Серебро, оксид серебра (I). Соли серебра и комплексные соединения серебра
Распространенность в природе
Занимает всего лишь 67-е место среди других элементов (7•10 -6 % по массе), однако в 20 раз превосходит золото. Встречается серебро в виде самородков с примесью золота, ртути и сурьмы; известны серебряные самородки весом до 13,5 тонн. Из минералов серебра наиболее важны серебряный блеск Ag2S и роговое серебро AgCl. Однако и самородное серебро, и его собственные минералы редки. Основная масса серебра извлекается в качестве побочного продукта при добывании других металлов, главным образом цинка и меди.
Серебро почти полностью отражает падающий свет. Лучше всех металлов серебро проводит тепло и электрический ток. По ковкости и тягучести оно уступает только золоту. Серебро тверже золота, но мягче меди. Чтобы сделать серебро более твердым, его сплавляют с медью.
Серебро довольно тяжелый металл (плотность 10,49 г/см 3 ), плавится при 961,9°С, а кипит при 2167°С.
ВСЕ О РИО КИСЛОТА + СОЛЬ ЗА 13 МИНУТ
Как и другие благородные металлы, серебро химически малоактивно, по сравнению с медью обладает значительно большей химической стойкостью. В отличие от меди, оно сохраняет металлический блеск при действии воздуха, влаги и углекислого газа. Но подобно меди серебро уже при комнатной температуре покрывается темным налетом сульфида серебра Ag2S, если потереть металл кусочком серы:
Темнеет серебро и на воздухе, содержащем сероводород и другие летучие соединения серы.
Свободные галогены при обычной температуре медленно соединяются с серебром:
Подобно меди серебро легко растворяется в разбавленной и концентрированной азотной кислоте с образованием нитрата серебра:
и в горячей концентрированной серной кислоте с образованием сульфата серебра:
В растворе цианистого натрия в присутствии кислорода воздуха серебро растворяется с образованием комплексного соединения:
Будучи в ряду напряжений металлов после водорода, серебро в кислотах-неокислителях не растворяется, не взаимодействует оно и с щелочами.
В соответствии со своим положением в I группе периодической системы серебро в большинстве соединений проявляет степень окисления +1 (одновалентно). Однако есть и производные серебра со степенью окисления +2 и +3, например AgO, AgF2. Проявление серебром высших степеней окисления объясняется тем, что в реакциях атома серебра может участвовать не только единственный валентный s-электрон внешней оболочки, но также один или два d-электрона предыдущей оболочки (конфигурация 4d 10 5s 1 ). Рассмотрим соединения, в которых серебро является одновалентным.
Ag2O — оксид серебра (I) — вещество буро-черного цвета, может быть получено только косвенным путем. Осаждается при введении ионов ОH — в раствор, содержащий ионы Ag + :
Оксид серебра (I) уже при 300°С разлагается на кислород и серебро:
В воде нерастворим, но растворим в водном растворе аммиака с образованием комплексной соли: Ag2O+4NH3+H2O=2[Ag(NH3)2]OH
ОГЭ/ЕГЭ/Соли азотной кислоты/общие свойства с другими солями/
Проявляет окислительные свойства, особенно по отношению к некоторым органическим веществам:
реакция «серебряного зеркала»
Из солей серебра следует отметить галогениды. Из галогенидов серебра в воде растворим фторид серебра AgF. Хлорид, бромид и иодид серебра отличаются очень слабой растворимостью в воде и разбавленных кислотах. Их получают действием соответствующих галогенидов натрия или калия на раствор нитрата серебра:
Образующиеся галогениды серебра выпадают в осадок в виде хлопьев (AgCl — белый, AgBr и AgI — желтоватые). Такие реакции имеют большое значение в аналитической химии: ионы серебра Ag + служат очень чувствительными реагентами на галогенид-ионы. Наименее растворимая соль серебра — сульфид серебра Ag2S. Из растворимых солей наиболее распространен нитрат се-
ребра AgNO3, его получают непосредственным растворением серебра в азотной кислоте. ,
Характерной особенностью солей серебра, как и других элементов побочных подгрупп I группы, является способность образовывать комплексные соединения с аммиаком, цианидами щелочных металлов и тиосульфатом натрия:
Все соли серебра легко восстанавливаются до металла. Нитрат серебра и его растворы, попав на кожу, оставляют на ней черные пятна мелкораздробленного серебра; отсюда старинное название AgNO3 — ляпис.
Цианирование служит основой добычи серебра из серебряных руд. Предварительно руду измельчают и обогащают. Затем обогащенный концентрат цианируют — переводят серебро в раствор действием NaCN в присутствии кислорода, образующийся цианидный комплекс серебра разрушают цинковой пылью по обменной реакции:
Полученный осадок серебра отправляют на переплавку, в процессе которой серебро очищается от примесей. В наше время основную часть серебра добывают в качестве побочного продукта при переработке свинцово-цинковых и медных руд.
Из серебра изготавливают специальное химическое оборудование и аппаратуру для пищевой промышленности. Значительное количество серебра идет на покрытие радиодеталей ответственного назначения, на серебрение проводов в высокочастотной радиотехнике, стекла и керамики в электронной аппаратуре.
Немалое количество серебра идет на производство серебряно-цинковых аккумуляторов. AgNO3 в медицине оказывает антисептическое действие. Идет на изготовление электролита для гальванического серебрения. Без труднорастворимых галогенидов серебра невозможно представить существование всей современной фото- и кинопромышленности.
Шире, чем само серебро, применяют его сплавы с другими металлами.
Источник: ollimpia.ru
ВНИМАНИЕ! Соли серебра ядовиты! Работать осторожно!
Катионы серебра образуют осадки со многими реагентами. Для открытия катионов Ag+ чаще всего используют осадительные реакции с анионами Cl — ,Br — ,I — ,CrO 2_ , а также окислительно-восстановительную реакцию, например, с формальдегидом HCHO (реакция «серебряного зеркала»).
Реакция с растворимыми хлоридами (фармакопейная), бромидами и йодидами. Катионы Ag+ при взаимодействии с растворимыми хлоридами, бромидами и йодидами образуют соответственно осадки: белый — хлорида серебра AgCl, желтоватый — бромида серебра AgBr и желтый — йодида серебра AgI:

Осадок хлорида серебра растворяется в концентрированном аммиаке с образованием комплекса [Ag(NH3)2]Cl:
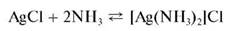
При подкислении раствора этого комплекса снова выпадает осадок
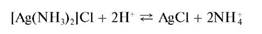
AgCl:
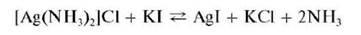
При прибавлении к раствору комплекса раствора йодида калия KI образуется осадок йодида серебра AgI:
Осадок AgCl растворяется также в концентрированных растворах HO и хлоридов, в присутствии цианида калия KCN, тиосульфата натрия Na2S2O3 с образованием растворимых комплексов:

Осадок AgBr малорастворим, а AgI — нерастворим в концентрированном аммиаке.
Открытию катионов Ag+ реакцией с хлорид-ионами мешают катионы Cu + ,Au + ,Tl + ,Pb 2+ , Hg 2+ , также образующие малорастворимые осадки хлоридов.
Методика. В одну пробирку вносят 2-3 капли раствора NaCl, в другую — столько же капель раствора NaBr, в третью — столько же раствора KI. В каждую пробирку добавляют по 3-5 капель раствора нитрата серебра AgNO3 Наблюдается помутнение растворов и выпадение осадков AgCl, AgBr и AgI.
Испытывают растворимость осадков, прибавляя в каждую пробирку по 5-10 капель концентрированного аммиака. При этом осадок AgCl растворяется полностью, осадок AgBr — частично, осадок AgI — не растворяется.
Раствор [Ag(NH3)2]Cl из первой пробирки делят на две примерно равные части. В одну из них прибавляют несколько капель раствора HNO3, в другую — несколько капель раствора KI. Наблюдается выпадение осадков AgCl и AgI соответственно.
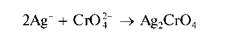
Реакция с хромат-ионами CrO 2 . — . При взаимодействии катионов Ag+ c хромат-ионами в нейтральной среде (рН «6,5-7,5) выделяется осадок хромата серебра Ag2CrO4 кирпично-красного цвета:
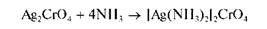
Осадок растворим в растворах кислот. В концентрированном аммиаке растворяется с образованием аммиачного комплекса серебра:
Если реакцию между Ag+ иCrO4 — проводить в щелочной среде, то вместо хромата серебра выпадает осадок оксида серебра Ag2O. В уксуснокислой среде образуется дихромат серебра Ag2Cr2O7 красно-бурого цвета.
Мешают все катионы, образующие малорастворимые хроматы (Sr 2 +, Ba 2 +, Hg 2 +,Hg 2 +,Pb 2 +,Bi 3 + идр.).
Методика. В пробирку вносят 2-3 капли раствора нитрата серебра AgNO3, прибавляют 1-2 капли раствора хромата калия K2CrO4 Выпадает кирпично-красный осадок.
Реакция с формальдегидом HCHO — реакция «серебряного зеркала» (фармакопейная). В присутствии в растворах восстановителей катионы Ag+ восстанавливаются до металлического серебра, которое, осаждаясь на стенках чистой пробирки, образует тонкую блестящую пленку — «серебряное зеркало». В качестве восстановителя часто применяют разбавленный раствор формальдегида в аммиачной среде при слабом нагревании (при сильном нагревании металлическое серебро выделяется в виде черно-бурого осадка). Вначале при реакции катионов Ag+ с
аммиаком образуется гидроксид серебра AgOH, переходящий в черно-бурый оксид серебра Ag2O, который растворяется в избытке аммиака с образованием аммиачного комплекса [Ag(NH3)2]+. Этот комплекс при взаимодействии с формальдегидом дает металлическое серебро. Реакцию можно описать схемой:
Мешают катионы ртути Hg 2+,Hg 2 +.
Методика. Вчистую, тщательно промытую (раствором хромовой смеси, а затем дистиллированной водой) пробирку вносят 3-4 капли раствора AgNO3, прибавляют несколько капель раствора аммиака до растворения выпавшего осадка оксида серебра Ag2O, несколько капель разбавленного раствора формальдегида и слегка нагревают пробирку (избегать сильного нагревания!). Стенки пробирки покрываются тонкой блестящей зеркальной пленкой металлического серебра.
Другие реакции катионов серебра. При взаимодействии катионов Ag+ с сероводородом H2S или растворимыми сульфидами образуется черно-коричневый осадок сульфида серебра Ag2S; с щелочами — черный осадок оксида серебра Ag2O; с тиоцианатом калия KSCN и с другими растворимыми тиоцианатами — белый осадок тиоцианата серебра AgSCN, растворимый в избытке реагента; с тиосульфатом натрия Na2S2O3 — белый осадок тиосульфата серебра Ag2S2O3, растворимый в избытке реактива; с гидрофосфатом натрия Na2HPO4 — желтый осадок фосфата (ортофосфата) серебра Ag3PO4; с ферроцианидом K4[Fe(CN)6] и феррицианидом K3[Fe(CN)6] калия — белый осадок Ag4[Fe(CN)6^ кирпично-красный осадок Ag3 [Fe(CN)6] соответственно. С дитизоном катионы Ag + образуют окрашенные комплексы. Известны и другие реакции катионов серебра.
Аналитические реакции катиона ртути(1) Hg 2+ ВНИМАНИЕ! Соединения ртути очень токсичны! Работать осторожно!
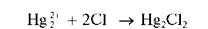
Реакция с хлорид-ионами. Катионы Hg 2 2 4 при взаимодействии с хлорид-ионами Cl — в растворах образуют белый осадок каломели Hg2Cl2:
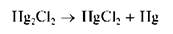
На свету осадок постепенно чернеет с выделением тонкодисперсной металлической ртути:

Осадок не растворяется в разбавленной, но растворяется в концентрированной азотной кислоте:
При прибавлении к осадку каломели раствора аммиака он темнеет вследствие выделения тонкодисперсной металлической ртути:
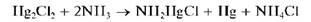
Методика. В пробирку вносят ~5 капель раствора нитрата ртути(I) Hg2(NO3)2 и прибавляют такое же количество раствора хлорида натрия. Выпадает белый осадок каломели. Осадок разделяют на две части. К одной части прибавляют концентрированную азотную кислоту — осадок растворяется.
К другой части прибавляют несколько капель раствора аммиака — осадок чернеет.
Восстановление Hg 2 + до металлической ртути хлоридом олова(П). Катионы ртути(I) при реакциях с восстановителями дают металлическую ртуть.
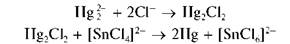
Так, при реакции Hg2+ с хлоридом олова(II) выделяющийся вначале белый осадок каломели Hg2Cl2 постепенно чернеет вследствие образования тонкодисперсной металлической ртути при восстановлении Hg 2 + оловом(II):
Мешают катионы ртути(II) Hg 2 +, также восстанавливающиеся до металлической ртути.
Методика. В пробирку вносят ~2 капли раствора нитрата ртути(I) Hg2(NO3)^ прибавляют ~2 капли раствора хлорида олова(II). Выпадает белый осадок каломели, постепенно чернеющий за счет выделения металлической ртути.
Восстановление Hg2+ металлической медью. Катионы Hg 2 + восстанавливаются металлической медью до металлической ртути, образующей с медью амальгаму меди:
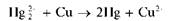
Мешают катионы ртути(II) Hg 2 +, дающие такой же эффект.
При нагревании ртуть улетучивается (отличие от аналогичной реакции с солями серебра).
Методика. На свежеочищенную (промытую раствором аммиака и затем дистиллированной водой или протертую наждаком) медную поверхность (например, на медную монету) наносят каплю раствора Hg2(NO3)2 Через некоторое время на поверхности образуется серое пятно амальгамы меди, которое после протирания поверхности мягкой тканью или сухой фильтровальной бумагой становится блестящим.
Если медную монету полностью погрузить в раствор Hg2(NO3)2^ затем, после извлечения из раствора, через некоторое время протереть мягкой тканью или сухой фильтровальной бумагой, то вся монета становится блестящей.
Реакция с водным раствором аммиака. Катионы Hg 2 2 4 реагируют с аммиаком в водном растворе с образованием черного осадка, представляющего собой смесь тонкодисперсной металлической ртути и соли, содержащей катион [OHg2NH2]NO3Если в качестве соединения ртути(1) использовать нитрат Hg2(NO3)2, то реакцию можно описать схемой:
Методика. В пробирку вносят 2-3 капли раствора нитрата ртути(1) Hg2(NO3)2 и прибавляют ~5 капель раствора аммиака. Выпадает черный осадок.
Реакция с йодидами. Катионы Hg2+ образуют при взаимодействии с йодид-ионами 1 — зеленый осадок йодида ртути(1) Hg2I2, растворимый в избытке реактива с образованием бесцветного комплексного тетрайо-домеркурат(П)-иона [HgI4] 2 ^ черного осадка тонкодисперсной металлической ртути:

Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют одну каплю раствора йодида калия KI. Выпадает осадок Hg2I2. Добавляют избыток (~5-10 капель) раствора KI. На дне пробирки под бесцветным раствором остается черный осадок металлической ртути.

Реакция с хромат-ионами. Катионы Hg 2 + образуют с хромат-ионами CrO 2 . — кирпично-красный осадок хромата ртути(!) Hg2CrO4:
Мешают все катионы, образующие малорастворимые хроматы (Sr 2+ , Ba 2 +,Pb 2 + идр.).
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2,при-бавляют 1-2 капли раствора хромата калия K2CrO4Выпадает красный осадок хромата ртутив).

Реакция с щелочами. Щелочи (NaOH, KOH) выделяют из растворов, содержащих катионы Hg2+, черный осадок оксида ртутив) Hg2O:
Осадок растворяется в азотной и концентрированной уксусной кислотах.
Методика. В пробирку вносят 3-4 капли раствора Hg2(NO3)2 ипри-бавляют 2-3 капли раствора NaOH или KOH. Выделяется черный осадок оксида ртути^).
Другие реакции катионов ртути(^. Катионы Hg 2 + образуют осадки при реакциях: с сульфид-ионами S 2- — черный HgS + Hg; с иодат-ионами IO — — желтый Hg2(IO3)2; с оксалат-ионами QO 2 . — — белый Hg2C2O4; с фосфат-ионами — белый (Hg2)3(PO4)2; с карбонат-ионами — желтый Hg2CO3 (быстро темнеющий вследствие разложения по схеме: Hg2CO3 -> HgO + Hg + CO2); с K4[Fe(CN)6]иK3[Fe(CN)6] — соответственно бледно-желтый и желто-зеленый ферро- и феррициани-ды ртути.
С дифенилкарбазидом катионы Hg 2 2 4 образуют комплексы синего цвета.
Аналитические реакции катиона свинца Pb 2 +
Источник: mydocx.ru
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).

Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4 + и анионы NO2 — , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 о С. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4] — и [Zn(OH)4] 2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Источник: scienceforyou.ru