В простых соединениях у кобальта наиболее устойчива степень окисления +2, в комплексных – +3. Водные растворы солей кобальта (II) обычно окрашены в розовый цвет.
Гидроксид кобальта (II)
Образуется при действии щелочей на соли кобальта (II):
На воздухе розовый осадок Co(OH)2 постепенно буреет, превращаясь в гидроксид кобальта (III):
Сo(OH)2 — слабое основание, растворимое в сильных кислотах:
При прокаливании Co(OH)2 образует оксид кобальта (II) CoO:
Cсоединения кобальта склонны к комплексообразованию (координационное число=6):
Никель и его соединения
Никель легко растворяется в разбавленной азотной кислоте и медленно в соляной и серной кислотах: Ni + 2HCl → NiCl2 + H2↑. Ион Ni 2+ в водных растворах имеет зелёную окраску. Для никеля наиболее характерна степень окисления +2. Оксид и гидроксид никеля проявляют основный характер:
Кобальт для пчёл. Сколько соли и кобальта давать пчёлам.
NiCl2 + 2NaOH → Ni(OH)2↓(зелёный) + 2NaCl;
Гидроксид никеля (П) может давать комплексы с аммиаком:
ПОДГРУППА МАРГАНЦА
Побочная подгруппа VII группы
Свойства элементов подгруппы марганца
| Атомный номер | Название | Электронная конфигурация | ρ, г/см 3 | ЭО | Атомный радиус, нм | Степень окисления |
| Марганец Mn | [Ar] 3d 5 4s 2 | 7,45 | 1,6 | 0,131 | +2,+3,+4, +5,+6,+7 | |
| Технеций Tc | [Kr] 4d 5 5s 2 | 11,5 | 1,36 | 0,136 | +2,+3,+4, +5,+6,+7 | |
| Рений Re | [Xe] 4f 14 5d 5 6s 2 | 20,53 | 1,46 | 0,137 | +3,+4,+5, +6,+7 |
Физические свойства:
Серебристо-белые, тугоплавкие металлы.
Химические свойства
· В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H + → Mn 2+ + H2↑
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
· С увеличением степени окисления металлов у силивается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Марганец и его соединения
Марганец
Получение
Марганец получают алюмотермическим способом из природного соединения MnO2: 3MnO2 + 4Al → 2Al2O3 + 3Mn
Химические свойства
Mn — металл средней активности. На воздухе покрывается тонкой оксидной плёнкой. Реагирует с неметаллами, например, с серой:
Растворяется в кислотах: Mn + 2HCl → MnCl2 + H2↑. При этом образуются соединения двухвалентного марганца.
Соединения Mn(II)
Оксид марганца (II). MnO получается восстановлением природного пиролюзита MnO2 водородом:
Гидроксид марганца (II). Mn(OH)2 — светло-розовое нерастворимое в воде основание:
Кобальт — Металл из Кошачьего Туалета!
Mn 2+ + 2OH — → Mn(OH)2
Легко растворимо в кислотах:
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
При действии сильных окислителей наблюдается переход Mn 2+ в MnO4 — :
2Mn(OH)2 + 5Br2 + 12NaOH – кат. CuSO 4 → 2NaMnO4 + 10NaBr + 8H2O;
Оксид марганца (IV). MnO2 — тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C). Сильный окислитель:
При сплавлении с содой и селитрой образует манганат натрия тёмно — зелёного цвета:
Манганаты могут быть получены также восстановлением перманганатов в щелочной среде:
Гидролиз манганатов (реакция диспропорционирования) протекает по схеме:
3MnO4 2 — + 2H2O → 2MnO4 — + MnO2 + 4OH —
За способность обратимо менять окраску манганат калия называют «минеральным хамелеоном».
Оксид марганца (VII) Mn2O7 — тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцовая кислота HMnO4 нестабильна):
При растворении Mn2O7 в щелочах образует перманганаты:
Перманганат калия KMn +7 O4 — тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
MnO4 2 — — сильный окислитель, в кислой среде восстанавливается до Mn 2+ , в нейтральной – до Mn +4 O2, а в щелочной – до Mn +6 O4 2 — .
ПОДГРУППА ХРОМА
Подгруппа хрома — побочная подгруппа VI группы
Свойства элементов подгруппы хрома
| Атомный номер | Название | Электронная конфигурация | ρ г/см 3 | ЭО | Атомный радиус, нм | Степень окисления |
| Хром Cr | [Ar] 3d 5 4s 1 | 7,2 | 1,56 | 0,125 | +1,+2,+3, +4,+5,+6 | |
| Молибден Mo | [Kr] 4d 5 5s 1 | 10,2 | 1,3 | 0,135 | +1,+2,+3, +4,+5,+6 | |
| Вольфрам W | [Xe] 4f 14 5d 4 6s 2 | 19,3 | 1,4 | 0,141 | +1,+2,+3, +4,+5,+6 |
Физические свойства
Блестящие, сероватого цвета металлы. С увеличением атомного номера растут температуры плавления и кипения. Вольфрам — самый тугоплавкий из известных металлов.
Химические свойства
В ряду Cr – Mo – W химическая активность падает. С увеличением степени окисления элементов у их оксидов и гидроксидов закономерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO3 соответствуют кислоты H2RO4. В том же направлении происходит усиление окислительных свойств соединений.
Хром и его соединения
Получение
· Хром можно получить алюмотермическим способом:
· Восстановлением оксидов оксидом углерода (II);
· Электролизом водных растворов соединений хрома.
При обычных условиях хром реагирует только с фтором. При высоких температурах (выше 600ºC) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором:
2Cr + N2 – tºC → 2CrN; 2Cr + 3S – tºC → Cr2S3;
· В раскалённом состоянии реагирует с парами воды:
· Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4).
В отсутствии воздуха образуются соли Cr 2+ , а на воздухе – соли Cr 3+ :
Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Соединения хрома (П)
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
Соединения хрома(111)
Оксид хрома (III)Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Гидроксид хрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах: 2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O;
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия. Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
2Cr +3 Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2Cr +6 O4
Соединения хрома (VI)
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия действием H2SO4 (конц.):
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO4 2 — :
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O7 2 — :
В щелочной среде эта реакция протекает в обратном направлении:
| кислая среда | ||
| 2CrO4 2 — + 2H + | ◄–––––––––––– ––––––––––––► | Cr2O7 2 — + H2O |
| щелочная среда |
Все соединения хрома (VI) — сильные окислители. Например,
ПОДГРУППА ВАНАДИЯ
Источник: poisk-ru.ru
Химические свойства соединений кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого Kobold — домовой, гном. Соединения кобальта были известны и применялись в глубокой древности. Сохранился египетский стеклянный кувшин, относящийся к ХV в. до н.э., окрашенный солями кобальта, а также голубые стекловидные кирпичи, содержащие кобальт.
В древней Ассирии, а также в Вавилоне из кобальта изготовляли лазурит — голубую краску, которой обливали керамические изделия. Вероятно, исходным материалом для получения кобальтовых соединений служил тогда цаффер (Zaffer) — сапфир, содержащий висмут и кобальт; откуда, по-видимому, и произошли названия красок — сафлор, шафран и др.
В средние века горняки находили вместе с другими рудами кобальтовую «землю», но не знали, что с ней делать. Иногда эта земля была похожа на серебряную руду, но не содержала никакого серебра. Примесь кобальтовой земли к другим рудам мешала выплавке металлов: с образующимся густым дымом (сульфидов и арсенидов) терялась часть выплавляемого металла.
Еще в IV в. у Псевдодемокрита и других авторов встречаются слова, означающие дым, образующийся при обжигании руд, содержащих сульфиды мышьяка. В средние века немецкие горняки, очевидно, желая подчеркнуть свойства кобальтовых земель, называли их коб-ольд (или кобельт), что означало подземный гном, насмешливый дух, бессовестный плут. В древнерусском языке имеются близкие по смыслу слова кобение (гадание), кобь (гадание по птичьему полету); последнее слово интересно сравнить с современным названием птицы — кобчик.
Кобальт упоминается у Бирингуччо, Василия Валентина, Парацельса и других авторов XV — XVII вв. В «Алхимическом лексиконе» Руланда (1612) о кобальте говорится: «Кобол кобальт (Koboltum, Kobaltum) или коллет (Colletum) — металлическая материя, чернее свинца и железа, растягивающаяся при нагревании.
Кобальт — черная, немного похожая по цвету на золу материя, которую можно ковать и лить, но она не обладает металлическим блеском, и которая представляет собой вредную взвесь, уводящую (при плавке) вместе с дымом хорошую руду». Очевидно, здесь говорится о металлическом кобальте.
Тем не менее в истории химии принято считать, что металлический кобальт был впервые описан в 1735 г. упсальским профессором Брандтом. В диссертации «О полуметаллах» Брандт указывает, в частности, что получаемый из руд металлический висмут не представляет собой чистого металла, а содержит «кобальтовый королек» (металлический кобальт). Он же выяснил, что соли кобальта окрашивают стекла в синий цвет. В чистом виде металлический кобальт был получен Верцелиусом.
В русской литературе XVIII и начала XIX в. встречаются названия кобольт, коболт (Соловьев и Страхов, 1824 и в более ранних сочинениях по химии). Двигубский (1824) употребляет название кобальт; в дальнейшем оно становится общепринятым.
Часть 2
Характеристика кобальта
Характеристика кобальта по положению в периодической системе. Электронная формула
Со, химический элемент с атомным номером 27. Его атомная масса 58,9332. Природный кобальт состоит из двух стабильных нуклидов: 59 Со (99,83% по массе) и 57 Со (0,17%). В периодической системе элементов Д. И. Менделеева кобальт входит в группу VIII и вместе с железом и никелем образует в 4-м периоде в этой группе триаду близких по свойствам переходных металлов. Конфигурация двух внешних электронных слоев атома кобальта 3s 2 p 6 d 7 4s 2 . Образует соединения чаще всего в степени окисления +2, реже — в степени окисления +3 и очень редко в степенях окисления +1, +4 и +5.
Радиус нейтрального атома кобальта 0,125 Нм, радиус ионов (координационное число 6) Со2+ — 0,082 Нм, Со3+ — 0,069 Нм и Со4+ — 0,064 Нм. Энергии последовательной ионизации атома кобальта 7,865, 17,06, 33,50, 53,2 и 82,2 ЭВ.
Нахождение кобальта в природе
Содержание кобальта в земной коре составляет около 0,003%. Однако, большая часть кобальта сосредоточена в центральном ядре Земли, где преобладают элементы группы железа. В литосфере кобальта содержится в среднем около 0,003 вес.%, кобальт находится в железных (около 0,6%) и каменных (0,08) метеоритах.
Ничтожные количества кобальта имеются в морской воде (10 -7 %) и в воде минеральных источников. Кобальт входит в состав более 30 минералов. К ним относятся каролит CuCo2SO4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. Как правило, кобальту в природе сопутствуют его соседи по 4-му периоду — никель, железо, медь и марганец.
Получение кобальта
Кобальт — относительно редкий металл, и богатые им месторождения в настоящее время практически исчерпаны. Поэтому кобальтсодержащее сырье (часто это никелевые руды, содержащие кобальт как примесь) сначала обогащают, получают из него концентрат. Далее для извлечения кобальта концентрат или обрабатывают растворами серной кислоты или аммиака, или методами пирометаллургии перерабатывают в сульфидный или металлический сплав. Этот сплав затем выщелачивают серной кислотой. Иногда для извлечения кобальта проводят сернокислотное «кучное» выщелачивание исходной руды (измельченную руду размещают в высоких кучах на специальных бетонных площадках и сверху поливают эти кучи выщелачивающим раствором).
Для очистки кобальта от сопутствующих примесей все более широко применяют экстракцию. Наиболее сложная задача при очистке кобальта от примесей — это отделение кобальта от наиболее близкого к нему по химическим свойствам никеля. Раствор, содержащий катионы двух этих металлов, часто обрабатывают сильными окислителями — хлором или гипохлоритом натрия NaOCl
2СоСl2 + NaClO + 4NaOH + H2O Õ 2Co(OH)3↓ + 5NaCl
чёрный осадок Co(OH)3 прокаливают для удаления воды, а полученный оксид Со3О4 восстанавливают водородом или углеродом. Металлический кобальт, содержащий до 2-3% примесей (никель, железо, медь), может быть очищен электролизом.
Химические свойства кобальта
нормальный электродный потенциал реакции Со – 2е ↔ Со 2+
φ0 = — 0,27 В, а реакции Со – 3е ↔ Со 3+ φ0 = +0,4 В. Окислительно – восстановительный потенциал кобальта в кислых растворах для реакции Со 2+ Õ Со 3+ + е равен 1,81 В, а реакции Со Õ Со 3+ + +3е 0,4 В. Степень окисления +2,+3. Электрохимический эквивалент Со 2+ равен 0,306мг/Кл, а Со 3+ 0,204мг/Кл.
В простых соединениях наиболее устойчив ион Со 2+ , в комплексных — ион Со 3+ . В электрохимическом ряду напряжений металлов кобальт расположен между железом и никелем. Он взаимодействует почти со всеми другими элементами. Так, при нагревании кобальт легко соединяется с галогенами, образуя галогениды.
При действии фтора на порошок кобальта или СоСl2 кобальт может восстановиться до 3-валентного и образовать коричневый фторид СоF3 . Также при нагревании кобальт взаимодействует с серой, селеном, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, причем проявляет валентность от +1 до +6. Сульфиды кобальта образуются в результате взаимодействия свежевосстановленного кобальтового порошка с Н2S. При 400 ˚С образуется Со3S4, а при 700 ˚С – СоS. Сульфид образуется и при взаимодействии кобальта с сернистым ангидридом при 800˚С.
В разбавленных соляной и серной кислотах кобальт медленно растворяется с выделением водорода и образованием хлорида СоСl2 или сульфата СоSO4. Разбавленная азотная кислота растворяет кобальт с выделением оксидов азота и образованием нитрата Со(NO3)2. Концентрированная азотная кислота пассивирует кобальт. Все соли кобальта хорошо растворимы в воде. Едкие щелочи осаждают из водных растворов солей синий гидроксид Со(ОН)2 .
При взаимодействии с газообразным аммиаком при 350-450 ˚С кобальт образует нитриды Со3N и Co2N2 , которые, не являются устойчивыми.
Кобальт реагирует с водой при нагревании и в интервале 422-921˚С вытесняет водород, образуя СоО.
Химические свойства соединений кобальта
Известны окислы и гидроокиси двух-, трех- и четырехвалентного кобальта.
Окислы и гидроокиси двухвалентного кобальта. Закись кобальта СоО образуется при окислении металлического кобальта парами воды при температуре красного каления, а также при нагревании карбонатов, сульфатов.

Со 2+ +Н2О t красного каления Со + Н2
Закись кобальта имеет серо-зеленый цвет с различными оттенками в зависимости от способа получения.
Закись кобальта легко растворяется в соляной, серной, азотной и других сильных кислотах, труднее – в уксусной, фтористоводородной кислотах с образованием соответствующих солей двухвалентного кобальта розового цвета
Гидроокись двухвалентного кобальта образуется при добавлении едкого натра или гидроокиси аммония к растворам солей двухвалентного кобальта
При обычной температуре, особенно без доступа воздуха, и при осаждении небольшим избытком раствора гидроокиси натрия сначала образуется синий осадок. Синий осадок постепенно становится фиолетовым и, наконец, розовым.
Гидроокись кобальта окисляется кислородом воздуха, превращаясь в Со(ОН)3 с изменением цвета из розового в бурый. Окисление ускоряется добавлением хлора, брома или перекиси водорода.
При незначительном нагревании происходит превращение Co(OH)2 в НСоО2, а затем в Со3О4; при более высокой температуре Со3О4 превращается в СоО.
Закись-окись кобальта Со3О4 образуется при нагревании закиси кобальта СоО (400-900°С) и при сгорании пирофорного кобальта на воздухе. Она получается также при нагревании гидроокиси кобальта

 Со(ОН)3 120-190°С НСоО2 240-300°С Со3О4
Со(ОН)3 120-190°С НСоО2 240-300°С Со3О4

Со3О4 770-920°С 3СоО + ½ О2
Закись-окись Со3О4 медленно растворяется в кислотах с образованием солей двухвалентного кобальта и выделением свободного кислорода. Растворение в соляной кислоте сопровождается выделением хлора
Окись Со2О3 и гидроокись трехвалентного кобальта Со(ОН)3.
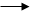
Со2О3 +H2S CoS + O2 + H2O

Co(OH)3 + H2S CoS + O2 + H2O
Простые ионы трехвалентного кобальта в водных растворах неустойчивы, они легко восстанавливаются до ионов двухвалентного кобальта.
Окись четырехвалентного кобальта СоО2.
Этот окисел частично образуется при получении Со2О3. Он неустойчив, легко разлагается с выделением кислорода.
Соли кобальта.
Сульфид кобальта СоS – черного цвета, выделяется пропусканием сероводорода в нейтральные воды раствора солей кобальта, содержащие ацетат натрия или добавлением раствора сульфида аммония и слабощелочным водным раствором солей кобальта.
Образования, которые можно получить при действии сульфида аммония (или сероводорода) на водные растворы солей кобальта, при прямом соединении элементов при высоких температурах можно также получить сульфид кобальта Со5S4 и др. в природе встречается минерал линнеит Со3S4, который можно получить искусственно.
Сульфат кобальта СоSO4 и СоSO4 ∙ 7 H2O. Безводный сульфат кобальта используется как весовая форма при определении кобальта.
Тиосульфат кобальта СоS2О3 мало диссоциирует.
Дата добавления: 2019-07-15 ; просмотров: 2101 ; Мы поможем в написании вашей работы!
Источник: studopedia.net
Соединения кобальта
Соединения со степенями окисления –1 и 0. Простейший карбонил кобальта Со2(СО)8 – двухядерное соединение. Это оранжевые кристаллы (т.пл. 51 С), нерастворимые в воде, но хорошо растворимые в органических растворителях, при 60 С начинает разлагаться.

Для кобальта получены четырехядерный карбонил состава [Со4(CO)12], а также жидкий трикарбонил(нитрозил)кобальт состава [Со(CO)3(NO)].
При нагревании Со2(СО)8 под давлением водорода образуется гидридокарбонил (карбонилгидрид), который можно рассматривать как соединение кобальта в степени окисления –1.
Соединения со степенью окисления +2. Степень окисления +2 характерна для кобальта. Оксид – СоО – серо-зеленые кристаллы, образуется при взаимодействии простых веществ или термическим разложением гидроксида или карбоната кобальта(II).
Гидроксид кобальта(II) нерастворим в воде, существует в двух модификациях: синяя модификация образуется при действии щелочей на соли кобальта(II) на холоду, при нагревании она переходит в розовую модификацию. У оксида и гидроксида кобальта(II) доминируют основные свойства.
Кобальт(II) образует разнообразные соли и галогениды. Нитраты, сульфаты, галогениды за исключением СоF2 хорошо растворимы в воде. Аквакомплексы [Co(H2O)6] 2+ придают растворам ярко-розовую окраску, такая же окраска характерна для кристаллогидратов.
Безводные галогениды, тиоцианид, сульфат и другие соли кобальта(II) могут присоединять молекулы аммиака с образованием координационных аммиакатов [Co(NH3)6] 2+ , которые устойчивее аналогичных комплексов железа(II), но водой все же разрушаются:
Поэтому реакция образования аммиакатов проводится в избытке аммиака и в присутствии NH4Cl.
Анионные координационные соединения кобальта(II) имеют обычно тетраэдрическую структуру [CoХ4] 2- (Х = Сl — , Br — , I — , SCN — , OH — ), окрашены в синий и фиолетовый цвета. Ниже приведены примеры образования анионных комплексов:
Реакция образования синего тетратиоцианатокобальтата(II) используется в аналитической химии для определения катионов кобальта(II). Большинство координационных соединений анионного типа при разбавлении их растворов разрушаются, образуя [Co(H2O)6] 2+ розового цвета.
Координационные соединения кобальта(II) – сильные восстановители. Например, аммиакаты легко окисляются даже молекулярным кислородом воздуха:
Соединения со степенью окисления +3. Бинарные соединения и соли для кобальта(III) нехарактерны. Относительно устойчив Со3О4, являющийся смешанным оксидом СоОСо2О3. Его получают осторожным нагреванием Co(NО3)2 при ~700 С. Это соединение является сильным окислителем:
Со(III) образует большое число катионных и анионных комплексов. Аквакомплекс [Co(H2O)6] 3+ неустойчив, так как является сильным окислителем и окисляет даже воду:
Из координационных соединений катионного типа наиболее устойчивы аммиакаты. Комплекс [Co(NH3)6] 3+ желтого цвета устойчив даже по отношению к концентрированной HCl, и медленно разрушается только в присутствии H2S и NaOH.
Из анионных комплексов наиболее устойчивы соединения состава М3 +1 [Co(CN)6] и М3 +1 [Co(NО2)6]. Гексанитритокобальтаты подгруппы калия малорастворимы в воде; образование желтого осадка К3[Co(NО2)6] используется в аналитической химии для обнаружения катионов калия. Из комплексных галогенидов выделен только гексафторокобальтат К3[CoF6].
Источник: studfile.net