В соответствии с конфигурацией внешних электронов атома 5s 2 5р 2 Олово имеет две степени окисления: +2 и +4; последняя более устойчива; соединения Sn (II) — сильные восстановители. Сухим и влажным воздухом при температуре до 100 °С олово практически не окисляется: его предохраняет тонкая, прочная и плотная пленка SnO2. По отношению к холодной и кипящей воде олово устойчиво. Стандартный электродный потенциал Олова в кислой среде равен -0,136 в.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:
Из разбавленных НCl и H2SO4 на холоду олово медленно вытесняет водород, образуя соответственно хлорид SnCl2 и сульфат SnSO4. В горячей концентрированной H2SO4 при нагревании Олово растворяется, образуя Sn(SO4)2 и SO2. Холодная (0°С) разбавленная азотная кислота действует на олово по реакции:
Взаимодействие олова с разбавленными кислотами. Опыт 1
При нагревании с концентрированной HNO3 (плотность 1,2-1,42 г/мл) олово окисляется с образованием осадка метаоловянной кислоты H2SnO3, степень гидротации которой переменна:
При нагревании Олова в концентрированных растворах щелочей выделяется водород и образуется гексагидростаниат:
Кислород воздуха пассивирует Олово, оставляя на его поверхности пленку SnO2. Химически оксид (IV) SnO2 очень устойчив, а оксид (II) SnO быстро окисляется, его получают косвенным путем. SnO2 проявляет преимущественно кислотные свойства, SnO — основные.
С водородом олово непосредственно не соединяется; гидрид SnH4 образуется при взаимодействии Mg2Sn с соляной кислотой:
Это бесцветный ядовитый газ, tкип -52 °С; он очень непрочен, при комнатной температуре разлагается на Sn и H2 в течение нескольких суток, а выше 150°С — мгновенно. Образуется также при действии водорода в момент выделения на соли Олова, например:
С галогенами олово дает соединения состава SnX2 и SnX4. Первые солеобразны и в растворах дают ионы Sn 2+ , вторые (кроме SnF4) гидролизуются водой, но растворимы в неполярных органических жидкостях. Взаимодействием олова с сухим хлором (Sn + 2Cl2 = SnCl4) получают тетрахлорид SnCl4; это бесцветная жидкость, хорошо растворяющая серу, фосфор, иод. Раньше по приведенной реакции удаляли Олово с вышедших из строя луженых изделий. Сейчас способ мало распространен из-за токсичности хлора и высоких потерь олова.
Тетрагалогениды SnX4 образуют комплексные соединения с Н2О, NH3, оксидами азота, РСl5, спиртами, эфирами и многими органическими соединениями. С галогеноводородными кислотами галогениды Олова дают комплексные кислоты, устойчивые в растворах, например H2SnCl4 и H2SnCl6. При разбавлении водой или нейтрализации растворы простых или комплексных хлоридов гидролизуются, давая белые осадки Sn(OH)2 или Н2SnО3·nН2О. С серой Олово дает нерастворимые в воде и разбавленных кислотах сульфиды: коричневый SnS и золотисто-желтый SnS2.
Ступко Т.В. Элементы IV А группы Германий, Олово, Свинец
Источник: www.allmetals.ru
Окислительно-восстановительные свойства олова и свинца
Задание 365
Какая степень окисления наиболее характерна для олова и, какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение:
Для олова в одинаковой степени характерны степени окисления +2 и +4. Для олова в одинаковой степени характерны степени окисления +2 и +4.
Для свинца наиболее характерна степень окисления +2 и в меньшей степени +4.
Уравнения реакций олова и свинца с концентрированной азотной кислотой:
а) При взаимодействии олова с концентрированной азотной кислотой образуются — оловянная кислота H2SnO3 и оксид азота (IV) NO2:
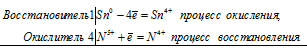
Sn 0 + 4N 5+ = Sn 4+ + 4N4 +
б) При взаимодействии свинца с концентрированной азотной кислотой образуются нитрат свинца Pb(NO3)2 и оксид азота (IV) NO2:
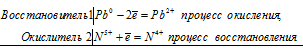
Pb 0 + 2N 5+ = Pb 2+ + 2N 4+
Задание 366
Чем можно объяснить восстановительные свойства олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: а) SnCl2 с НgCl2; б) РЬО2 с НСl (конц.).
Решение:
Олово и свинец на внешнем энергетическом уровне содержат по четыре электрона. Так как олово (II) на внешнем энергетическом уровне содержит два электрона, то оно может их отдать, т. е. проявить свойства восстановителя. Свинец (IV) на внешнем энергетическом уровне не содержит электронов, поэтому свинец (IV) может присоединить недостающие электроны, проявив при этом свойства окислителя. Свинец в степени окисления +4 может только присоединять электроны, поэтому проявляет только свойства окислителя, олово в степени окисления +2 может и отдавать, и присоединять по два электрона, проявляя при этом свойства или восстановителя, или окислителя.
а) Реакция SnCl2 с НgCl2

Sn 2+ + 2Hg 2+ = Sn 4+ + 2Hg +
б) Реакция РЬО2 с НСl (конц.).
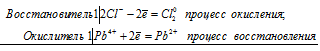
Pb 4+ + 2Cl — = Pb 2+ + Cl2 0
Задание 367
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение:
Олово и свинец образуют оксиды и диоксиды: PbO, PbO2, SnO, SnO2.
SnO и PbO образуют гидроксиды Sn(OH)2 и Pb(OH)2, которые проявляют амфотерные свойства. У Pb(OH)2 преобладают основные свойства, он растворяется только в концентрированном растворе щёлочи. У Sn(OH)2 преобладают кислотные свойства.
Оксидам PbO2 и SnO2 отвечают гидроксиды H2SnO3 и H2PbO3 – слабые кислоты. Причём кислотные свойства их ослабевают в ряду H2SnO3 — H2PbO3. Основные свойства в ряду Sn(OH)2 — Pb(OH)2 усиливаются.
Уравнения реакции взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II):
а) Sn +2NaOH + 4H2O = Na2[Sn(OH)6] + 2H2↑ (молекулярная форма);
Sn + 2OH – + 4H2O = [Sn(OH)6] 2- + 2H2↑ (ионно-молекулярная форма)
б) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] (молекулярная форма);
Pb(OH)2 + 2OH — = [Pb(OH)4] 2- (ионно-молекулярная форма).
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Периодическая система элементов. Степень окисления. Электроотрицательность | Задания 41 — 46
Источник: buzani.ru
Какие степени окисления наиболее характерны для олова и свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.


⚡ Условие + 37% решения:
Какие степени окисления наиболее характерны для олова и свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
Решение: Для олова одинаково характерны степени окисления + 2 и +4. Свинец в соединениях находится преимущественно в степени окисления + 2. При взаимодействии с концентрированной азотной кислотой олово ведет себя как неметалл. Образуется оловянная кислота H2SnO3.
Готовые задачи по химии которые сегодня купили:
- Какие из перечисленных солей будут подвергаться гидролизу: ZnSO4, K2SO4, Na2SO3.
- Могут ли самопроизвольно протекать следующие реакции в стандартных условиях? Fe2O3(к)
- Какие вещества называют окислителями, какие – восстановителями?
- Проводим предварительный расчет интервала объемов раствора серебра нитрата.
- Составить схему гальванического элемента, в котором электродами являются два нижеприведенных металла, опущенные в растворы их солей, с концентрацией ионов 1 моль/л. Определить какой металл является анодом, какой – катодом? Описать процессы, которые протекают на катоде и аноде, и вычислить ЭДС гальванического элемента.
- Как зависит скорость химической реакции от концентраций реагирующих веществ?
- При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
- Соотнесите испытания, проводимые при установлении прозрачности, степени мутности и окраски водных растворов с раствором сравнения.
- Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
- Какие факторы влияют на скорость химических реакций?





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com