Что не реагирует с калием?
Интересно отметить, что с азотом (N) калий не взаимодействует. Важнейшие соединения калия: оксид К2О, пероксид К2О2, супероксид К2О4, гидроксид КОН, иодид KI, карбонат K2CO3 и хлорид KCl. Al2O3 + 2KOH = 2KAlO2 + H2O (так реакция протекает при сплавлении реагентов).
В каком виде встречается калий?
Обозначается символом K (лат. Kalium). Простое вещество калий — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Для чего используется калий?
— КОН (гидроксид калия) применяют в аккумуляторах, для осушения газов. — Поташ (углекислый калий) используют для получения поташного оптического стекла, в производстве удобрений, в процессах очистки газов, осушения, дубления кож. — Пероксид и супероксид калия поглощают углекислый газ и выделяют кислород.
Калий от гипертонии, инсульта, остеопороза, камней в почках и диабета.
Как реагирует с водой калий?
С калием нужно обращаться очень осторожно. На воздухе он может самовозгораться. Кусочек калия поместим в чашку Петри с водой. Калий так энергично реагирует с водой, что выделяющийся в реакции водород загорается.
Что реагирует с калием?
Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния. Калий хранят под слоем керосина.
Как принимать препараты калия?
Обычная суточная доза для взрослых составляет 1–2 таблетки 3 раза в сутки. Дозу можно повысить до 3 таблеток 3 раза в сутки.
Как получить калий в промышленности?
Металлический калий получают путём обменных реакций между металлическим натрием и гидрооксидом или хлоридом калия, а также электролизом расплавов KOH.
В чем содержится калий?
Калия достаточно в таких продуктах: продукты из мяса, многие крупы, картофель в мундире, отруби пшеницы, зеленый горошек и бобы, ростки пшеницы. Много этих микроэлементов: в моркови, тыкве, свекле, редьке, перце, капусте, огурце, авокадо. В зелени, а особенно много в петрушке и шпинате.
Каким способом можно получить калий?
Калий, рубидий и цезий можно получить электролизом расплава их солей, однако на практике таким способом их не получают из-за их высокой химической активности.
Как лучше усваивается калий?
Калий хорошо усваивается, особенно в присутствии пиридоксина (90–95%). Достаточное поступление магния с пищей обеспечивают цельные злаки, зеленые листовые овощи, орехи и др. Он также содержится в хлорофилле растений, морских и сине-зеленых водорослях.
Что означает слово калий?
КА́ЛИЙ, -я, м. Химический элемент, металл серебристо-белого цвета, добываемый из углекалиевой соли (поташа).
Как щелочные металлы реагируют с водой?
Взаимодействие с водой
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом: 2M + 2H2O = 2MOH + H2.
Что взрывается в воде?
Металлический натрий взаимодействует с водой, образуется водород, который в присутствии кислорода воздуха стремительно окисляется — взрывается. . При реакции щелочного металла с водой получается водород, а также пары воды, поскольку металл сильно разогревается.
Почему калий взрывается в воде?
При реакции с водой, калий загорается и взрывается. Калий настолько активный, что даже может вытягивать кислород из молекул целлюлозы, из которых состоит бумага.
Источник: openvorkuta.ru
Калий — характеристика химического элемента и основные свойства

Человеческий мозг непрерывно обучается. Нет разницы, чем мы занимаемся и какие конкретно действия повторяем день изо дня. Для прочного закрепления привычки требуется постоянное повторение и мозг обязательно обучится новому, даже претерпит изменения в своём физическом теле. Когда-то учёные начали узнавать наш мир.
Они составляли причинно-следственные связи и удивлялись, открывая новые законы природы. Так, одной из задач для учёных стала тайна элемента калий — химический элемент, который важен для живых существ.

История открытия
Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева. Примерная молярная масса 39,1 г/моль. Электронная конфигурация калия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1

Единственная возможная степень окисления +1 (плюс один). На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1. Кристаллическая решётка простого вещества кубическая объёмно-центрированная. В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум).
Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений». И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И. Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Калий в природе

- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Способы получения
Современные условия позволяют учёным получать калий несколькими способами.
Уравнение взаимодействия с жидким натрием расплавленного основания при 380−450°C или хлорида при 760- 890 °C: Na + KOH = NaOH + K
Электролиз расплава хлорида в смеси с карбонатом калия при температуре около 700 °C:
Физические свойства
Легкоплавкий металл серебристого цвета. При надрезе быстро образует оксидную плёнку после нескольких секунд контакта с кислородом, что объясняет требования особых условий содержания в помещениях. Хранится только в посуде с керосином, силиконами или бензином. Обладает хорошей растворимостью при соединении со ртутью. Образует амальгамы.
На соединение с водой реагирует взрывом. При поднесении горелки окрашивает пламя в розово-фиолетовый цвет.
Химические характеристики
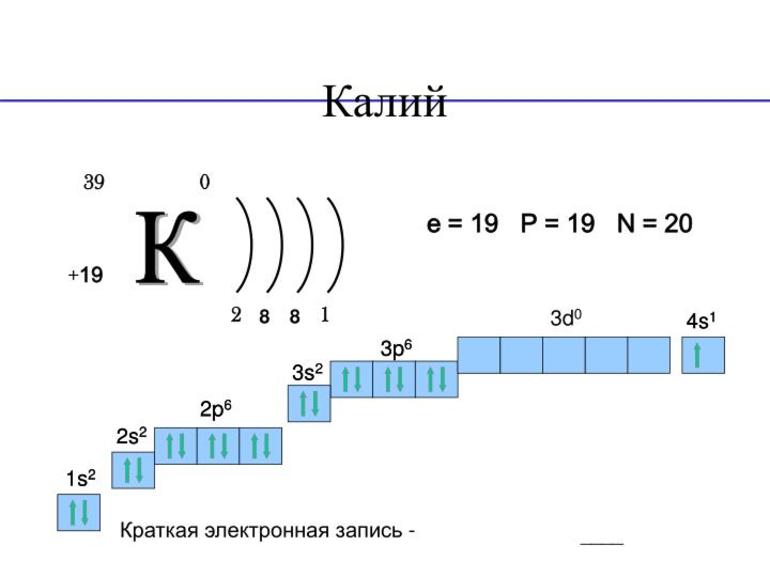
Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
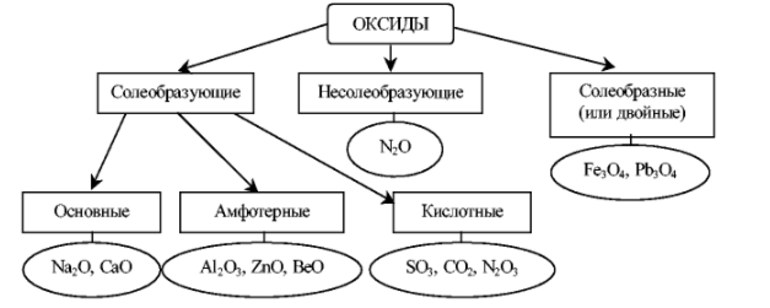
При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними. Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C.
Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Особые соединения калия

Бромид используется в фармацевтике для изготовления успокоительных лекарств.
Карбонат, хлорид и нитрат пользуются популярностью у садоводов, так как представляют собой удобрения, обогащённые большим количеством полезных микроэлементов.
Перманганат применяется в химических лабораториях для получения кислорода, а также ранее широко применялся в быту благодаря своим антисептическим свойствам.
Пероксид и супероксид обеспечивают регенерацию воздуха на подводных лодках и противогазах, благодаря своей способности поглощать углекислый газ и выделять кислород.

Из описания характеристик калия с другими элементами становится понятно, что это крайне важная составляющая организма, которая должны взаимодействовать с другими металлами и неметаллами, чтобы обеспечить гармоничный рост и развитие организма. Норма потребления этого элемента для человека — 2040 мг в сутки.
Роль этого металла и реакций организма, в которых он принимает участие, имеют большое значение для строения клеток, из которых состоит любой живой организм. Благодаря образованию различных химических связей, калий помог человечеству добиться новых вершин в кораблестроении, садоводстве, фармацевтической промышленности.
Повсеместное нахождение в природе позволяет добывать металл и его соединения беспрерывно, а благодаря успехам учёных в области химии возможно регулировать плотность содержания калия в препаратах. При соблюдении правильных пропорций и составлении схем алгоритмов можно предугадать пользу или вред.
Калий может быть полезным, но также он способен обрекать людей на тяжкие мучения, такие как: ожоги рук, раздражение слизистых оболочек. Об этом следует помнить всем, кто стремится узнать больше о свойствах этого металла. Прежде чем начинать работу с опасными веществами, лучше узнать всё о многолетнем опыте предшественников, чтобы избежать печальных и необратимых последствий.
Источник: nauka.club
Нахождение в природе
Калий (К) – серебристо-белый металл, быстро тускнеющий на воздухе при обычных условиях. Относится к щелочным металлам. Его ближайшие аналоги – литий, натрий, рубидий, цезий.
Содержание калия в земной коре 2,41% по массе, калий входит в первую десятку наиболее распространенных в земной коре элементов. Основные минералы, содержащие калий: сильвин KСl (52,44% К), сильвинит (Na,K)Cl (этот минерал представляет собой плотно спрессованную механическую смесь кристалликов хлорида калия KCl и хлорида натрия NaCl), кариаллит KCl·MgCl2·6H2O (35,8% К), различные алюмосиликаты, содержащие калий, каинит KCl·MgSO4·3H2O, полигалит K2SO4·MgSO4·2CaSO4·2H2O, алунит KAl3(SO4)2(OH)6. В океане Калий поглощается организмами и донными илами (например, входит в состав глауконита); поэтому океанические воды содержат лишь 0,038%
Калий встречается в природе в виде двух стабильных нуклидов: 39К (93,10% по массе) и 41К (6,88%), а также одного радиоактивного 40К (0,02%). Период полураспада калия-40 Т1/2 примерно в 3 раза меньше, чем Т1/2 урана-238 и составляет 1,28 миллиарда лет. При b-распаде калия-40 образуется стабильный кальций-40, а при распаде по типу электронного захвата образуется инертный газ аргон-40. Некоторые минералы Калия не теряют аргона, и по его содержанию можно определить абсолютный возраст горных пород (так называемый калий-аргоновый метод).
Калий принадлежит к числу щелочных металлов. В периодической системе Менделеева калий занимает место в четвертом периоде в подгруппе IА. Конфигурация внешнего электронного слоя 4 s1, поэтому калий всегда проявляет степень окисления +1 (валентность I).
Получение
Масштабы производства и потребления калия значительно ниже, чем натрия. По химическим свойствам калий близок натрию, но имеет более высокую реакционную способность. По этой причине получение калия более затруднительно, и в тех случаях, когда применение калия или натрия сравнительно равноценно, предпочитают натрий. В промышленности калий получают по обменным реакциям между металлическим натрием и КОН или KCI: KOH + Na → NaOH + K; KCI + Na → NaCI + K. В первом случае реакция идёт между расплавленным гидроксидом KOH и жидким натрием – противотоком в тарельчатой реакционной колонне при 380-440 о С, во втором – через расплавленную соль KCI пропускают пары натрия при 760-800 о С; выделяющиеся пары калия конденсируют. Получение Калия электролизом расплавленных KOH или KCl мало распространено вследствие низких выходов Калия по току и трудности обеспечения безопасности процесса.
Металлический калий упаковывают в чистые, сухие, герметичные стальные контейнеры вместимостью 25-100 л или стальные банки вместимостью 2-10л.
Физические свойства Атомные характеристики
Атомный номер 19, атомная масса 39,09830 а. е. м., атомный объём 43,550∙10 -6 м 3 /моль. Атомный радиус (металлический) 0,236 нм, ионный радиус К + 0,133, ковалентный 0,203 нм. Конфигурация внешних электронных оболочек атома калия 3p 6 4s 1 . Калий имеет два стабильных изотопа 39 К (93,08 %) и 41 К (6,91 %) и один слаборадиоактивный изотоп 40 К (0,0119 %) с периодом полураспада 1,32∙10 9 лет.
Известно несколько искусственных радиоактивных изотопов калия, среди которых практическое применение нашел изотоп 42К с периодом полураспада 0,52 сут. Калий при комнатной температуре обладает о. ц. к. решеткой с периодом α = 0,5247 нм. Энергия кристаллической решетки 90,2 мкДж/кмоль. Потенциалы ионизации атома калия Ј (эВ). Электроотрицательность 0,8.
Работа выхода электронов для различных граней монокристалла калия: φ = 2,4 эВ для грани (100), 2,75 эВ для грани (110), 2,35 эВ для грани (111).
Плотность 0,862 г/см3(20 °C). При плавлении плотность калия снижается на 2,42 %.
При плавлении электрическое сопротивление калия возрастает в 1,45 раза. Температурный коэффициент электрического сопротивления калия при 273К α = 5,81∙10 -3 К -1 . С увеличением давления удельное электрическое сопротивление твёрдого калия значительно уменьшается.
При 298 К и давлении 1177 МПа удельное электрическое сопротивление калия составляет 27,5 % от того значения, которое наблюдается при 0,098 МПа. В термопаре калий – платина при температуре горячего спая 173,16 К развивается т. Э. д. с. Е = +0,780 мВ, а при температуре горячего спая 373,16 К Е = -0,83мВ. Абсолютный коэффициент т. э. д. с. е = — 15,6 мкВ/К. Максимальное значение коэффициента вторичной электронной эмиссии σмах = 0,75 и соответствует ускоряющему напряжению первичных электронов Ер = 0,2 кэВ. Постоянная Холла калия при комнатной температуре R = -4,2∙10 -10 при 293 К.
Источник: studfile.net