— Почему эти металлы называются «щелочными»?
— При растворении в воде они образуют щелочи.
— А что такое щелочи?
Пока вы не находитесь в лаборатории и не контактируете напрямую с разными веществами, то такие понятия очень абстрактны… Я сама осознала понятие «щелочь», когда на 1 курсе в лаборатории вытерла «мыльные» руки о синтетический халат и через 2 минуты обнаружила на этих местах дырки!
Щелочи – мылкие на ощупь, довольно едкие вещества. Они очень гигроскопичны (тянут на себя влагу). По воздействию на кожу они похожи на кислоты – так же разъедают и щипят (если концентрированные).
Но вернемся к металлам.
Для начала рассмотрим
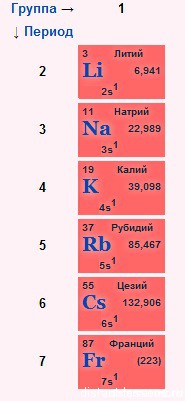
строение электронных оболочек
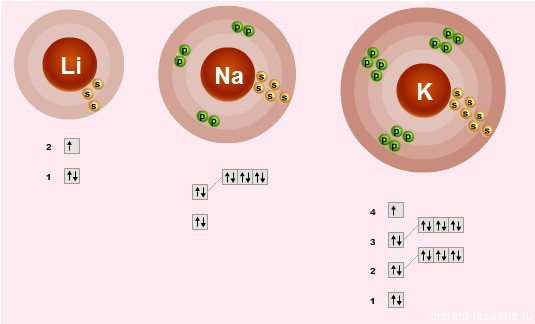
Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 1 неспаренный электрон на s-подуровне:
n S 1
Химия 9 класс (Урок№23 — Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)
Что это означает?
- Валентности элементов = 1, т.е. каждый атом может образовывать 1 связь.
- Степень окисления элементов =+1 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, этот 1 электрон все слабее притягивается к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Fr более сильный металл, чем Li.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
Физические свойства щелочных металлов
Общие характеристики:
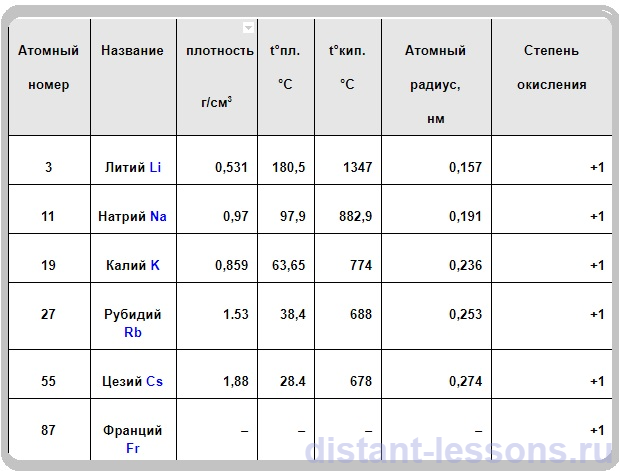
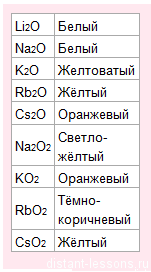
- все серебристо-белого цвета (Сs – желтоватый),
- мягкие как пластелин,

- плотность Li, Na и K меньше 1 – они плавают по поверхности воды,
- т.к. все металлы очень активно реагируют с водой (гигроскопичны) – реагируют с большим выделением тепла – по сути, горят на воздухе, искрят, то их хранят под слоем вазелина.
- Все элементы окрашивают пламя в разный цвет:
K – в фиолетовый
Rb – в красно-коричневый
Cs – в красно-фиолетовый
- Электро- и теплопроводны
Химические свойства щелочных металлов
Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
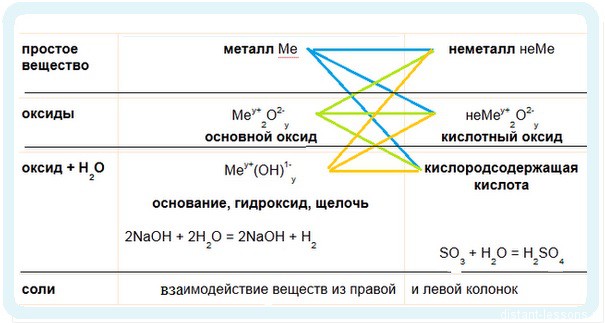
Щелочные металлы — САМЫЕ ОПАСНЫЕ и Активные Элементы!
1. Идем по синим стрелочкам
С кислородом образует оксиды, пероксиды и надпероксиды разных цветов:
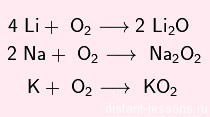
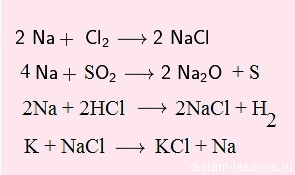
В реакциях с кислотами- окислителями водород не выделяется:

Обратите внимание на последнюю реакцию — взаимодействие металла с солью:
K + NaCl = Na + KCL
Не всякий металл может вступить в такую реакцию!
В таблице растворимости (она есть на развороте в любом учебнике по химии) внизу есть такая строчка:
![]()
Это электрохимический ряд активности металлов. Сейчас мы не будем подробно разбирать суть этого ряда, а просто примем за правило:
в этом ряду каждый предыдущий элемент может вытеснять последующий из его солей
2. Идем по зеленым стрелочкам — реакции для оксидов

3. Идем по оранжевым стрелочкам
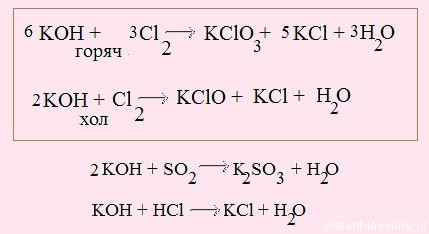
Обратите внимание на первые две реакции — они выделены в рамке. В первой реакции используется горячая щелочь — окисление идет до степени окисления хлора +5. При использовании холодной щелочи хлор окисляется только до +1.
Реакция щелочи с кислотой называется реакцией нейтрализации. Два сильных едких вещества нейтрализуют друг друга, образуя воду.
3. Отдельно надо выделить реакцию щелочных металлов с водородом.
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочными металлами будет проявлять отрицательную степень окисления. Получаются при этом гидриды:
![]()
Все соединения щелочных металлов хорошо растворимы в воде.
Это значит, что единственный способ их качественного определения — это цвет пламени и цвет оксидов. Никаких осадков их соединения не образуют.
style=»text-align: center;»> Получение металлов
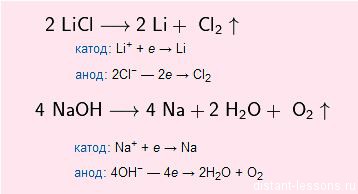
Обычно щелочные металлы получают электролизом расплавов их солей или щелочей:
NaCl (электролиз) → Na + Cl2
Источник: distant-lessons.ru
Какими свойствами обладают щелочные элементы
Литий, натрий, калий, рубидий, цезий и франций – металлы главной подгруппы I группы в таблице элементов Д.И. Менделеева. Их называют щелочными, поскольку при взаимодействии с водой они образуют растворимые основания – щелочи.

Статьи по теме:
- Какими свойствами обладают щелочные элементы
- Почему в периодической системе изменяются неметаллические свойства
- К каким химическим элементам относится бор
Щелочные металлы – s-элементы. На внешнем электронном слое каждый из них имеет один электрон (ns1). Радиусы атомов сверху вниз в подгруппе увеличиваются, энергия ионизации уменьшается, восстановительная активность, как и способность отдавать валентные электроны с внешнего слоя, увеличивается.
Рассматриваемые металлы очень активны, поэтому в свободном состоянии они в природе не встречаются. Их можно обнаружить в виде соединений, в составе минералов (поваренной соли NaCl, сильвинита NaCl∙KCl, глауберовой соли NaSO4∙10H2O и других) или в виде ионов в морской воде.
Физические свойства щелочных металлов
Все щелочные металлы при обычных условиях представляют собой серебристо-белые кристаллические вещества, обладающие высокой тепло- и электропроводностью. Они имеют объемно-центрированную кубическую упаковку (ОЦКУ). Плотности, температуры кипения и плавления у металлов I группы относительно низкие. Сверху вниз в подгруппе плотности увеличиваются, а температуры плавления уменьшаются.
Получение щелочных металлов
Щелочные металлы получают обычно электролизом расплавленных солей (чаще хлоридов) или щелочей. При электролизе расплава NaCl, к примеру, на катоде выделяется чистый натрий, а на аноде – газообразный хлор: 2NaCl(расплав)=2Na+Cl2↑.
Химические свойства щелочных металлов
По химическим свойствам литий, натрий, калий, рубидий, цезий и франций – это наиболее активные металлы и одни из самых сильных восстановителей. В реакциях они легко отдают электроны с внешнего слоя, превращаясь в положительно заряженные ионы. В образуемых щелочными металлами соединениях преобладает ионная связь.
При взаимодействии щелочных металлов с кислородом в качестве основного продукта образуются пероксиды, и в качестве побочного – оксиды:
4Na+O2=2Na2O (оксид натрия).
С галогенами они дают галогениды, с серой – сульфиды, с водородом – гидриды:
2Na+Cl2=2NaCl (хлорид натрия),
2Na+S=Na2S (сульфид натрия),
2Na+H2=2NaH (гидрид натрия).
Гидрид натрия – неустойчивое соединение. Он разлагается водой, давая щелочь и свободный водород:
Свободный водород и щелочь образуются также при взаимодействии с водой самих щелочных металлов:
Эти металлы также взаимодействуют с разбавленными кислотами, вытесняя из них водород:
С органическими галогенидами щелочные металлы взаимодействуют по реакции Вюрца:
Совет полезен?
Статьи по теме:
- К каким химическим элементам относится цинк
- Полоний как химический элемент
- Как определить валентность по таблице Менделеева
Добавить комментарий к статье
Похожие советы
- Что такое щелочь
- Как определить ионную связь
- Как определить металл и неметалл
- Как научиться читать таблицу химических элементов Д.И. Менделеева
- С какими элементами взаимодействует углерод
- Почему в периодической системе изменяются металлические свойства
- Какие есть металлы
- К каким химическим элементам относится калий
- От чего зависят кислотно-основные свойства
- Какие есть щелочные металлы
- Характеристика и строение калия
- Как получить натрий
- Как определить щелочь
- Как определить сильное основание
- Что такое батареи Alkaline
- Хлор как химический элемент
- Какая температура плавления металлов
- Какой металл является наилучшим проводником
- Что такое дихромат калия
- Имеет ли запах щелочь
- Как определить металлы в таблице Менделеева
- Радий как химический элемент
- Что такое металлический водород
- Как нарисовать лапы
Источник: www.kakprosto.ru
Щелочные металлы

К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями.
Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т. е. химическая активность. В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.

Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов – твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
1. Щелочные металлы активно взаимодействуют с водой:
2. Реакция щелочных металлов с кислородом:
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
K + , Rb + и Cs + – фиолетовый
Источник: www.yoursystemeducation.com