Так как в периодах и группах периодической системы Д.И.Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от бора к астату, то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы, а в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди р-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии — INTENSIV

Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия, олова, свинца на внешнем электронном слое имеют четыре электрона, атомы сурьмы, висмута – пять, атомы полония – шесть. Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути). Кристаллическая решетка металлов образуется за счет металлической связи. Имеющиеся между узлами кристаллической решетки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Физические свойства металлов
- Все металлы – твердые вещества (кроме ртути).
- Для всех металлов характерны металлический блеск и непрозрачность.
- Все металлы – проводники теплоты и электрического тока. Металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Важными свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь.

Ртуть
По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий – мягкие металлы (их можно резать ножом); хром – самый твердый металл (царапает стекло).
Температуры плавления и плотности металлов также изменяются в широких пределах. Самый легкоплавкий металл – ртуть (tпл.= — 39 ̊ С), самый тугоплавкий – вольфрам (tпл.= 3380 ̊ С). Плотность лития – 0,59 г/см 3 , осмия – 22,48 г/см 3 .
13. Простые вещества (металлы и неметаллы)
Металлы отличаются своим отношением к магнитным полям и делятся на три группы:
— ферромагнитные металлы способны намагничиваться под действием слабых магнитных полей (железо, кобальт, никель, гадолиний);
— парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
— диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Химические свойства металлов
Атомы металлов не могут присоединять электроны. Поэтому они во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова. В периодах слева направо восстановительная активность металлов уменьшается; в главных подгруппах сверху вниз – увеличивается.
- Взаимодействие с простыми веществами – неметаллами:
а) с галогенами металлы образуют соли – галогениды, например:
б) с кислородом металлы образуют оксиды, например:

Горение железа в кислороде
в) с серой металлы образуют соли – сульфиды, например:
г) с водородом самые активные металлы образуют гидриды, например:
д) с углеродом многие металлы образуют карбиды, например:
- Взаимодействие со сложными веществами:
а) металлы, находящиеся в начале ряда напряжений (от Li до Na), при обычных условиях вытесняют водород из воды и образуют щелочи, например:
б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными кислотами (HCl, H2SO4 и др.), в результате чего образуются соли и выделяется водород, например:
в) металлы взаимодействуют с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде, например:
Общие способы получения металлов
Большинство металлов встречаются в природе в виде различных соединений (оксиды, сульфиды, сульфаты, хлориды, карбонаты и др.). Только наименее активные металлы встречаются в природе в свободном виде (самородные металлы) – золото, серебро, платина и др.
Получение металлов из их соединений – это задача металлургии.
Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде.
В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др.
Гидрометаллургия – это получение металлов, которое состоит из двух процессов: 1) природное соединение металла (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в данном процессе играет электрический ток.
Сплавы
Металлы в чистом виде применяют реже, чем их сплавы. Это объясняется тем, что сплавы часто обладают более высокими техническими свойствами, чем чистые металлы. Изготовление сплавов основано на свойстве металлов в расплавленном состоянии взаимно растворяться и смешиваться друг с другом.
По своему составу и строению сплавы бывают различными. Важнейшими из них являются:
- Механическая смесь металлов. Охлажденный расплав представляет собой смесь очень мелких кристаллов отдельных металлов (например, Pb + Sb)
- Твердые растворы. При охлаждении расплава образуются однородные кристаллы. В узлах их кристаллических решеток находятся атомы различных металлов (например, Cu + Ni).
- Интерметаллические соединения. При взаимном растворении металлов их атомы реагируют между собой, образуя химические соединения. В таких соединениях металлы чаще всего не проявляют валентность, характерную для них в соединениях с неметаллами (например, Cu3Zn, Zn3Mg, Ag2Zn5).
В состав сплавов могут входить и неметаллы (углерод, бор и др.)

Способность металлов в расплавленном виде не только механически смешиваться, но и образовывать между собой (и атомами неметаллов) различные соединения – одна из главных причин, объясняющая, почему сплавы по физическим свойствам сильно отличаются от свойств составляющих их металлов. Сплав полученный из монокарбида вольфрама и кобальта – «победит» — по твердости сравним с алмазом. В настоящее время в технике применяют большое число различных сплавов, обладающих заранее заданными свойствами. Для их получения используют более 40 химических элементов в разнообразных сочетаниях и количественных соотношениях.
Некоторые широко используемые сплавы
Сталь – сплав железа и углерода, добавки: Mn, Cr, Ni, Si, P, S.
Бронза – сплав меди с оловом, добавки: Zn, Pb, Al, Mn, P, Si.
Латунь – сплав меди с цинком, добавки: Sn, Mn, Al, Pb, Si.
Мельхиор – сплав меди с никелем.
Дюралюминий – сплав алюминия с медью (3-5%), марганцем (1%), магнием (1%).
Амальгамы – сплавы металлов, содержащие ртуть.
Источник: al-himik.ru
Общие сведения. Металлами называют вещества, обладающие своеобразным металлическим блеском, пластичностью, высокой прочностью
Металлами называют вещества, обладающие своеобразным металлическим блеском, пластичностью, высокой прочностью, электро- и теплопроводностью, ковкостью и свариваемостью, что обусловлено особой природой металлической связи. У металлов своеобразные не только физические, но и химические свойства: способность к окислению и восстановлению в реакциях.
Большинство химических элементов (82 из 109- 75%) относится к металлам.
Свойства сплавов обычно резко отличаются от свойств исходных металлов и их можно регулировать.
Содержание химических элементов в земной коре колеблется в больших пределах. Наиболее распространенными и ценными являются:
Содержание остальных металлов составляет около 2%. Ряд металлов (цинк, олово, свинец, кобальт, вольфрам, молибден, ванадий) содержатся в тысячных долях процента, но имеют большое значение для получения высококачественных сплавов.
Характерная особенность строения металлов – наличие металлической связи между атомами. Атомы металлов на внешней оболочке содержат небольшое количество слабосвязанных электронов. Электронные облака атомов перекрываются, поэтому внешние электроны могут свободно перемещаться и являются как бы общими, не связанными с отдельными атомами.
Таким образом, общие электроны образуют электронный газ, который свободно перемещается между ионами и скрепляет их друг с другом. Эта особенность определяет стремление атомов металла располагаться как можно плотнее. Компактная упаковка атомов приводит к повышенной плотности металлов.
Металлы и сплавы в твердом состоянии имеют кристаллическое строение, которое характеризуется определенным, закономерным расположением атомов. Атомы в кристалле металла образуют пространственно кристаллическую решетку, состоящую из многократно повторяющихся ячеек, имеющих относительно простую форму.
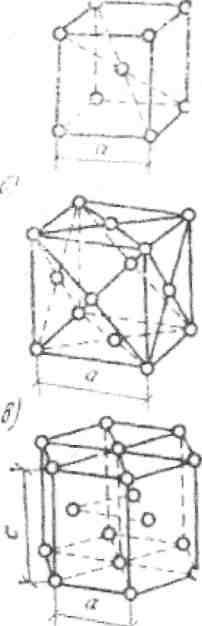
В промышленных металлах наиболее распространены следующие кристаллические решетки (рис. 1): кубическая объемно-центрированная, кубическая гранецентрированная и гексагональная. В элементарной кубической объемно-центрированной решетке находится девять атомов (восемь в вершинах куба и один в центре).
Такую решетку имеют: железо при температуре до 910 °С и выше 1390 °С, хром, вольфрам, ванадий и др. В кубической гранецентрированной решетке 14 атомов (восемь в вершинах куба и по одному в центре каждой грани). Такую решетку имеют: железо при температуре 910-1390 °С, медь, никель, алюминий и др. В гексагональной решетке, имеющей форму шестигранной призмы, 17 атомов (12 в вершинах, два в центре оснований и три внутри призмы). Данная решетка имеется у магния, цинка и других металлов.
Возможны и другие формы кристаллических решеток. Атомы в решетке находятся на определенных расстояниях один от другого. Эти расстояния очень малы и вычисляются в нанометрах (1 нм = 10″ м). Расположение атомов, межатомные расстояния, насыщенность атомами — все это влияет на качество металлов.
Размеры кристаллической решетки характеризуются параметрами (периодами) — расстояниями между центрами атомов, расположенных в узлах элементарной ячейки. Например, для железа эти параметры равны 28,4-36,3 нм.
 |
 |
 |
 |
Рис. 1. Основные виды элементарных ячеек кристаллических решеток металлов а — объемно-центрированная кубическая; б — гранецентрированная кубическая; в – гексагональная плотноупакованная
Кристаллическая природа металлов обуславливает анизотропию их свойств, т.е. различие свойств металлов в зависимости от направления кристаллографических осей, образующих кристаллы металлов.
Процесс перегруппировки атомов в кристаллографической решетке происходит в твердом состоянии металла подобно процессу затвердевания жидкого сплава при определенных- температурах и сопровождается тепловым эффектом. Этот процесс образования новых кристаллов из кристаллов прежней модификации называется вторичной кристаллизацией.
Металлические сплавы, представляющие собой поликристаллические тела, в которых кристаллиты (кристаллические образования, которые при правильном внутреннем строении не сохранили в процессе роста правильную форму кристалла вследствие помех соседних кристаллов) различно ориентированы один относительного другого, обладают мнимой изотропностью (квазии-зотропны). Однако в результате технологической обработки сплава (прокатки, волочения, ковки и т.д.) происходит ориентировка кристаллов по направлению обработки, и металл становится анизотропным. Некоторые механические свойства металлических сплавов при технологической и термической обработках повышаются в направлении главных кристаллографических осей. Этим частопользуются при изготовлении некоторых деталей машин и металлических строительных изделий.
Процесс кристаллизации металлических сплавов начинается при охлаждении жидкого сплава и продолжается у многих сплавов до определенных температур в отвердевшем состоянии в виде перекристаллизации. На размер и форму образующихся кристаллов влияет скорость охлаждения жидкого сплава: при медленном охлаждении образуются крупные зерна, а при быстром — металлический сплав приобретает мелкозернистое строение.
В настоящее время измельчение зерна металла достигается не только за счет увеличения скорости охлаждения, но и за счет введения различных присадок, увеличивающих число центров кристаллизации при V=const и создающих условия для замедленного роста кристаллов. Этот метод измельчения зерна называется модифицированиеми применяется при выплавке специальных чугунов, сталей и некоторых цветных металлов.
Основными способами модифицирования структуры и свойств стали применяемыми в современной металлургии, являются:
— введением в расплавленный металл веществ образующих тугоплавкие соединения, являющиеся центрами кристаллизации (Ti, Al, Si, Mn);
— введение лигирующих элементов, повышающих прочность кристаллических решоток феррита и ацетенита, замедляющих диффузионные процессы выделения углерода, карбидов и движение дислокаций;
— термическая и пормомеханическая обработка.
При затвердевании металлических слитков, болванок, заготовок образуются различные по крупности кристаллы: более мелкие у наружной поверхности, а более крупные внутри слитка. Кроме того, кристаллы ориентированны различно: внутри слитка они имеют более правильные формы, чем в наружных слоях, а чаще всего приобретают разветвленную древовидную форму. Такие скопления кристаллов в слитках называются дендритами. Возможно также образование кристаллов пластинчатой, игольчатой и других форм.
Затвердевание слитка по всему объему происходит не одновременно, поэтому и строение слитка неоднородно. В верхней части, у поверхности слитка, затвердевающего в первую очередь, образуются усадочные раковины, окруженные макро и микропорами.
При ускоренном охлаждении сплава внутри отливки могут образоваться полости — газовые пузыри — за счет газов, не успевших удалиться из металлов.
Подобная неоднородность отливок может привести к снижению их механических свойств.
Соответствующей механической обработкой отливки (давлением, прокаткой) с последующей термической обработкой можно придать волокнистое строение в направлении обработки и уменьшить размер зерен, что улучшает его механические свойства. В жидком состоянии большинство сплавов представляет собой однородный жидкий раствор. При переходе в твердое состояние однородность многих сплавов сохраняется за счет внедрения или замещения атомов в кристаллографической решетке растворителя атомами других более легких элементов.
Структура реальных сплавов в значительной степени отличается от идеального строения кристаллов. В реальном металле всегда имеются нарушения макро- и микроскопического характера (поры, газовые и неметаллические включения, микротрещины и пр.), а также дефекты кристаллического строения, связанные с нарушением правильного расположения атомов в самой кристаллической решетке.
Все эти виды нарушений заметно влияют на свойства, причем наиболее велика роль несовершенства кристаллического строения, так называемых дислокаций. Из-за присутствия в металле дислокаций теоретическая прочность не реализуется. Прочность реальных кристаллов обычно составляет не более 1-5% от теоретической, рассчитанной по силам связи между атомами. В конструкции же, когда на эксплуатационные характеристики металла оказывают такие факторы, как наличие надрезов, напряженное состояние, температурные условия эксплуатации, агрессивность окружающей среды, используется только от 40 до 80% прочности исходного металла.
Член – корреспондент АНСССР И. А. Одинг еще в конце 40х годов прошлого столетия, сформулировал основные закономерности изменения прочности кристаллических тел в зависимости от от плотности дислокаций, благодаря им получили интенсивное развитие:
1. получение металлов с кристаллическим строением близким к совершенству (создание бездислакационных кристаллов с прочностью приближающейся к теоретической), и разработка на этой основе высокопрочных композиционных материалов;
2. создание в уже имеющихся материалах повышенной или высокой плотности дислокаций, что при условии равномерного или периодического распределения в объеме металла позволяет в несколько раз повысить его прочность;
Во втором пути повышения прочности металлов используются два основных метода:
— пластическая деформация (механическая энергия) для достижения необходимой плотности дислокаций;
— термическое воздействие (тепловая энергия).
Наиболее эффективно повышает прочность комбинация этих двух способов с названием термомеханическая обработка (ТМО).
Влияние структурных составляющих на свойства железоуглеродистых сплавов
Графит — мягок, его истинная плотность 2,25 г/см 3 , он нарушает сплошность металла, понижая сопротивление растяжению и вязкость, увеличивает хрупкость тем больше, чем крупнее его частицы. Графит характеризует микроструктуру литейных чугунов.
Феррит — твердый раствор углерода в aFe, мягкий, вязкий, хорошо куется и сваривается. Чем больше в металле феррита, тем металл мягче, более ковок и тем больше дает удлинение при растяжении.
Цементит — карбид железа Fe3C. С увеличением его содержания сначала возрастают твердость и прочность металла (наибольший предел прочности при растяжении — при содержании углерода 1,2%); с дальнейшим увеличением количества цементита сопротивление падает, вязкость уменьшается, а твердость и хрупкость возрастает.
Аустенит — твердый раствор углерода в γ Fе; содержит до 2% углерода. В обыкновенных сталях аустенит устойчив только при температуре выше 723°С В легированных сталях, содержащих в своем составе некоторое количество Мп, Cr, Ni и других элементов, аустенит может быть устойчивым и при обычной, и даже низкой температуре. Механические свойства аустенита зависят от содержания в нем углерода. С уменьшением количества углерода аустенит становится более мягким и вязким; с увеличением — более твердым и хрупким.
Ледебурит — эвтетика (цементит + аустенит), очень тверд и хрупок, присутствует в белых чугунах. Образуется при температуре 1130 °С и содержит углерода С=4,3% — эвтектический чугун.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Металлы и неметаллы


Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.



В быстроразвивающемся мире уже мало учиться только в рамках школьной программы, важно получать полезные знания о финансах и инвестициях, чтобы гарантировать материальное благополучие
Создай себе задел на будущее, получай уже сегодня расширенный объем знаний и навыков по ФИНАНСОВОЙ ГРАМОТНОСТИ в режиме онлайн


Зарегистрируйся сейчас, ПРИБЛИЗЬ СВОЙ УСПЕХ
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.

Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.

Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.

Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.

Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.

Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.

Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
- С оксидами металлов
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
- С растворами солей
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
- С другими неметаллами
- Со сложными веществами
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.

Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ — 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
- Защитные покрытия
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Источник: 100urokov.ru