Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Реакции разложения солей, оснований и кислот в неорганической химии #егэхимия #химшкола #химия
При нагреванииобразца нитрата серебра(I) часть вещества разложилась, при этом образовался твердый
При нагреванииобразца нитрата серебра(I) часть вещества разложилась, при этом образовался жесткий остаток массой 88 г. К этому остатку добавили200 г 20%-ного раствора соляной кислоты, в результате чего образовался раствор массой 205,3 г с массовой частей соляной кислоты 15,93 %. Обусловьте объем консистенции газов, выделившейся при разложении нитрата серебра(I).
- Лилия Жендарина
- Подготовка к ЕГЭ/ОГЭ
- 2019-10-28 03:53:39
- 1
- 1
Тамара Куделич 2019-10-28 03:55:01
Запишем уравнение разложения нитрата серебра (I):
2AgNО3 2Ag + 2NО2 + O2+AgNО3ост. (1)
где AgNO3ост. неразложившаяся часть нитрата серебра (I).
Таким образом, жесткий остаток это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl AgCl + HNO3(2)
Вычислим массу и количество вещества соляной кислоты в ее начальном растворе:
m(HCl)иcx. = 20г 0,2 = 40г
n(HCl)иcx.= 40г / 36,5 г/моль = 1,1моль
Вычислим массу и количество вещества соляной кислоты в образовавшемся растворе:
m(HCl)кон. = 205,3 г 0,1593 = 32,7 г
n(HCl)кон.= 32,7 г / 36,5 г/моль = 0,896 моль(0,9 моль)
Вычислим количество вещества соляной кислоты, пошедшей на реакцию с AgNО3:
n(HCl)реакц = 1,1 моль 0,896 моль = 0,204 моль(0,2 моль)
Найдем количество вещества и массу неразложившегося нитрата серебра:
По уравнению (2) n(AgNО3)ocт.= n(HCl)реакц.= 0,204 моль. (0,2 моль)
m(AgNО3)ocт.= (AgNО3)ocт. M(AgNО3) = 0,204 моль 170 г/моль = 34,68г.(34 г)
Найдем массу образовавшегося серебра:
m(Ag) = mостатка m((AgNО3)ocт) = 88 г 34,68 г = 53,32 г.(54 г)
n(Ag) = m(Ag)/ M(Ag) = 53,32 г / 108 г/моль = 0,494 моль. (0,5 моль)
Найдем количество вещества и объем смеси газов, образовавшихся при разложении нитрата серебра:
Все реакции разложения в неорганике | Химия ЕГЭ 2022 | Умскул
По уравнению (1) n(NО2 + O2) =3/2n(Ag) = 3/2 0,494моль= 0,741моль(0,75 моль)
V(NO2 + O2) = n(NO2 + O2) Vm= 0,741моль 22,4 л/моль = 16,6л.(16,8л).
Ответ: V(NO2 + O2) = 16,6л. (16,8л).
Источник: obrazovalka.com
Разложение веществ

Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
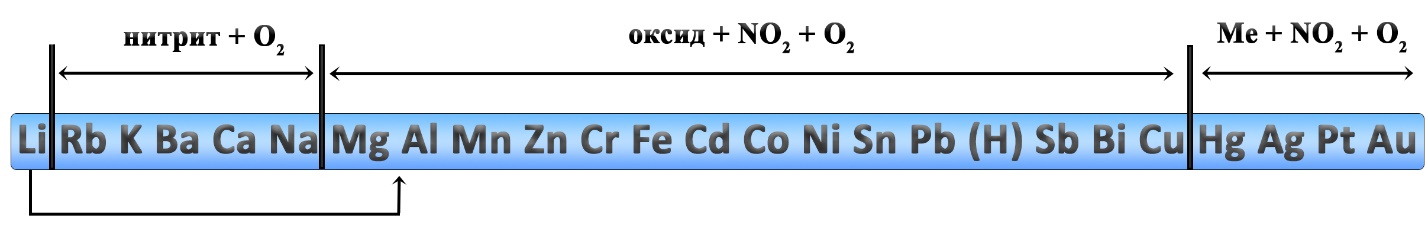
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
Задание по образцу ФИПИ:
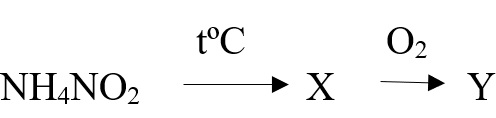
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
Разложение карбонатов
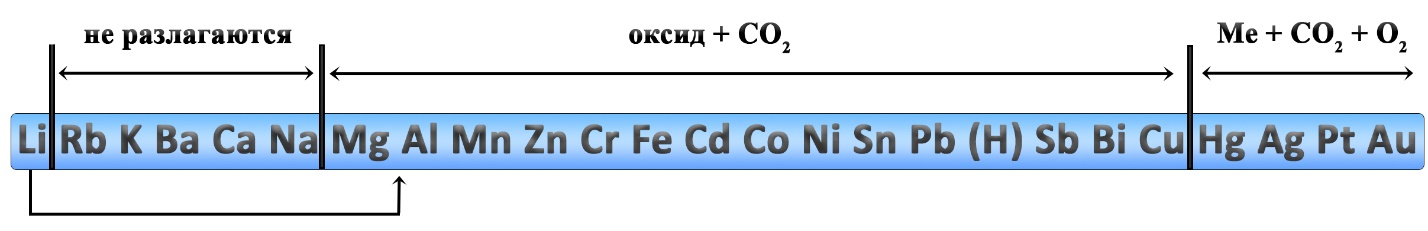
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
При разложении каких карбонатов образуется оксид металла?
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
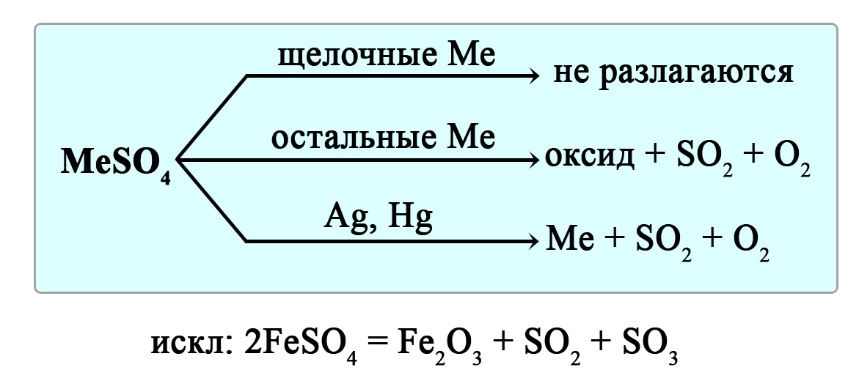
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
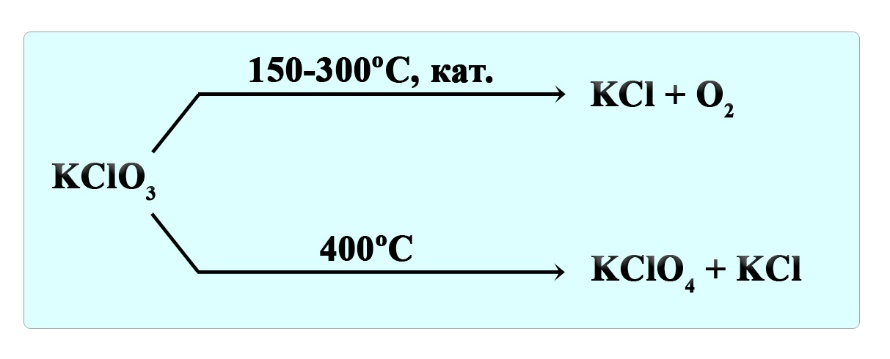
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
Сходным образом разлагается перхлорат калия:
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
Источник: onlineclass.space