Впервые человек, вероятно, познакомился с метеоритным железом, т.к. древнеегипетское название железа «бени-пет» означает небесное железо. В хеттских текстах встречается упоминание о железе как о металле, упавшем с неба.
- Физические свойства
- Химические свойства
- Нахождение в природе
- Получение
- Применение и использование
Физические свойства железа
Железо — серебристо-серый пластичный металл. Кристаллические модификации а-, g- и d-Fe открыты в 1868 Д. К. Черновым.
До f 1042К кристаллическая решётка объёмно-центрированная кубическая, параметр решётки а = 0,2 86645 нм — а-Fe, между t 1173 и 1673К — гранецентрированная, а = 0,3 637 нм — g-Fe, выше f 1673К — объёмно-центрированная, а = 0,2 925 нм — d-Fe, между f 1042 и 1173К – объёмно-центрированная, а = 0,2 895 нм — d-Fe (иногда называется бета — b). Модификации g- и d-Fe парамагнитны. Физические свойства железа зависят от содержания примесей. При общем содержании примесей менее 0,01% по массе — плотность (293,15К) 7,84•10 3 кг/м 3 ; tnл1536°С, энтальпия плавления 13,77 кДж/моль; t кипения 2880°С; энтальпия испарения 350,02 кДж/моль; коэффициент теплопроводности (298К) 74,04 Вт/м К; удельное электрическое сопротивление (293 К) 9,7•10 -8 Ом/м; температурный коэффициент электрического сопротивления (273-373 К) 6,51•10 -3 К -1 , относительное удлинение 45-55%; температурный коэффициент линейного расширения (293 К) 11,7•10 -6 К -1 , твёрдость по Бринеллю 350-450 МПа; модуль Юнга 190-210•10 3 МПа; модуль сдвига 8,4•10 -3 МПа; кратковременная прочность на разрыв 170-210 МПа, предел текучести 100 МПа; ударная вязкость 300 МПа; средняя удельная теплоёмкость (273-1273 К) 640,57 Дж/кг•К, молекулярный объём 7,093•10 -6 м3/моль.
Какое железо в таблетках лучше? Как его принимать. Правда о гематогене.
Химические свойства железа
Степени окисления железа +2, +3, +1, +4, +6. Наиболее устойчивы соединения двух- и трёхвалентного железа. Химически чистое железо при нормальной температуре стойко к окислению на воздухе и в воде. При отсутствии влаги не реагирует заметно с кислородом, серой, бромом, хлором; во влажном воздухе окисляется, покрываясь ржавчиной FeO•nH2О.
При нагревании в присутствии воды окисляется с образованием Fe3О4 (до 845К) или FeO (выше 845К) и выделением водорода. При нагревании в сухом воздухе при 473-573К покрывается тончайшей оксидной плёнкой, которая защищает металл от коррозии (технический метод защиты железа от коррозии — воронение).
Реагируя при повышенных температурах и в присутствии воды с S, Р, Cl, N, Ti, образует галогениды, сульфиды, фосфиды, нитриды, титаниды железа. Хорошо растворяется в разбавленных кислотах и практически не растворяется в щелочах. При взаимодействии с концентрированными кислотами Н2SO4 и HNO3 покрывается защитной оксидной плёнкой.
Дефицит железа: симптомы и причины ☝️
Склонно к образованию комплексных соединений. Закись железа FeO проявляет основные свойства, оксид Fe2О3 — амфотерен, обладает слабо выраженной кислотной функцией, реагирует с более основными окислами, образуя ферриты Fe2О3•nMeO, имеющие ферромагнитные свойства.
Кислотные свойства выражены и у Fe +6 , существующего в виде ферратов, солей не выделенной в свободном состоянии железной кислоты. Водные растворы солей железа вследствие гидролиза имеют кислую реакцию.
Водные растворы солей двухвалентного железа на воздухе неустойчивы, Fe 2+ окисляется до Fe 3+ . Растворимость углерода в а-Fe при комнатной температуре 2•10 -5 %, при t 1110К 0,02%; в g-F при t 1426К растворяется 2,11% углерода. Твёрдый раствор углерода в g-Fe называется аустенитом, а углерода в а-Fe — ферритом. При закалке аустенита образуется мартенсит, пересыщенный твёрдый раствор углерода. Сочетание закалки с нагревом до относительно низких температур позволяет придать стали требуемое сочетание твёрдости и пластичности.
Железо в природе
По содержанию в земной коре (4,65%) железо занимает 4-е место. Среди других породообразующих элементов имеет максимальный атмосферный вес. Железо — сидерофильный элемент. Ведущий элемент метеоритного вещества: в каменных метеоритах содержится 25, в железных — 90,85% по массе Fe. Космическая распространённость железа близка к его содержанию в фотосфере Солнца — 627 г/т.
Содержание железа для Земли в целом выше, чем для земной коры (38,8%). Наиболее бедны железом верхние оболочки Земли: в атмосфере фактически не содержится железо (лишь в метеорной и земной пыли), в гидросфере — 1•10 -6 %, в почве — 3,8%, в растениях (золе) — 1,0%, в живом веществе — 1•10 -2 %. Распространённость железа в горных породах (% по массе): ультраосновные — 9,85; основные — 8,56; средние — 5,85; кислые — 2,70; щелочные — 3,60; осадочные — 3,33 (по А. П. Виноградову).
Неокисленное железо в виде теллурического (земного) или метеоритного встречается в природе редко. Известно свыше 300 минералов, содержащих железо: оксиды, сульфиды, силикаты, фосфаты, карбонаты и др.
Важнейшие минералы железа: гематит Fe2О3 (70% Fe), магнетит Fe2О4 (72,4% Fe), гётит FeOOH (62,9% Fe), лепидокрокит FeO(OH) (62,9% Fe), лимонит — смесь гидрооксидов Fe с SiO2 и другими веществами (40-62% Fe), сидерит FeCO3 (48,2% Fe), ильменит FeTiO3 (36,8% Fe), шамозит (Fe 2+ Fe 3+ )3 AlSi3O10(OH)2(Fe, Mg)3•(О,OH)6 (34-42% FeO); вивианит Fe3(PO4)2•8Н2О(43,0% FeO), скородит Fe(AsO4)•2Н2О (34,6% Fe2О3), ярозит KFe3(SO4)2(OH)6 (47,9% Fe2О3) и др. Возможность отделения окисножелезных расплавов от силикатных — первопричина концентрации железа в магматическом процессе.
В сульфидных магматических рудах железо — один из главных компонентов. Высокотемпературный контактово-метасоматический процесс приводит к формированию магнетитовых месторождений в скарнах. В переносе железа большая роль принадлежит хлоридным комплексам. В гидротермальном процессе повсеместно распространены сульфиды железа. В высокотемпературных гидротермальных жилах присутствуют магнетит, пирротин, халькопирит
Железо — единственный породообразующий элемент с переменной валентностью. Отношение оксидного железа к закисному устойчиво растёт с увеличением кремнекислотности расплавов. Ещё больший рост происходит в щелочных системах, где минерал, содержащий трёхвалентное железо — эгирин, (Na,Fe)Si2О6, становится породообразующим.
В метаморфическом процессе железо, по-видимому, мало подвижно. Содержание железа в современных океанических осадках близко к содержаниям в древних глинистых породах и глинистых сланцах. Основные генетические типы месторождений и схемы обогащения смотреть в статье железные руды.
Получение железа
Чистое железо получают восстановлением из оксидов (железо пирофорное), электролизом водных растворов его солей (железо электролитическое), разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С. Особо чистое железо (99,99%) получают с помощью зонной плавки. Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах. Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом. Основную массу железа выплавляют в виде сталей (до 2% углерода) или чугунов (свыше 2% углерода).
Применение железа
Железоуглеродистые сплавы — основа конструкции материалов, применяющихся во всех отраслях промышленности. Техническое железо — материал для сердечников электромагнитов и якорей электромашин, пластин аккумуляторов. Железный порошок в больших количествах применяется при сварке.
Оксиды железа — минеральные краски; ферромагнитные Fe3О4, g-Fe используются для производства магнитных материалов. Сульфат FeSO4•7Н2О применяется в текстильной промышленности, в производстве берлинской лазури, чернил; FeSO4 — коагулянт для очистки воды. Железо используется также в полиграфии, медицине (как антианемическое средство); искусственные радиоактивные изотопы железа — индикаторы при исследовании химико-технологических и биологических процессов.
Источник: www.mining-enc.ru
Соединения железа — свойства, валентность железа в реакциях с веществами
Железо (Fe) — это один из наиболее распространенных химических элементов. Соединения железа массово используются в химической промышленности, народном хозяйстве. Сплавы железа с другими элементами стали основой большинства строительных материалов или деталей автомобилей и другой техники.
Но о применении железа поговорим позже. Сначала обозначим характеристики этого необыкновенного элемента.
Fe — строение, признаки, расположение в таблице Менделеева
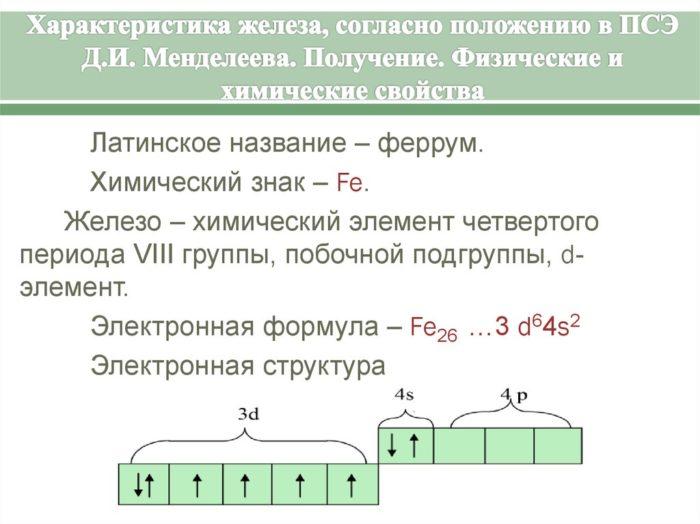
Железо (Fe) — элемент 8б группы 4 периода. Порядковый номер в периодической системе — 26. Отметим, что кобальт (Co) и никель (Ni), входящие в 8б группу таблицы Менделеева, включены в семейство железа. Строение электронной оболочки атома Fe таково: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 Электронное строение атома данного элемента обусловливает характерные степени окисления: +2 и + 3. Железо также может находиться в степени +6. О некоторых исключениях и интересных веществах, где этот элемент проявляет необычные свойства, поговорим чуть позже.
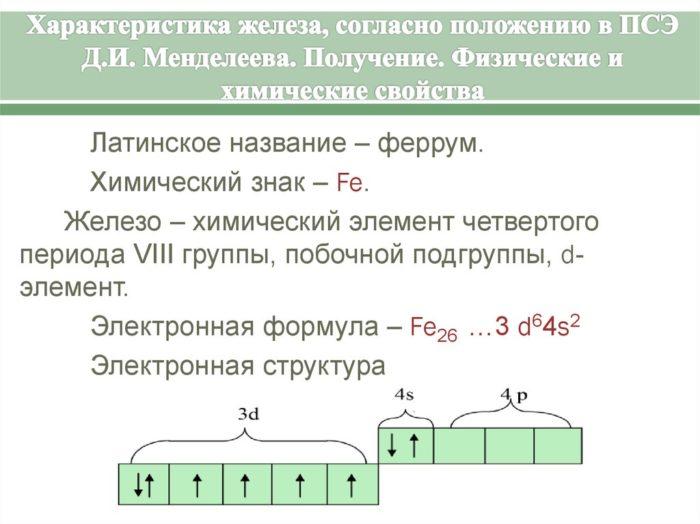
Рис. 1. Характеристика железа
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Важно! Этот химический элемент в немалом количестве содержится в горах. Огромные залежи располагаются на Урале, в Сибири и других регионах России. Богаты железными рудами Украина, Прибалтика и т.д.
Физические свойства
Железо — ковкий и довольно прочный металл серебристо-белого цвета . На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется. Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Соединения Fe (+2)
Начнем с тех веществ, где железо проявляет наименьшую окислительную степень после нуля — + 2. Данную степень этот химический элемент способен проявлять в различных бинарных соединениях, а также в сложных и комплексных солях.
Оксид железа II — FeO
Получить его возможно, если восстанавливать с помощью водорода оксид железа III. В целом FeO можно считать амфотерным оксидом, но в нем больше преобладают основные свойства. Представляет собой черный порошок, который невозможно растворить в воде. Ценится за свое быстрое окисление и восстановление до изначального вещества.
Гидроксид железа II — Fe(OH)2
Готовимся к углубленному изучению химии
Железо – химический элемент четвертого периода и побочной подгруппы VIII группы периодической системы. Атом железа содержит восемь валентных электронов, однако в соединениях железо обычно проявляет степени окисления (+2) и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного железа.

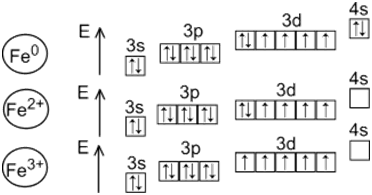
Степень окисления +3 для железа является наиболее устойчивой. Соединения железа(III) могут быть восстановлены только под действием сильных восстановителей, таких как водород в момент выделения, сероводород. Эти реакции проводят в кислой среде :
Fe2(SO4)3+H2S=2FeSO4+S+H2SO4
Железо широко распространено в природе – это самый распространенный металл, после алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком состоит из железа с примесью никеля и серы, а возможно и других элементов.
В природе железо встречается в виде руд — оксидов Fe2O3 (гематит, красный железняк) и Fe3O4 (магнетит, магнитный железняк), гидратированного оксида Fe2O3 ⋅ H2O (лимонит, бурый железняк), карбоната FeCO3 (сидерит), дисульфида FeS2 (пирит), редко встречается в виде самородков, попадающих на землю с метеоритами. Такое метеоритное железо было известно людям издревле. Освоение получения железа из железной руды послужило началом железного века.

ПОЛУЧЕНИЕ ЖЕЛЕЗА
В настоящее время железную руду восстанавливают коксом в доменных печах, при этом расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C (цементит), а частично растворяет его. При затвердевании расплава образуется чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь. Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный кислородом. Существует и прямой метод получения железа, основанный на восстановлении окатышей магнитного железняка природным газом:
Fe3O4 + CH4 = 3Fe + CO2 + 2H2O
ФИЗИЧЕСКИЕ СВОЙСТВА
Железо – серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип. 2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в структуре металла отдельных зон – доменов, магнитные моменты которых под действием внешнего магнитного поля ориентируются в одну и ту же сторону.
Железо существует в форме нескольких полиморфных (аллотропных) модификаций. При температурах ниже 9100C устойчиво железо с объемно-центрированной кристаллической решеткой (αα-Fe, немагнитное α-железо существующее при 769–9100C называют β-Fe), в интервале температур 910–14000C – более плотная модификация с кубической гранецентрированной (γγ-Fe), а выше этой температуры и вплоть до температуры плавления вновь становится устойчивой структура с объемно-центрированной ячейкой (δ-Fe).
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
· Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
· Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
· Смешанную степень окисления железо проявляет при взаимодействии с кислородом, водяным паром.

1) с кислотами. На влажном воздухе окисляется, покрываясь коричневой коркой гидратированного оксида Fe2O3 ⋅ H2O, ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl2 + H2
но пассивируется в холодных концентрированных растворах кислот-окислителях – серной и азотной.
2) с солями. Будучи металлом средней химической активности, железо вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO4= FeSO4 + Cu
При этом, как и при растворении в кислотах, образуются соли двухвалентного железа.
3) с парами воды. При температуре белого каления железо реагирует с водой. Пропуская перегретый водяной пар через раскаленный на жаровне чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H2O = Fe3O4 + 4H2.
4) с кислородом. В кислороде железо сгорает с образованием черyого порошка железной окалины – оксида железа(II, III) Fe3O4,имеющей тот же состав, что и природный минерал магнитный железняк:
3Fe + 2O2 = Fe3O4
Искры, вырывающиеся при заточке стальных ножей или при резке стальных листов ацетилено-кислородным пламенем, также представляют собой раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в образующихся соединениях зависит от силы окислителя — неметалла. Так, при взаимодействии с хлором образуется хлорид FeCl3:
2Fe + 3Cl2 = 2FeCl3,
с серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO4 + O2 + 2H2O = 4Fe(OH)SO4.
Белый осадок гидроксида железа(II) Fe(OH)2, образующийся при действии на соли железа(II) растворов щелочей, на воздухе мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II) и железа(III), который лишь через некоторое время приобретает характерный для Fe2O3 ⋅ H2O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого осадка при действии растворов щелочей, сульфидов, карбонатов на соли железа(III):
2FeCl3 + 3Na2CO3 + 6H2O = 2Fe(OH)3 +3CO2+ 6NaCl
Запомнить! Оксид и гидроксид железа(III) являются слабо амфотерными, с преобладанием основных свойств.
Так, при растворении гидроксида железа(III) в кислотах образуются соли железа(III), а при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)3 + 2H2SO4 = Fe2(SO4)3 + 3H2O,
Fe2O3 + CaO = CaFe2O4.
В концентрированных щелочах Fe(OH)3 медленно растворяется, образуя гидроксоферраты, например, Na3[Fe(OH)6]:
Fe(OH)3+3NaOHводн.=Na3[Fe(OH)6]
При действии недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
Na3[Fe(OH)6]+3HClнед.=3NaCl+Fe(OH)3↓+3H2O Na3[Fe(OH)6]+6HClизб.=3NaCl+FeCl3+6H2O
При пропускании углекислого газа они разлагаются на гидроксид железа(III) и карбонат натрия:
2Na3[Fe(OH)6]+3CO2↑=3Na2CO3+2Fe(OH)3↓+3H2O
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и угольной не могут быть выделены из водных растворов по причине полного необратимого гидролиза:
2FeCl3+3Na2S+6H2O=2Fe(OH)3+3H2S↑+6NaCl
О протекании реакции судят по выделению газа и образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O.
Запомнить! Ферраты содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.
Качественные реакции на катионы железа
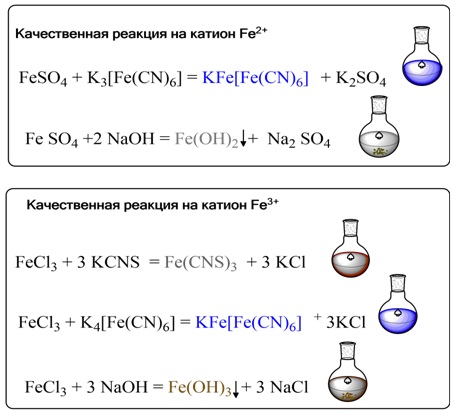
На ионы железа существуют удобные качественные реакции. Если к раствору соли железа(III) прибавить разбавленный раствор роданида калия KCNS, то образуется интенсивно-красное окрашивание, вызванное образованием роданида железа(III):
FeCl3+3KSCN=Fe(SCN)3+3KCl
Другим реагентом на ионы железа(III) служит комплексное соединение гексацианоферрат(II) калия K4[Fe(CN)6], часто называемый также «желтая кровяная соль». Такое странное на первый взгляд название связано с тем, что раньше эту соль получали нагреванием крови с поташом и железными опилками. С солями железа(III) она дает синий коллоидный раствор «берлинской лазури» или «турнбуллева синь»:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓+3KCl
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(II) с раствором «красной кровяной соли» — гексацианоферрат(III) калия K3[Fe(CN)6]:
K3[Fe(CN)6]+FeCl2=KFe[Fe(CN)6]↓+2KCl
Таким образом, красная кровяная соль служит реактивом на соли двухвалентного железа. При более высоких концентрациях растворов выделяется нерастворимая в воде форма «берлинской лазури» состава Fe4[Fe(CN)6]3.
SHAPE * MERGEFORMAT

УПРАЖНЕНИЯ
1. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Решение:
Написаны четыре уравнения описанных реакций :
1) 2Fe + 6H2SO4 → Fe2 (SO4)3 + 3SO2↑ +6H2O
2) Fe2 (SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
3) 2Fe(OH)3 → Fe2O3 + 3H2O
4) Fe 2 O 3 + Fe → 3 FeO
_________________________________________________________________
2. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Источник: himiy88.blogspot.com