Нитрат серебра – это неорганическое высокореактивное вещество, обладающее сильными окислительными свойствами. Активно используется в медицине как дезинфицирующее, кровеостанавливающее, для уничтожения бородавок. Азотнокислое серебро необходимо в фотографии, гальванотехнике, а также в аналитической химии. Оно довольно опасно и токсично, поэтому при обращении с ним следует соблюдать меры предосторожности, в некоторых областях было заменено более безопасными реагентами.
Что такое нитрат серебра, формула
Нитрат серебра представляет собой среднюю серебряную соль азотной кислоты. В составе серебро – металл переходной группы, проявляющий небольшую электроотрицательность, переменную степень окисления: от +1 до +3, а также кислотный остаток. Химическая формула:
Впервые нитрат серебра был получен в 13 веке Альбертом фон Больштедтом, это синтетическое соединение, не встречающееся в природе. Впервые его применили в 1620-х годах голландские физиологи Гельмонт и Сильвий для обеззараживания глаз новорождённых, чьи матери страдали от гонореи. Тогда же ему было дано название лунный, адский или ляписный камень (в переводе с латинского «ляпис» – камень, луной называли серебро) за его выжигающую способность.
нитрат серебро
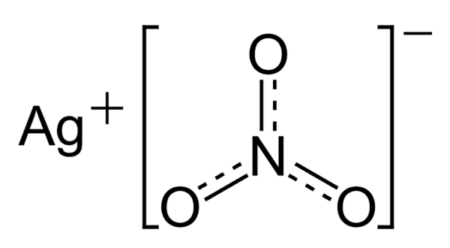
Структурная формула нитрата серебра
Физические свойства, внешний вид
Нитрат серебра – это мелкодисперсный порошок пластинчатых либо ромбических кристаллов без цвета и запаха, с острым горько-солёным неприятным вкусом. Плотность высокая, сниженная гигроскопичность. Растворимость ляписа в воде хорошая, с повышением температурного режима возрастает. Хуже растворяется в спиртах (этанол, метанол), плохо в других полярных растворителях: пиридине, ацетоне.
Ляпис плавится при температуре 209 °С, при подогревании до 300 °С начинается термическое разложение. Несмотря на гидрофильность, не образует кристаллогидратов. Устойчив к воздействию агрессивных факторов окружающей среды. Растворы дают кислое значение водородного показателя, pH менее 7.

Химические свойства, реакции
Особые химические свойства обуславливают то, что нитрат серебра реагирует с более слабыми металлами. Например, с железом, при этом серебро выпадает в осадок серебристого цвета:
Характерно реагирование серебра нитрата с щелочами. С едким натром в числе продуктов выделяется нерастворимый оксид:
В спиртовой среде при отрицательной температуре (-50 °С) взаимодействие с каустическим поташем приводит к выделению аморфной гидроокиси серебра:
Получение нитрата серебра (химия)
Ионные реакции серебра ляписа протекают по механизму обмена. С хлороводородом он даёт белый хлорид:
C цианистым калием реакция серебра нитрата идёт двумя путями:
В первом случае происходит отделение цианида серебра и растворимого нитрата калия. При втором варианте реакция серебра нитратного идёт с образованием комплекса дицианоаргентата:
Комплексообразованием характеризуется реакция серебра нитрата с концентрированными парами аммиака, образуется нитрат диамминсеребра:
Термолиз протекает до металлического серебра, бурого газа и молекулярного кислорода:
При пропускании через раствор нитрата электрического тока наблюдается электролиз:
В реакции с сероводородом происходит формирование черных сульфидов:
Производство и получение
И в лабораторных, и в промышленных условиях основой для синтеза ляписа является растворение серебра в азотной кислоте:
В лаборатории для этого выбирают чистый метал, в промышленности – серебросодержащее сырьё. Технология включает несколько этапов:
- В реакторе, снабжённом мешалкой, осуществляют растворение при атмосферном давлении и периодическом перемешивании при 35 °С.
- В раствор подают пероксид водорода, смешивают в течение 30 минут.
- Полученную массу фильтруют, в ней содержатся примеси хлораргирита, который отправляют на повторную переработку для извлечения аргентума.
- Маточный раствор переходит в кристаллизатор, в котором выделяются кристаллы. Затем происходит перекристаллизация для увеличения чистоты продукта.
- Порошок фильтруется и подаётся в вакуумную сушку, где из него извлекают ненужную жидкость.
На масштабных производствах в целях безопасности стараются применять менее концентрированную кислоту.
Применение
Основная сфера использования ляписного карандаша – медицина. Он обладает комплексом полезных фармацевтических свойств, ярко выраженной антимикробной активностью. В химии это ценный предшественник других соединений серебра, которые получают путём неорганического и органического синтеза. Нитрат серебра способен окрашивать микропрепараты и оставлять тёмные трудно смываемые следы на коже, что пригодилось для изготовления избирательных чернил.
Применение в медицине
Нитрат серебра – это действующее вещество антибактериальных препаратов, использующихся для обеззараживания свежих ран и язв. В древности им пользовались для закапывания в царапины и укусы от бешеных животных, чтобы предотвратить развитие смертельной болезни. Сегодня известно, что ляпис демонстрирует несколько фармакологических действий:
- прижигающее – запаивает края повреждений, не допуская попадания внутрь бактерий;
- противовоспалительное – снимает воспаление, покраснение и зуд, уменьшает кровоточивость;
- антисептическое – убивает патогенные микроорганизмы;
- вяжущее – создаёт на поверхности кожи тонкую защитную плёнку;
- бактерицидное – не только замедляет размножение бактериальных патогенов, но и губительно действует на их клетки;
- противогерпетическое – направлен на борьбу с бородавками.
Механизм действия ляписного карандаша заключается в связи сульфидных группировок в мембране возбудителей, что вызывает изменение конформации (формы) белка, вызывает его денатурацию. В клеточной стенке создаются отверстия, несовместимые с жизнью для болезнетворной микрофлоры. Ляпис блокирует работу их ферментных систем, замедляя развитие их колоний.
Применение в химической промышленности и других областях
Нитрат серебра – востребованный и недорогой реагент, имеющий ряд преимуществ для индустрии синтетических веществ. Он устойчив к повышенной влажности и действию ультрафиолетового излучения, смешивается с различными растворителями. Этим обусловлено его использование для добычи сульфитов, карбонатов, йодидов, в качестве индикатора загрязнений питьевой воды.
В фотографии раствор ляписа – проявитель для плёнок, компонент фотоэмульсий. В производстве зеркал он служит источником ионов серебра, а в приготовлении несмываемых чернил – основный красящий компонент.
Токсичность и опасность
Нитрат серебра – это агрессивный окислитель. Нанесение ляписного карандаша в небольших концентрациях оправданно, однако следует внимательно следить за состоянием при терапии препаратами на его основе. Соединение относится ко 2 классу опасности (высокоопасные вещества). Длительное воздействие на кожу, слизистые оболочки приводит к возникновению глубоких ожогов.
При повышении в плазме крови концентрации серебра появляются симптомы аргирии – изменения цвета кожных покровов на серо-синий. Отравление при случайном проглатывании включает дисфункцию желудочно-кишечного тракта, тошноту, рвоту. Смертельная доза – 10 г. Вдыхание пыли раздражает дыхательные пути.
Инструкция по применению
Показания
Нитрат серебра назначается для коррекции следующих состояний:
- гонококковая инфекция грудничков;
- эрозии, изъязвления, трещины;
- бородавки;
- носовые кровотечения.
Противопоказания
Главное противопоказание – индивидуальная непереносимость средства и повышенная чувствительность к нему. Это выражается в резкой аллергии, образовании отёка, сильной боли. Возникает редко. Чтобы избежать неприятных последствий, необходимо консультироваться перед использованием.
Способ применения и дозы
Лекарство наносят на поражённый участок тонким слоем, не рекомендуется дотрагиваться до здоровых зон раз в три дня. Продолжительность лечения определяется индивидуально, как правило до исчезновения симптоматики.
Побочные эффекты, передозировка
При несоблюдении инструкции могут возникнуть аллергические реакции, ухудшение самочувствия, ожоги. Необходимо четко следовать указаниям врача.
Где купить и сколько стоит
Технический нитрат серебра продаётся заводами-производителями оптом, либо специализированными интернет-магазинами в розницу. Оптовая цена составляет 100 руб/кг, розничная – 1700 рублей за 100 грамм. Медикамент продаётся в аптеках, стоимость порядка 200-300 рублей.
Заключение
Нитрат серебра – это важное для фармацевтики соединение, получаемое на основе смешивания кислоты и серебром. Раствор нитратов используются как проявитель фото, для получения реактивов. Препараты проявляют бактереостатическую и противомикробную активность. Использовать их нужно осторожно, т.к. активный компонент может отрицательно воздействовать на неповреждённую слизистую.
- Сульфат алюминия: свойства, применение
- Дихлорметан: свойства, реакции, применение
- Алюмосиликаты: свойства, виды, получение, применение
- Оксиды железа: свойства, реакции, применение, польза и вред
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Источник: chtoikak.ru
Формула нитрата серебра
Нитрат серебра (азотнокислое серебро, адский камень, ляпис) – соль металла серебра и азотной кислоты.

Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это твёрдое вещество, представляющее из себя бесцветные ромбические кристаллы, с плотностью 4,352 г/см , хорошо растворяется в воде 222,5 г/100 г ( ).
Растворимость в метаноле и этаноле равно соответственно 3,6 г/100 г и 2,12 г/100, температура плавления , выше разлагается.
Химические свойства нитрата серебра
- взаимодействует c металлами, стоящими в ряду напряжения левее серебра:
![[ 2AgNO_3 + Fe = Fe(NO_3)_2 + 2Ag downarrow ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-621231e771a01f904b53ca77164834a8_l3.png)
- Взаимодействует с основаниями:
![[ AgNO_3 + NaOH = Ag_2O downarrow + H_2O + NaNO_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b8868981c43ada8c0a1e3edda5c053fd_l3.png)
- взаимодействует кислотами и солями по обменному механизму с выпадением осадка или комплексообразованием, с органическими веществами, которые имеют в своём составе альдегидную группу:
![[ AgNO_3 + HCl = AgCl downarrow + HNO_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d5a418e6be4f6c279e7c91e40cf696b2_l3.png)
![[ AgNO_3 + NaCl = AgCl downarrow + NaNO_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0af99e329a8f5d600378d70809b537a6_l3.png)
![[ AgNO_3 + KCN = AgCN downarrow + KNO_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f08ef1fe789e13500daa0fc1c6698e52_l3.png)
![[ AgNO_3 + 2KCN = K[Ag(CN)_2] + KNO_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f29c9297ad07b1447e0ebc5fcb201d72_l3.png)
![[ 2AgNO_3 + 3NH_4OH + HCHO = 2Ag downarrow + HCOONH_4 + 2NH_4NO_3 + 2H_2O ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f9ac6ca2b10e1243d14ac645c2b9b3b6_l3.png)
- При нагревании разлагается:
![[ 2AgNO_3 = 2Ag + 2NO_2 uparrow + O_2 uparrow ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a06f98a22bc05da0bb77f95e2e506026_l3.png)
Получение
Нитрат серебра получают растворением металлического серебра в концентрированной азотной кислоте:
![]()
Качественная реакция
Качественной реакцией на нитрат-ион является образование тёмно-бурого раствора сульфата нитрозожелеза (II) при взаимодействии с в сильно кислой среде:
![]()
![]()
Качественной реакцией на ионы серебра является образование белого творожистого осадка хлорида серебра при добавлении к раствору или :
![]()
Применение
Нитрат серебра применяется в медицине для прижигания небольших ран и бородавок.
В малых концентрациях он используется в качестве противовоспалительного и вяжущего средства.
Также используется в изготовлении зеркал.
Примеры решения задач
| Задание | Рассчитайте эффективную степень диссоциации в воде при моляльности раствора моль/кг, если понижение температуры замерзания этого раствора равно град. |
| Решение | На первом шаге вычислим изотонический коэффициент, который показывает формальное число частиц, на которое продиссоциировало соединение: |
![]()
— криоскопическая постоянная воды
Рассчитаем степень диссоциации :
![]()
или
— число ионов, на которые диссоциирует .
| Задание | Рассчитайте концентрацию ионов серебра в насыщенном растворе метанола при для . |
| Решение | в является слабым электролитом, поэтому запишем диссоциацию через константу равновесия: |
![]()
Равновесные концентрации частиц:
Здесь — исходная концентрация нитрата серебра, — убыль концентрации .
![]()
![]()
моль/л — молярность насыщенного раствора
![]()
![]()
![]()
моль/л
Источник: ru.solverbook.com
Нитрат серебра I

Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:

Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине


Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.

Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
-
Изображения нитрата серебра


Соединения серебра
- Серебро (Ag)
- Азид серебра (AgN3) Тринитрид серебра
- Амид серебра (AgNH2)
- Антимонид серебра I (Ag3Sb)
- Арсенат серебра I (Ag3AsO4) Арсенат серебра
- Арсенид серебра I (Ag3As) Арсенид трисеребра
- Ацетат серебра (AgC2H3O2) Серебро уксуснокислое
- Ацетиленид серебра (Ag2C2)
- Бензоат серебра (AgC7H5O2) Серебро бензойнокислое
- Бромат серебра I (AgBrO3) Серебро бромноватокислое
- Бромид серебра I (AgBr) Серебро бромистое
- Вольфрамат серебра (Ag2WO4) Серебро вольфрамовокислое
- Гексафторогерманат серебра (Ag2[GeF6])
- Гидроксид серебра (AgOH) Гидроокись серебра
- Гидрофосфат серебра (Ag2HPO4) Фосфорнокислое серебро кислое
- Гипонитрит серебра (Ag2N2O2) Серебро азотноватистокислый
- Диборид серебра (AgB2) Серебро бористое
- Дигидрофосфат серебра (AgH2PO4)
- Дихромат серебра (Ag2Cr2O7) Бихромат серебра (Серебро двухромовокислое)
- Йодат серебра (AgIO3) Серебро йодноватокислое
- Йодид серебра I (AgI) Серебро йодистое
- Карбонат серебра I (Ag2CO3) Серебро углекислое
- Лактат серебра (AgC3H5O3) Серебро молочнокислое
- Лаурат серебра (AgC12H23O2) Серебро лауриновокислое
- Метафосфат серебра (AgPO3) Серебро фосфорнокислое
- Молибдат серебра (Ag2MoO4) Серебро молибденовокислое
- Нитрат серебра I (AgNO3) Серебро азотнокислое (Ляпис или адский камень)
- Нитрат серебра II (Ag(NO3)2) Азотнокислое серебро
- Нитрид серебра I (Ag3N)Серебро азотистое
- Нитрит серебра I (AgNO2) Серебро азотистокислое
- Оксалат серебра (Ag2C2O4) Серебро щавелевокислое
- Оксид серебра I (Ag2O) Окись серебра
- Оксид серебра III (Ag2O3)
- Оксид серебра I,III (Ag2O2) Серебро окись
- Ортоарсенит серебра I (Ag3AsO3) Арсенит серебра
- Ортофосфат серебра I (Ag3PO4)
- Пальмитат серебра (AgC16H31O2) Серебро пальмитиновокислое
- Периодат серебра (AgIO4) Серебро йоднокислое
- Перманганат серебра (AgMnO4) Серебро марганцовокислое
- Перренат серебра (AgReO4) Серебро рениевокислое
- Перхлорат серебра (AgClO4) Серебро хлорнокислое
- Пирофосфат серебра (Ag4P2O7) Дифосфат серебра
- Пропионат серебра (AgC3H5O2) Серебро пропионовокислое
- Реактив Толленса ([Ag(NH3)2]ОН)
- Селенат серебра (Ag2SeO4) Серебро селеновокислое
- Селенид дисеребра (Ag2Se) Серебро селенистое
- Селенит серебра (Ag2SeO3) Серебро селенистокислое
- Субфторид серебра (Ag2F) Гемифторид серебра
- Сульфат серебра (Ag2SO4) Серебро сернокислое
- Сульфид серебра I (Ag2S) Серебро сернистое
- Сульфид серебра II (AgS) Сернистое серебро
- Сульфит серебра (Ag2SO3) Серебро сернистокислое
- Тартрат серебра (Ag2C4H4O6) Серебро виннокислое
- Теллурид серебра (AgTe) Серебро теллуристое
- Теллурид серебра I (Ag2Te) Теллурид дисеребра
- Теллурит серебра (Ag2TeO3) Серебро теллуристокислое
- Тетрафтороборат серебра (Ag[BF4]) Тетрафторобориат серебра
- Тиоантимонит серебра (Ag3SbS3) Серебро тиосурьмянистокислое
- Тиосульфат серебра (Ag2S2O3) Серебро тиосернокислое
- Тиоцианат серебра I (AgSCN) Серебро роданистое
- Фосфид серебра (Ag3P) Серебро фосфористое
- Фторид серебра I (AgF) Серебро фтористое
- Фторид серебра II (AgF2) Фтористое серебро
- Фульминат серебра (AgONC) Гремучее серебро
- Хлорат серебра (AgClO3) Серебро хлорноватокислое
- Хромат серебра (Ag2CrO4) Серебро хромовокислое
- Хлорид серебра I (AgCl) Серебро хлористое
- Хлорит серебра (AgClO2) Серебро хлористокислое
- Цианамид серебра (Ag2CN2)
- Цианат серебра (AgOCN) Серебро циановокислое
- Цианид серебра I (AgCN) Серебро цианистое
- Цитрат серебра (Ag3C6H5O7) Серебро лимоннокислое
Любое копирование, в т.ч. отдельных частей текстов или изображений, публикация и републикация, перепечатка или любое другое распространение информации, в какой бы форме и каким бы техническим способом оно не осуществлялось, строго запрещается без предварительного письменного согласия со стороны редакции. Во время цитирования информации подписчиками ссылки обязательны. Допускается цитирование материалов сайта без получения предварительного согласия, но в объеме не более одного абзаца и с обязательной прямой, открытой для поисковых систем гиперссылкой на сайт.
Источник: chem.ru