При электролизе водного раствора AgNO3 в течение 50 мин и силе тока 3А на катоде выделилось 9,6 г серебра. Определите выход по току. сила течение раствор ток выход мина серебро катод электролиз
Поделиться
Инна Бодрова
I = 3 A
t = 50 мин = 3000 с
m(Ag)факт = 9,6 г
Поскольку соль AgNO3 образована слабым основанием и сильной кислотой, а материал анода не оговорен, то будем считать, что имеем электролиз с инертным анодом в кислой среде.
Анодный процесс
На аноде могут протекать два процесса – электрохимическое окисление воды с выделением кислорода и окисление аниона. Однако, поскольку в растворе находятся анионы NO3^(-), в которых азот имеет высшую степень окисления, то дальнейшее окисление аниона невозможно. Следовательно, в растворе будет протекать электрохимическое окисление воды.
Анод (+) 2Н2О – 4е = О2↑ + 4Н (+) (рН ≤ 7)
Катодный процесс
На катоде могут протекать два процесса – восстановление ионов Ag(+) и восстановление ионов водорода Н (+).
снятие посеребренки электролизом
2Н (+) + 2е = Н2 (pH < 7); Еo восст = – 0,41 В
Ag(+) + e = Ag; Еo восст = + 0,799 В (при инертном аноде)
Поскольку электродный потенциал восстановления ионов серебра Ag (+) больше, чем электродный потенциал восстановления ионов водорода, то на катоде будут восстанавливаться ионы серебра Ag (+).
Катод (-)Ag(+) + e = Ag
Схема электролиза
Катод (-)Ag(+) + e = Ag | 4 — восстановление
Анод (+) 2Н2О – 4е = О2 + 4Н (+) | 1 – окисление
Ионное уравнение окислительно-восстановительной реакции.
4Ag(+) + 2Н2О = 4Ag + О2↑ + 4Н (+)
Молекулярное уравнение окислительно-восстановительной реакции.
4AgNO3 + 2Н2О = 4Ag↓ + О2↑ + 4НNO3
Электрохимический эквивалент серебра
k(Ag) = M(Ag)/(z(Ag)*F) = 108/(1* 96500) = 11,2*10^(-4) г/Кл
M(Ag) = 108 г/моль – молярная масса серебра
z(Ag) = 1 – число принимаемых ионом серебра Ag(+) электронов, равное валентности серебра
F = 96500 Кл/моль – постоянная Фарадея
Заряд, прошедший через электролит
q = I*t = 3*3000 = 9000 Кл
По первому закону Фарадея теоретическая масса выделившегося серебра
m(Ag)теор = q*k(Ag) = 9000*11,2*10^(-4) = 10,08 г
Выход серебра
q = [m(Ag)факт/m(Ag)теор] *100% = [9,6/10,08]*100% = 95,2%
Поделиться
Natali Rakhmanina
m теор. Ag = 108*3*50*60/(1*96485) = 10.0741 г;
выход = 8.6/10.0741 = 0.8537 (85.37%);
на катоде: Ag+ +e- = Ag,
на аноде: 2H2O -4e- = O2↑ + 4H+,
сумм. ур-е: 4AgNO3 + 2H2O = 4Ag + O2↑ + 4HNO3.
Поделиться
Татьяна Платицына
Больше не о чем спросить, умник?
Поделиться
а можно это серебро собрать?))))
Источник: sprashivalka.com
Электрохимия В 13. Задача 1 При электролизе водного раствора серебра азотнокислого (AgNO3) в течение 50 минут при силе тока 3А выделилось 9,6 грамм серебра

Единственный в мире Музей Смайликов
Самая яркая достопримечательность Крыма

Скачать 44.44 Kb.
При электролизе водного раствора серебра азотнокислого (AgNO3) в течение 50 минут при силе тока 3А выделилось 9,6 грамм серебра.
Определить электрохимический эквивалент серебра.
I = 3 A
t = 50 мин = 3000 с
m(Ag)факт = 9,6 г
Поскольку соль AgNO3 образована слабым основанием и сильной кислотой, а материал анода не оговорен, то будем считать, что имеем электролиз с инертным анодом в кислой среде.
Анодный процесс
На аноде могут протекать два процесса – электрохимическое окисление воды с выделением кислорода и окисление аниона. Однако, поскольку в растворе находятся анионы NO3^(-), в которых азот имеет высшую степень окисления, то дальнейшее окисление аниона невозможно. Следовательно, в растворе будет протекать электрохимическое окисление воды.
Анод (+) 2Н2О – 4е = О2↑ + 4Н (+) (рН ≤ 7)
Катодный процесс
На катоде могут протекать два процесса – восстановление ионов Ag(+) и восстановление ионов водорода Н (+).
2Н (+) + 2е = Н2 (pH o восст = – 0,41 В
Ag(+) + e = Ag; Е o восст = + 0,799 В (при инертном аноде)
Поскольку электродный потенциал восстановления ионов серебра Ag (+) больше, чем электродный потенциал восстановления ионов водорода, то на катоде будут восстанавливаться ионы серебра Ag (+).
Катод (-)Ag(+) + e = Ag
Схема электролиза
Катод (-)Ag(+) + e = Ag | 4 — восстановление
Анод (+) 2Н2О – 4е = О2 + 4Н (+) | 1 – окисление
Ионное уравнение окислительно-восстановительной реакции.
4Ag(+) + 2Н2О = 4Ag + О2↑ + 4Н (+)
Молекулярное уравнение окислительно-восстановительной реакции.
4AgNO3 + 2Н2О = 4Ag↓ + О2↑ + 4НNO3
Электрохимический эквивалент — количество вещества, которое должно выделиться во время электролиза на электроде , согласно закону Фарадея , при прохождении через электролит единицы количества электричества. Электрохимический эквивалент измеряется в кг / Кл .
Электрохимический эквивалент серебра
k(Ag) = M(Ag)/(z(Ag)*F) = 108/(1* 96500) = 11,2*10^(-4) г/Кл
M(Ag) = 108 г/моль – молярная масса серебра
z(Ag) = 1 – число принимаемых ионом серебра Ag(+) электронов, равное валентности серебра
F = 96500 Кл/моль – постоянная Фарадея
Заряд, прошедший через электролит
q = I*t = 3*3000 = 9000 Кл
По первому закону Фарадея теоретическая масса выделившегося серебра
m(Ag)теор = q*k(Ag) = 9000*11,2*10 -4 = 10,08 г
Выход серебра
q = [m(Ag)факт/m(Ag)теор] *100% = [9,6/10,08]*100% = 95,2%
Какая масса меди осаждается на катоде при прохождении тока силой 2А через раствор медного купороса (CuSO4) течение 15 минут?
На катоде могут протекать два процесса – восстановление ионов Cu 2+ и восстановление ионов водорода Н + .
2Н + + 2е = Н2 (pH o восст = – 0,41 В
Cu 2+ + 2e = Cu; Е o восст = + 0,337 В (при инертном аноде)
Поскольку электродный потенциал восстановления ионов меди Cu 2+ больше, чем электродный потенциал восстановления ионов водорода, то на катоде будут восстанавливаться ионы меди Cu 2+ .
Катод (-)Cu 2+ + 2e = Cu
По первому закону Фарадея теоретическая масса выделившейся меди :
М- молярная масса меди, М(Сu)=64 г/моль;
I- сила тока, I=2А
τ — время проведения электролиза, с; τ = 15∙60 с
z – число принимаемых ионом меди Cu 2+ электронов, равное валентности меди, z(Cu) = 2
F — постоянная Фарадея, равная 96500 Кл/моль
Теоретический вопрос
Условия образования дендритных осадков.
Факторы, оказывающие влияние на кинетику кристаллизации и размер зерен, оказывают влияние и на их форму. В условиях близких к равновесию образуются правильно ограненные кристаллы. Они растут медленно, поверхность их гладкая, хотя и содержит необходимые для застройки граней ступеньки (рисунок 2.8).
С увеличением степени переохлаждения межфазная поверхность становится неровной, на поверхности металла появляется множество ячеек, средняя часть которых несколько выдвигается в расплав (рисунок 2.8, б).
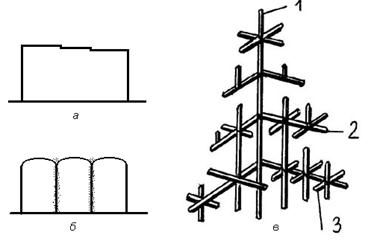 |
| Рисунок 2.8. Формы роста кристаллов в расплаве при кристаллизации: а — плоский (ограненный) кристалл; б — столбчатый ячеистый; в — дендритный: цифры у осей — соответственно, оси первого, второго и третьего порядков |
Появление ячеистой структуры связывается с присутствием в расплаве и перераспределением примесей. При наличии постоянного теплоотвода от поверхности отливки в первую очередь кристаллизуются наиболее чистые по содержанию примесей участки жидкого металла, в связи с чем наблюдается выдвижение фронта кристаллизации в расплав. Объемы жидкого металла, наиболее загрязненные примесями оттесняются в появившиеся впадинки на фронте кристаллизации, затвердевают в последнюю очередь и образуют границы ячеек. Выращенный в таких условиях кристалл приобретает столбчатую, вытянутую в направлении теплоотвода форму, напоминающую связку карандашей, боковые поверхности которых соответствуют обогащенным примесями границам зерен.
При еще большем увеличении степени переохлаждения, что достигается увеличением теплоотвода от кристаллизирующейся жидкости, выступы на межфазной границе становятся настолько большими, что жидкость между выступами значительно отстает по темпу затвердевания от выступающих частей кристалла. Наступает так называемый дендритный тип кристаллизации.
Образовавшиеся длинные выступы становятся осями первого порядка. При возникновении на поверхности этих осей неровностей (выступов) появляются новые направления возможного роста кристалла, т.е. оси второго, третьего порядка и т.д. Кристалл в процессе роста напоминает дерево в среде жидкого металла.
Если обеспечить слив металла, не закристаллизовавшегося к данному моменту времени, то можно получить дендрит в чистом виде — иллюстрацию для изучения дендритного роста кристаллов (дендрит Чернова). Наслаивание металла на образовавшиеся оси первого, второго и т.д. порядков при последующей кристаллизации приводит к заполнению всего междендритного пространства и образованию сплошного кристалла. Однако слои металла, образующие сплошной кристалл, появившиеся в различные моменты кристаллизации отличаются по содержанию примесей. Оси формируются наиболее чистым металлом, участки, закристаллизовавшиеся в междендритном пространстве в последнюю очередь. Последние наиболее сильно загрязнены примесями.
Дендритный рост кристаллов объясняется следующим образом. Наиболее стабильным кристаллом, например металла с ГЦК решеткой, является кристалл, образованный наиболее плотно упакованными плоскостями (111).Такой кристалл имеет форму октаэдра (рисунок 2.9).
Грани октаэдра обладают минимальной свободной энергией. Вершины октаэдра, как правило, обладают значительным количеством дефектов кристаллического строения, повышенной свободной энергией. В связи с этим уже на ранних этапах роста октаэдрический кристалл отбрасывает шесть отростков в трех взаимно перпендикулярных направлениях. Эти отростки превращаются в оси первого порядка, ответвления от которых образуют оси второго, третьего и т.д. порядков.
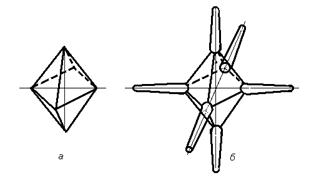 |
| Рисунок 2.9. Начальные этапы дендритного роста кристаллов: а — рост совершенного ограненного кристалла в виде октаэдра; б — образование отростков (дендритных осей первого порядка) |
Ускоренный рост выступающих участков дендрита обусловлен несколькими причинами:
1. Особенности упаковки атомов и преимущественное расположение выходов дефектов кристаллического строения на поверхности этих участков.
2. Выступающие участки кристалла соприкасаются с большим объемом жидкости, приходящейся на единицу их поверхности. За счет этого быстрее рассеивается теплота кристаллизации, выделяющаяся на фронте затвердевания. При этом оказывается, что острие соприкасается с более охлажденным металлом, чем около боковых поверхностей, в связи с чем кристаллизация оказывается более выгодной у острия.
Источник: topuch.com
При электролизе водного раствора нитрата серебра (AgNO3) с серебряными электродами масса одного из электродов увеличилась на 53,9 г. Как изменилась масса другого электрода

Готовое решение: Заказ №8435

Тип работы: Задача

Статус: Выполнен (Зачтена преподавателем ВУЗа)

Предмет: Химия

Дата выполнения: 07.09.2020

Цена: 228 руб.
Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
При электролизе водного раствора нитрата серебра (AgNO3) с серебряными электродами масса одного из электродов увеличилась на 53,9 г. Как изменилась масса другого электрода, какое количество электричества (в числах Фарадея) было пропущено через электролизер?
Решение :
Составим схему электролиза:
На катоде: Ag + + 1ē = Ag На аноде: Ag – 1ē = Ag +
Продукты электролиза – Ag и Ag + .

- На основе метода валентных связей (МВС) предположить пространственное строение молекулы и определить является ли молекула диполем: 12. NF3
- Используя принципы метода МО, составить энергетическую диаграмму молекулы, написать электронную конфигурацию и определить кратность связи: 12. Описание молекулы NO
- Какие коррозионные процессы протекают при хранении во влажной атмосфере кобальтового стержня, лежащего на хромированной медной подставке?
- Составить гальванический элемент с оловянными электродами. Рассчитать ЭДС элемента. Концентрации электролита у анода и катода задать самостоятельно. Написать электродные процессы.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
В случае копирования материалов, указание web-ссылки на сайт natalibrilenova.ru обязательно.
Источник: natalibrilenova.ru