Все во Вселенной — от ядра Земли до самых дальних галактик — состоит из атомов. Это фундаментальная единица элемента.
К настоящему времени было идентифицировано 118 элементов (все они перечислены в периодической таблице).
Слово «атом», означающее «неделимый», происходит от древнегреческого слова «ἄτομος». Древнегреческие философы считали, что атом невозможно разделить на что-то меньшее. Однако ученые доказали этот факт неправильно в начале 20 века, когда они открыли субатомные частицы (электроны, протоны, нейтроны).
Ниже мы перечислили некоторые из наиболее интригующих фактов об атомах, которые только сделают вас умнее. Так что давайте начнем с самого короткого и простого.
1. Состав атомов
Каждый атом содержит одно ядро [в центре] и один или несколько электронов. Ядро обычно состоит из равного числа протонов и нейтронов, вместе называемых нуклонами.
Водород — Самый ЛЕГКИЙ Газ во Вселенной!
2. Ядро содержит почти всю массу
Ядро, расположенное в центре атома, составляет более 99,9 % его массы, но занимает лишь одну триллионную его общего объема. Таким образом, большая часть пространства внутри атома пуста.
3. Электроны чрезвычайно малы

Электрон является наиболее активным компонентом атома, но он почти ничего не вносит в массу атома. Например, в атоме водорода масса электрона составляет всего 0,0005 массы ядра.
4. Атом может иметь электрический заряд
Электроны несут отрицательный заряд, протоны несут положительный заряд, а нейтроны не имеют электрического заряда. Атом электрически нейтрален, если он имеет одинаковое количество электронов и протонов.
Однако, если атом имеет меньше или больше протонов, чем электронов, он имеет общий положительный или отрицательный заряд (известный как Ион).
5. Что удерживает протоны и нейтроны вместе?
Ядерная сила удерживает протоны и нейтроны вместе в ядре атома. Электроны притягиваются к протонам другой силой, называемой электромагнитной силой, которая слабее ядерной силы.
Эта ядерная сила примерно в 1038 раз сильнее гравитационной, но действует только в очень малых масштабах.
6. 94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя некоторые встречаются в незначительных количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
7. Каждый атом уникален
Каждый атом содержит определенное количество протонов в ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра содержат 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные характеристики зависят от количества электронов в атоме.
8. Самый большой и самый маленький атом
Самым большим элементом (по размеру) является Франций, но поскольку он крайне нестабилен, предпочтение отдается Цезию. У него большая валентная оболочка и относительно менее эффективный заряд ядра.
Аэрогель — самый легкий твердый материал [Veritasium]
Наименьший элемент — гелий, первый в группе благородных газов в периодической таблице. Его атомный радиус примерно в 9 раз меньше диаметра цезия.
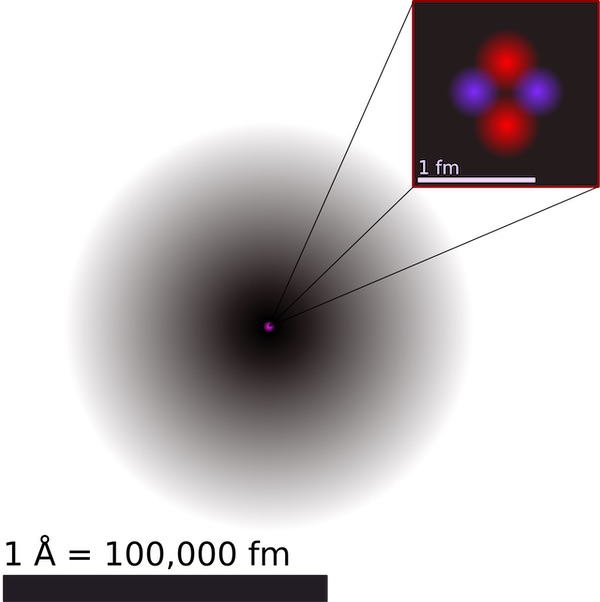
9. Самый тяжелый и легкий атом
Оганессон — самый тяжелый элемент (по атомной массе), открытый в 2002 году. Это первый благородный газ, который удивительно химически активен и проявляет очень необычные физические и химические свойства.
Оганессон, однако, является самым тяжелым синтетическим химическим элементом. Самым тяжелым природным элементом является Уран с атомным весом 238,029.
Элемент, который имеет самый легкий атом-это водород. У него есть только один протон, обращающийся вокруг одного электрона. Его самый распространенный изотоп, известный как Протий, состоит из одного протона и нулевых нейтронов.
10. Возможно ли преобразовать один элемент в другой?
В некоторых экстремальных условиях электромагнитная сила (которая отталкивает электроны и протоны) преодолевает сильную ядерную силу, выбрасывая нуклоны из атомного ядра и оставляя после себя совершенно другой элемент. Это именно то, что происходит при делении ядер.
Однако этот процесс [распада] является дорогостоящим и опасным. Ученые пока не смогли безопасно генерировать энергию с помощью ядерного деления.
11. Атомы в человеческом теле
Тело человека весом 70 кг состоит из 7 × 10 27 атомов. Три атома (водород, кислород и углерод) составляют до 99 процентов от общего количества.
Что еще интереснее, 98 процентов этих атомов обновляются каждый год, даже не подозревая об этом. Самая быстро меняющаяся молекула — это вода: почти 50 процентов молекул воды в организме заменяются каждые 8 дней.
Более того, человеческий волос — 100 нанометров в поперечнике — состоит из миллиона атомов углерода.
12. Сколько атомов существует во Вселенной?
Наблюдаемая вселенная огромна: она охватывает приблизительно 93 миллиарда световых лет. Согласно теоретической оценке, в нашей вселенной насчитывается от 10 78 до 10 82 атомов.
Это не какой-то выдуманный номер. Расчеты основаны на достоверных данных (что мы знаем о вселенной). Однако между этими оценками существует огромная разница, что говорит о значительной степени ошибки. Более точные цифры будут доступны, когда мы узнаем больше о космосе.
13. Радиоактивные атомы
В нестабильном атоме силы неуравновешенны. В этом случае атомное ядро содержит избыток либо протонов, либо нейтронов. Атом пытается достичь стабильного состояния, выбрасывая свои дополнительные частицы или высвобождая энергию в других формах. Элементы, содержащие такие нестабильные ядра, называются радиоактивными.
Фермий, например, является радиоактивным элементом: его самый стабильный изотоп (Fm-257) имеет период полураспада 100,5 суток.
14. Видя атомы
Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом.

Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах.
15. Квантовая природа атомных свойств
Поскольку атомы чрезвычайно малы по размеру, они проявляют квантовые свойства, поэтому предсказание их поведения с применением классической физики всегда приведет к неверным результатам.
Когда электрон прыгает с одного энергетического уровня (орбиты) на другой, он не перемещается в пространстве между ними. Вместо этого он исчезает с одной орбиты, а затем сразу же появляется на другой орбите.
Чтобы лучше описать и оценить их поведение, несколько атомных моделей включили в себя законы квантовой физики.
Источник: new-science.ru
Какой элемент периодической таблицы самый легкий?
Самый легкий элемент в таблице Менделеева — водород. Атомный вес водорода — 1,00794, а атомный номер — 1. Водород — самый распространенный элемент в периодической таблице, 75 процентов массы Вселенной состоит из водорода.
Первый элемент периодической таблицы — водород. Физическая форма этого элемента при комнатной температуре представляет собой газ без цвета и запаха. Водород имеет множество применений, однако водород обычно используется для производства аммиака и переработки ископаемого топлива. Водород играет важную роль в изучении сверхпроводимости, а его жидкая форма используется в криогенике. Другие распространенные применения водорода включают наполнение воздушных шаров, производство соляной кислоты, производство ракетного топлива и создание топливных элементов.
Похожие посты




Другие интересные посты
Источник: ru.411answers.com
Легкие металлы — перечень, свойства и польза элементов
Официально такой группы химических элементов не существует. Неофициально в нее занесены вещества с малой плотностью. Легкие металлы востребованы промышленным, оборонным комплексом, медициной, сферой красоты.

Что представляют собой
В номенклатуре IUPAC – уважаемой в мире международной организации, курирующей теорию и практику в сфере химии, термин « легкие металлы » отсутствует.
Неофициально к легким металлам относятся вещества с плотностью менее 5 граммов на кубический сантиметр.
Разные списки включают пять – десять позиций.
Самое распространенное деление – по используемости:
- На этом основании выделяют пять главных: алюминий, бериллий, магний, титан, литий.
- Их дополняет «экзотика»: галлий, индий, висмут, таллий, кадмий.
Вторая группа причисляется к редким металлам.
Редкими эти элементы названы потому, что на практике используются недавно и не так широко, как традиционные материалы.
Физико-химические характеристики
Общие характеристики легких металлов:

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
- Малая плотность.
- Металлический блеск.
- Серебристо-белый цвет.
Самый легкий элемент в группе – литий. Кубик из него ребром в 1 см весит полграмма (то есть плотность лития 0,533 г/см3).
Другие базовые свойства элементов разнятся. Например, алюминий – самый мягкий, титан и бериллий – самые прочные. Индий – самый блестящий.
Классификация
Каждый представитель «легкой» группы относится еще к какому-нибудь сообществу.
Основанием становится не плотность, а другие физико-химические характеристики:
- Щелочные элементы – литий.
- Щелочноземельные – бериллий, магний.
- Цветные металлы – алюминий, титан, магний.
- Легкоплавкие – висмут, галлий, кадмий, таллий, индий.
- Тугоплавкие – титан, магний.
Каждый химический элемент наделен специфическими свойствами, присущими своей группе.
Как представлены в природе
На легкий металлический сегмент приходится пятая часть литосферы (по массе).
Чаще они входят в состав руды либо минерала. Особенно химически сверхактивные элементы, например, литий. Этот самый легкий металл в природе представлен собственными минералами – лепидолитовой слюдой и сподуменом.

Способы получения
Технологию выплавки легких металлов отработали к середине 19 века.
Для их получения в металлургии используется три способа:
- Электролиз расплава солей. То есть аккумуляция на электродах компонентов растворенных либо других веществ. Реакцию запускает электрический ток, пропускаемый через раствор либо расплав электролита.
- Металлотермия. Восстановление из их соединений другими, более активными металлами. Процесс проходит при повышенных температурах.
- Электротермия. Материал нагревается, затем расплавляется теплом, полученным из электрического тока.
Производство легких элементов – весьма энергоемкий процесс. Поэтому металлургические комбинаты располагают поближе к источникам энергии.
В отличие от тяжелых металлов: их базовые предприятия привязывают к месторождению.
Ценностью легких, особенно цветных металлов, обусловлен второй способ получения – переработка лома.
Сферы использования
Главная миссия легких элементов – уменьшать массу конечного продукта. Недаром металлурги используют их и самостоятельно, и как добавку к сплавам из более тяжелого материала:
- Традиционная сфера применения, например, алюминия – авиа-, автомобилестроение.

- Алюминий, тугоплавкий магний, титан пластичны, прочны, поэтому входят в ТОП-4 конструкционных материалов.

- Литий – главный исходник при производстве аккумуляторов.

Этот щелочной элемент – материал третьего тысячелетия, поскольку незаменим при производстве электромобилей, смартфонов, других гаджетов.
- Без прочных элементов не обходится военно-промышленный, сегмент, атомная сфера.
Свойства элементов оценила медицина:
- Биологически совместимый с организмом человека титан – материал зубных и костных протезов.
- Психиатры используют соединения лития как седатив для пациентов с нестабильной психикой.
Серебряно-белый титан любят ювелиры.
Источник: jgems.ru