Электрохимический ряд напряжений металлов опытным путем установил Алессандро Вольта, на тот момент он выглядел следующим образом: Zn, Pb, Sn, Fe, Cu, Ag, Au. Величина электродного потенциала зависела оттого, насколько далеко отстояли друг от друга члены ряда. Но причина этого была неизвестна. В 1853 г. русский учёный Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему “Исследование над явлениями вытеснения одних элементов другими”. В этой работе он обобщил различные исследования способности одних металлов вытеснять другие из растворов их солей.
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта.
Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Металлы. Тема 34. Взаимодействие металлов с водой, растворами солей других металлов. Видеоопыт
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Ряд активности металлов
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Металлы, которые водород восстанавливает из их оксидов
K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr
Fe, Cd, Co, Ni, Sn, Pb, W, Sb, As, Bi, Cu, Hg, Ag
Источник: himgdz.ru
Взаимодействие металлов с растворами солей
При взаимодействии с неметаллами концентрированная азотная кислота восстанавливается до диоксида азота, а разбавленная – до монооксида азота.
Причины разрушения металлов (окисления, химической коррозии) в растворах солей могут быть различными в зависимости от состава конкретной системы, с которой контактирует металл. Чаще всеговстречаются следующие случаи.
1.Металл + раствор соли менее активного металла с большим по величине СЭПОТ: Zn +2AgNO3 = Zn(NO3)2+2 Ag
E o (Zn 2+ /Zn o ) = -0,76B (более акт.металл); E o (Ag + /Ag o ) = +0,8B
DЕ о = 0,8 – (-0,76) = 1,56В.
Более активный металл – цинк вытесняет менее активный металл – серебро из раствора соли. При этом более активный цинк окисляется катионами менее активного металла Ag + .
Вывод: любой металл в ряду стандартных электродных потенциалов обладает способностью вытеснять все нижестоящие за ним металлы из растворов их солей.
Однако это не означает, что вытеснение обязательно происходит во всех случаях. Например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuS04. Это объясняется тем, что хлорид-ион Сl — быстро разрушает защитную поверхностную пленку на алюминии, а сульфат-ион SO4 2- практически не разрушает ее.
2.Металл + раствор соли более активного металла с меньшим по величине СЭПОТ.
а) Fe + Mg(NO3)2 + H2O = E o (Fe 2+ /Fe o ) = — 0,44B E o (Mg 2+ /Mg o ) = -2,37B DЕ о = -2,37 – (-0,44) < 0 – реакция т/д невозможна.
Однако, нитрат магния подвергается гидролизу (в состав соли входит катион слабого основания и сильной кислоты), и реакции среды будет кислая. Запишем уравнение гидролиза той ступени, которая практически идет:
Образующаяся кислота взаимодействует с железом:
Складываем эти два уравнения, умножая первое на 4, с учетом 4-х молей кислоты. т.к. вся образующаяся кислота расходуется на окисление железа:
В данном растворе железо окисляется разбавленной азотной кислотой, образующейся при гидролизе нитрата магния.
1) K2S + H2O = КОН + КНS / x 2 рН > 7, среда щелочная. Далее протекает взаимодействие алюминия с раствором щелочи. Поскольку оксид алюминия, покрывающий поверхность металла, обладает амфотерными свойствами, он легко растворяется в щелочной среде и металл будет окисляться водой, как показано ниже.
Складывая два последних уравнения реакций, получаем:
Для написания окончательного уравнения реакции (б), протекающей в данной системе, необходимо суммировать уравнения 2 и 3:
Вывод: При взаимодействии менее активного металла причиной его окисления является взаимодействие с продуктами гидролиза соли – кислотой или щелочью.
Примечание. Возможны другие виды взаимодействия металлов с раствором соли. Все зависит от конкретной системы, например:
Если активности металла близки, то возможно одновременное вытеснение металла из состава соли и взаимодействие окисляющегося металла с продуктами гидролиза соли.
Источник: studopedia.su
Составление электронных и молекулярных уравнений реакций. Уравнение Нернста (Nernst)
Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
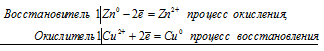
Zn0 + Cu 2+ = Zn 2+ + Cu 0
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
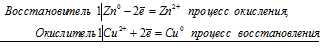
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb 2+ , и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
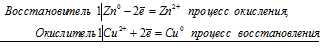
Zn 0 + Pb 2+ = Zn 2+ + Pb 0
Задание 243.
При какой концентрации ионов Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
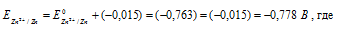
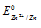
— стандартный электродный потенциал цинка.
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
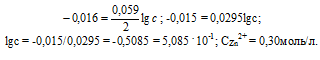
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами:
а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Cd 0 + 2Ag + = Cd 2+ + 2Ag 0
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni 2+ , и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.

Cd 0 + Ni 2+ = Cd 2+ + Ni 0
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (моль/л). Ответ. 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn 2+ в растворе:
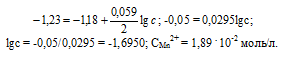
Ответ. 1,89 . 10 -2 моль/л.
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Олово и свинец| Задания 365 — 367
Источник: buzani.ru