Относится к элементам p-семейства. Неметалл. Обозначение – Si. Порядковый номер – 14. Относительная атомная масса – 28,086 а.е.м.
Электронное строение атома кремния
Атом кремния состоит из положительно заряженного ядра (+14), состоящего из 14 протонов и 14 нейтронов, вокруг которого по 3-м орбитам движутся 14 электронов.
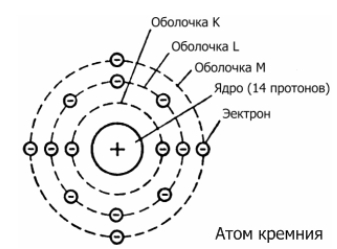
Рис.1. Схематическое строение атома кремния.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне кремния находится четыре электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
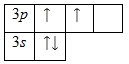
Наличие двух неспаренных электронов свидетельствует о том, что кремний способен проявлять степень окисления +2. Также возможно возбужденное состояние для атома кремния за счет наличия вакантной 3d-орбитали. Электроны 3s -подуровня распариваются и занимают свободные d-орбитали:
Соединения кремния. 9 класс.
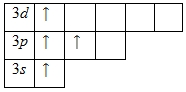
Поэтому у кремния есть ещё одна степень окисления, равная +4.
Примеры решения задач
| Задание | Электронная оболочка атома содержит 34 электрона. Какой это элемент и чему равен заряд ядра атома? |
| Решение | Общее число электронов в атоме химического элемента соответствует его порядковому номеру. Если электронная оболочка атома содержит 34 электрона, значит порядковый номер также равен 34. Это селен. Заряд ядра равен +34. |
| Ответ | Порядковый номер 34, заряд ядра +34. |
| Задание | Относительная атомная масса некоторого элемента равна 127. В электронной оболочке атома содержится 53 электрона. Какой это элемент? Сколько ядерных частиц содержит атом? |
| Решение | Количество электронов в атоме химического элемента равно количеству протонов, а также заряду ядра и порядковому номеру. Элемент, электронная оболочка которого содержит 53 электрона – это йод. Количество нейтронов представляет собой разницу между массовым и зарядовым числами: |
Источник: ru.solverbook.com
Строение атома кремния (количество электронов, протонов и нейтронов)
Кремний – 14 элемент периодической таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
 Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента.
Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента.
Кремний и его соединения: химические свойства #кремний #химшкола #неметаллы #егэхимия
Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт вакантной 3d-орбитали, проявляя степень окисления +4. 
Схема строения атома кремния – 1s 2 2s 2 2p 6 3s 2 3p 2 или +14 Si)2)8)4.
Степень окисления кремния
Атомы кремния в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4. Степень окисления – это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Электронное строение атома кремния
Атом кремния состоит из положительно заряженного ядра (+14), состоящего из 14 протонов и 14 нейтронов, вокруг которого по 3-м орбитам движутся 14 электронов. 
Распределение электронов по орбиталям выглядит следующим образом: +14Si)2)8)4; 1s 2 2s 2 2p 6 3s 2 3p 2 . На внешнем энергетическом уровне кремния находится четыре электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:  Наличие двух неспаренных электронов свидетельствует о том, что кремний способен проявлять степень окисления +2. Также возможно возбужденное состояние для атома кремния за счет наличия вакантной 3d-орбитали. Электроны 3s -подуровня распариваются и занимают свободные d-орбитали:
Наличие двух неспаренных электронов свидетельствует о том, что кремний способен проявлять степень окисления +2. Также возможно возбужденное состояние для атома кремния за счет наличия вакантной 3d-орбитали. Электроны 3s -подуровня распариваются и занимают свободные d-орбитали:

Поэтому у кремния есть ещё одна степень окисления, равная +4.
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона. Энергия ионизации Si: Eo = 787 кДж/моль — Что такое ион читайте .
Источник: tablitsa-mendeleeva.ru
Строение атома кремния

Кремний (Si) – второй по распространённости в земной коре неметалл после кислорода. В природе находится в составе соединений, в чистом виде встречается редко. Строение атома кремния определяет свойства элемента.
Строение
Кремний – 14 элемент периодической таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента. Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт вакантной 3d-орбитали, проявляя степень окисления +4.
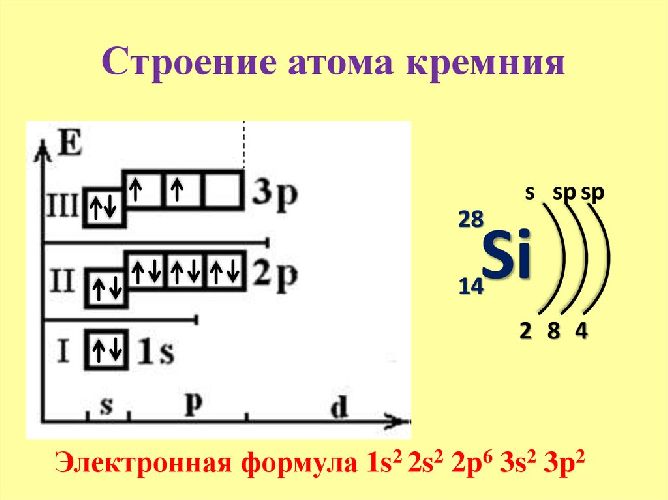
Схема строения атома кремния – 1s 2 2s 2 2p 6 3s 2 3p 2 или +14 Si)2)8)4.
Физические свойства
Кремний – твёрдый тёмно-серый элемент с металлическим блеском. Является полупроводником. Имеет одну модификацию, схожую по структуре с аллотропной модификацией углерода – алмазом. Однако связи между атомами кремния не такие прочные, как между атомами углерода.

Кремний встречается в природе в составе песка, глины, кварца, силикатов. Диоксид кремния (SiO2) – песок. Получают кремний путём прокаливания песка с углеродом (углём) или металлами:
Кремний используют для производства радиоэлементов, фотоэлементов, при производстве жароупорных материалов.
Химические свойства
Благодаря электронному строению кремний способен реагировать с другими элементами, принимая или отдавая электроны. В реакциях с металлами выступает в роли восстановителя, с неметаллами – окислителя. При оптимальных условиях кремний реагирует только с фтором:
Si + 2F2 → SiF4.
При нагревании реагирует:
- с кислородом (600°C) – Si + O2 → SiO2;
- с хлором (400°C) – Si + 2Cl2 → SiCl4;
- с углеродом (2000°C) – Si + C → SiC;
- с азотом (1000°C) – 3Si + 2N2 → Si3N4.
Является окислителем в реакциях с металлами:
Si + 2Mg → Mg2Si.
Может реагировать с концентрированными щелочами с выделением водорода:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Кремний не реагирует непосредственно с водородом и кислотами, кроме плавиковой кислоты HF: Si + 6HF → H2[SiF6] + 2H2 или Si + 4HF → SiF4 + 2H2. Соединение с водородом – силан (SiH4) – получают разложением соли кислотой – Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Что мы узнали?
Кремний – неметалл четвёртой группы периодической системы. На внешнем энергетическом уровне атома располагается четыре электрона. Имеет степень окисления +2. В природе находится в соединениях в виде глины, песка, кварца и других веществ. Существует только одна модификация кремния, схожая с алмазом. Получают кремний путём нагревания песка с углём или металлами.
Реагирует элемент с неметаллами, металлами и щелочами. С водородом и кислотами (исключение – HF) не реагирует.
Источник: obrazovaka.ru