Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
9 класс. Химия. Железо и его соединения
Источник: k-tree.ru
Строение атома железа
Относится к элементам d — семейства. Металл. Обозначение – Fe. Порядковый номер – 26. Относительная атомная масса – 55,849 а.е.м.
Электронное строение атома железа
Атом железа состоит из положительно заряженного ядра (+26), внутри которого есть 26 протонов и 30 нейтронов, а вокруг, по четырем орбитам движутся 26 электронов.
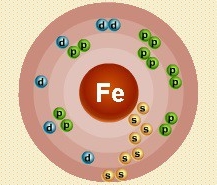
Рис.1. Схематическое строение атома железа.
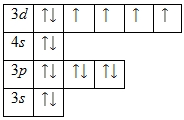
Распределение электронов по орбиталям выглядит следующим образом:
Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Электронная формула элемента имеет окончание …3p 3 .Напишите полную электронную формулу этого элемента и определите его порядковый номер в Периодической системе Д.И. Менделеева. |
| Ответ | Полная электронная формула будет выглядеть следующим образом: |
Порядковый номер элемента можно найти, сложив все электроны атома, вне зависимости от того, какие орбитали они занимают. Значит это 15-й элемент – фосфор.
| Задание | Определите число неспаренных электронов в атомах следующих элементов: а) магния; б) марганца; в) брома. |
| Ответ | а) Электронная конфигурация атома магния: |
1s 2 2s 2 2p 6 3s 2 .
Неспаренных электронов нет:

б) Электронная конфигурация атома марганца:
В атоме марганца 5 неспаренных электронов:
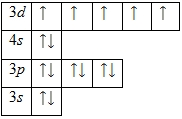
93. Электронная оболочка железа
в) Электронная конфигурация атома брома:
В атоме брома 1 неспаренный электрон:
Источник: ru.solverbook.com
1.Железо
1.1. Строение атома, степени окисления, примеры соединений
Железо — это d- элемент VIII группы; порядковый номер – 26; атомная массаAr(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.

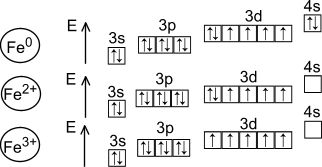
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2e-→Fe +2 , окисляется восстановитель
Fe 0 -3e-→Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3
Fe2O3 + 3CO = 2Fe + 3CO2
Fe2O3 + 3H2 = 2Fe + 3H2O
1.2. Нахождение в природе
— магнетит (магнитный железняк) FезО4 (содержит до 72% железа), основные месторождения находятся на Урале.
— гематит (красный железняк) Fe2О3 (содержит до 65% железа), основное месторождение — Криворожское.
— лимонит (бурый железняк) Fe2О3 • nH2O (содержит до 60% Ре), крупные месторождения в Крыму и на Урале.
— пирит (железный колчедан) FeS2 (содержит около 46% железа), — сидерит (шпатовый железняк) FeСО3 (содержит до 35% Железа)
1.3. Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа)
в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика
в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
выше 1394 °C устойчиво δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe как отдельную фазу, и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.
От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой.
От 1400 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлом. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Источник: studfile.net