Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
— входят в состав агрегата;
— способны достраивать кристаллическую решетку агрегата;
— образуют малорастворимое соединение с ионами агрегата;
— изоморфны с ионами агрегата».
Румянцева М.Н. — Химические и электрохимические методы формирования наночастиц — Лекция 5
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Пример 4.2. Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата серебра
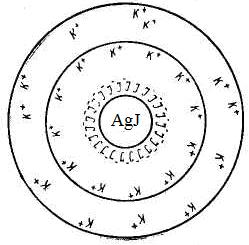
Рис. 4.11. Схематическое строение мицеллы золя иодида серебра
Формула мицеллы запишется:

где m – количество молекул или атомов, образующих агрегат; n – число потенциалопределяющих ионов, адсорбированных на поверхности агрегата; (n – x) – число противоионов в плотной части двойного электрического слоя (адсорбционный слой); x – число противоионов в диффузной части двойного электрического слоя; – заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра при небольшом избытке иодида калия
образуется мицелла следующего состава:
Заряд коллоидной частицы в этом случае будет отрицательным.
Формулы мицелл золей носят только качественный характер, они позволяют судить о структуре поверхностных слоев, но не пригодны для количественной характеристики состава мицелл. Существование мицелл в дисперсных системах приводит к тому, что состав дисперсионной среды вдали и вблизи частиц различается. Если, например, диффузный слой содержит ионы H + , то при фильтровании суспензий эти ионы уходят вместе с частицами. В результате возникает повышенная концентрация ионов H + в осадке по сравнению с фильтратом. Это явление получило название суспензионного эффекта.
Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)
Образование ДЭС в присутствии электролита-стабилизатора обеспечивает электростатический фактор устойчивости дисперсной системе, который усиливается с ростом потенциала поверхности и толщины ДЭС. Он очень чувствителен к действию электролитов и характерен для систем с полярными, особенно водными средами, создающими условия для диссоциации. Наряду с электростатическим, в дисперсных схемах возможно проявление и других факторов стабилизации.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Каково строение мицеллы золя иодида серебра, полученного добавлением к 30 мл раствора иодида калия (С(КI) = 0,006 моль/л) 40 мл
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
Строение мицеллы.
Рассмотрим строение мицеллы на примере образования золя йодистого серебра:
Нерастворимые молекулы йодистого серебра образовывают ядро коллоидной частицы. Вещество ядра, которое имеет аморфную или кристаллическую структуру, составляет почти всю массу мицеллы и образована из нейтральных молекул или атомов:
m[AgJ] — ядро коллоидной частицы
Образованное ядро коллоидного степени дисперсности, в соответствии с правилом Пескова-Фаянса, адсорбирует на своей поверхности ионы, которые есть в составе ядра, т.е. в рассмотренном случая Ag + или J — . Из двух видов ионов адсорбируются те, которые находятся в избытке в растворе. Эти ионы достраивают кристаллическую решетку ядра, внедряются в его структуру и обусловливают соответствующий заряд. Они имеют название потенциалопределяющие ионы.
Например: КJ — в избытке, тогда m[AgJ]*nJ — .
В растворе есть также ионы противоположного знака потенциалопределяющим. Они называются противоионами. Часть их тесно связывается электрическими и адсорбционными силами и входят в адсорбционный слой. Ядро вместе с адсорбционным слоем носит название гранула (или частица)
Противоионы, которые остались, образовывают диффузный слой. Ядро вместе с адсорбционным и диффузным слоямими называются мицеллою:
Она электронейтральная частица. Поэтому при пропускании постоянного тока через коллоидный раствор двигаются не мицеллы, а только гранулы. Числа m, n, x — в зависимости от условий приготовления золей изменяются в широких границах.
Одной из важных свойств золей есть то, что частицы данного золя имеют электрические заряды одного знака. Благодаря этому они не объединяются в большие дольки и не осаждаются. Свойство системы противодействовать увеличению частиц называется агрегативной устойчивостью. Способность дисперсных частиц содержаться в зависшем состоянии называется кинетической устойчивостью. Те электролиты, ионы которых потенциалопределяющие называют стабилизаторами, а их ионы стабилизирующими.
Стойкость коллоидных систем объясняется взаимодействием межмолекулярных сил притягивания и сил электростатического отталкивания. Поэтому важным фактором устойчивости коллоидов есть наличие электрического заряда гранулы и сольватных (гидратных) оболочек из ионов диффузного слоя. Последние препятствуют приближению ионов диффузного слоя с гранулой. И чем толще диффузный слой, тем более устойчивые коллоиды, и меньше вероятность слипания коллоидных частиц в большие агрегаты — коагуляция, и осаждение коллоидного вещества в осадок — седиментация.
Десольватацию, а т.е. и коагуляцию можно вызвать: повышением температуры, механическим действием, высокочастотным колебанием и др. Прибавление электролита также вызовет коагуляцию. В последнем случае ионы электролита десольватируют ионы диффузного слоя и помогают перейти им в адсорбционный слой. При прибавлении маленького количества электролита слипание частичек происходит незаметно для невооруженного глаза. Начальная стадия коагуляции называется скрытой коагуляцией.
Увеличение концентрации электролита ведет к дальнейшему развитию коагуляции, повышению ее скорости, появлению более крупных частиц. При этом золь становится мутным. Эта ступень называется явной коагуляцией.
И наименьшее количество электролита, который вызовет начало явной (заметной) коагуляции называется порогом коагуляции золя.
У золей порог коагуляции обычно маленький и определяется в единицах миллимолей электролита на литр золя.
Величина обратная порогу коагуляции называется коагулирующей способностью электролитов (ионов). Коагуляцию вызовет главным образом, один из ионов добавленного электролита — ион противоположный по знаку потенциалопределяющим ионам.
Чем больше заряд коагулирующего иона, тем сильнее проявляется его коагулирующая способность и ниже порог коагуляции (правило Шульце-Гарди).
Например, для отрицательно заряженного золя As2S3 коагулирующие способности относятся:
Коагуляцию можно вызвать и если к одному золю прибавить другой с противоположным зарядом. Происходит взаимная коагуляция и выпадают в осадок оба золя.
Так, при очищении питьевой воды от зависших высокодисперсных частичек песка, глины и др. (отрицательно заряженные золи) прибавляют небольшое количество Al2(SO4)3, что при гидролизе дает положительный золь
Происходит взаимная коагуляция.
Стойкость коллоидного раствора можно повысить, если прибавить к нему небольшое количество раствора высокомолекулярного вещества. Это явление называется коллоидной защитой. Его суть сводится к образованию вокруг коллоидной частицы адсорбционной оболочки из высокомолекулярного вещества, которое препятствует слипанию частиц.
Диализом называется процесс очистки золей от присутствующих в них ионно-молекулярных примесей. Для этого используют полупроницаемые перегородки, сквозь которые проходят низкомолекулярные вещества. Приборы — диализаторы. Для ускорения процесса используют проточную воду и электрическое поле.
Ультрафильтрация — это метод отделения дисперсной фазы от дисперсионной среды фильтрацией коллоидных растворов сквозь полупроницаемые мембраны (под вакуумом, или давлением). Используют также и ультрацентрифуги.
Явления относительного перемещения фаз вдоль поверхности распределения фаз, которые приводят к возникновению электрического поля, называются электрокинетическими.
Электрофорез — это явление перемещения частиц дисперсной фазы в электрическом поле к электроду, знак которого противоположный заряду частичек.
Электроосмос — это явление переноса жидкости (дисперсионной среды) сквозь диафрагмы под влиянием электрического тока.
Оптические свойства коллоидных растворов:
Опалесценция — золь имеет окраску. Поскольку наиболее сильно рассеиваются короткие волны, то рассеянный свет от источника белого света должнен иметь голубой оттенок. Т.е. золи в проходящем свете имеют одну окраску, а в отраженном — другую (голубую). Например, водный золь HgCl – красно-желтый, а в отраженном свете — голубой.
Эффект Фарадея-Тиндаля — рассеивание света коллоидными частицами. При пропуске сквозь золь пучка светы появляется светлый конус, который видно в затемненном помещении. Таким образом можно распознать, коллоидным или истинным является раствор.
При определенных условиях, например, при изменении условий сохранения (например, температуры), или при повышении концентрации золи переходят в гели — вязкие массы. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое — полутвердое состояние. При этом теряется текучесть, а вязкая масса заполняет весь объем, который занимал коллоидный раствор.
Гель удерживает очень большое количество дисперсионной среды, что вследствие ячеистой структуры проявляет качества твердого тела.
Много гелей под действием механических сил (встряхивание, перемешивание) переходят в золи. Обычно после завершения механического действия золь с большей или с меньшей скоростью переходит в гель. Это явление называется тиксотропией: гель ↔ золь.
Со временем гели претерпевают изменение — их структура постепенно уплотняется, выделяя частицу поглощенной жидкости. Это явление называется синерезисом. При высыхании геля его объем почти не изменяется.
От гелей следует отличать золи (студни) — растворы высокомолекулярных веществ в низкомолекулярных жидкостях (системы гомогенные). Они могут образоваться при набухании твердых полимеров в определенных жидкостях.
Значение золей исключительно большое, поскольку они более распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений — все это сложные золи.
С золями связано производство искусственных волокон, выделка кож, крашение, изготовление клея, пленок, чернила. Много золей в почве и от них зависит плодородность последних. Используются они и в строительстве.
Источник: helpiks.su