Коагулирующая способность сульфата натрия по отношению к золю выше коагулирующей способности хлорида кальция. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов больше, чем у CaCl2. Значит, коагулирующими ионами являются анионы. Следовательно, частицы золя заряжены положительно.
Пример 3. Порог коагуляции золя серебра ионами алюминия равен 0,186 ммоль/л. Какой объем 28%-ного раствора сульфата алюминия (пл. 1,33 г/мл) требуется для коагуляции золя объемом 2 л?
Рассчитаем молярную концентрацию 28%-ного раствора сульфата алюминия, подставив известные по условию задачи величины и молярную массу сульфата алюминия:
Поскольку С(Al 3+ ) = 2C(Al2(SO4)3), концентрация иона коагулятора равна 2∙1,09 моль/л = 2,18 моль/л = 2180 ммоль/л.
Из уравнения для расчета порога коагуляции , где V0 – объем золя, V1 – минимальный объем электролита, вызвавший коагуляцию, выразим объем электролита:
Подставим в это выражение известные по условию задачи величины и вычислим:
Принцип суперпозиции. Модель на осциллографе
Ответ: для коагуляции требуется 0,17 мл раствора сульфата алюминия.
Контрольные задания
331. Золь гексацианоферрата (II) меди (II) получен в условиях избытка: а) хлорида меди; б) гексацианоферрата (II). Напишите формулы мицеллы обоих золей и назовите их составные части.
332. Напишите формулу мицеллы для золя йодида серебра, полученного добавлением к раствору йодида калия объемом 30 мл с концентрацией 0,006 моль/л раствор нитрата серебра объемом 40 мл с концентрацией 0,004 моль/л. Напишите части мицеллы.
333. Золь бромида свинца (II) получен при смешивании растворов ацетата свинца и бромида кальция. Коагулирующая способность нитрата магния по отношению к этому золю больше коагулирующей способности сульфата аммония. Напишите формулы мицеллы и назовите ее составные части.
334. Золь гидроксида магния был получен смешиванием равных объемов растворов хлорида магния с концентрацией 0,01 моль/л и гидроксида калия с концентрацией 0,015 моль/л. Напишите формулу мицеллы, назовите ее составные части и укажите, какой из электролитов: хлорид калия, сульфат натрия, нитрат алюминия – будет обладать наибольшей коагулирующей способностью к полученному золю.
335. Смешали равные объемы 1%-ных растворов хлорида кальция и серной кислоты (плотности принять равными 1 г/мл). Напишите формулу мицеллы образовавшегося золя и назовите ее составные части.
336. Для получения коллоидного раствора Fe4[Fe(CN)6]3 к раствору FeCl3 с концентрацией 0,008 моль/л и объемом 8 мл добавили К4[Fe(CN)6] с концентрацией 0.007 моль/л и объемом 6 мл. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Формулу мицеллы, назовите составные части. 3. К какому электроду будет перемещаться дисперсная фаза при электрофорезе?
4. Какой ион К2SO4 вызывает коагуляцию золя?
337. Коллоидный раствор Cr(OH)3 получен при прибавлении 3 мл 10%-ного водного раствора Cr2(SO4)3 (ρ=1,1г/см 3 ) и 5мл 5%-ного раствора (NH4)2S (ρ=1,05г/см 3 ). Какова формула мицеллы коллоидного раствора?
Кирпичики вселенной: Элементарные частицы из которых состоит мир. Лекция профессора Дэвида Тонга.
338. Какие золи: гидроксида железа, иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
339. Какой объем раствора AgNO3 с концентрацией 0,001 моль/л следует добавить к раствору NaCl объемом 10 мл с концентрацией 0,002 моль/л, чтобы получился золь, гранулы которого заряжены положительно? Напишите схему строения мицеллы золя.
340. Получены два золя иодида серебра из растворов AgNO3 и KI с молярными концентрациями по 0,05 моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16 мл к раствору KI объемом 20 мл, другой – раствора KI объемом 16 мл к раствору AgNO3 объемом 20 мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте.
Напишите формулы мицеллей.
341. Коагуляция золя гидроксида железа (III) объемом 4 л наступила при добавлении 10%-ного раствора сульфата магния объемом 0,91 мл (плотность 1,1г/мл). Вычислите порог коагуляции золя сульфат-ионами. Ответ: 0,21 ммоль/л.
342. Порог коагуляции золя гидроксида железа фосфат-ионами равен 0,37 ммоль/л. Какой объем 5%-ного раствора Na3PO4 (пл. 1,05 г/мл) требуется для коагуляции золя объемом 750 мл? Ответ: 0,87 мл.
343. Для получения коллоидного раствора Сu(OH)2 к раствору KOH с концентрацией 0,005 моль/л и объемом 5 мл добавили CuSO4 с концентрацией 0,025 моль/л и объемом 10 мл. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Формулу мицеллы, назовите составные части. 3. К какому электроду будет перемещаться дисперсная фаза при электрофорезе?
4. Какой ион NaCl вызывает коагуляцию золя?
344. При добавлении 50 мл золя оксида алюминия 0,4 мл раствора K2SO4 с концентрацией 0,02 моль/л наблюдается начало явной коагуляции. Рассчитайте порог коагуляции (ммоль на литр золя) и коагулирующую способность сульфата по отношению к золю оксида алюминия.
345. К 100 см 3 0,03%-ного раствора хлористого натрия (плотность 1005 кг/м 3 ) добавлено 250 см 3 0,001 н раствора азотнокислого серебра. Для изучения коагуляции к полученному золю хлористого серебра добавлены следующие электролиты KBr, Ba(NO3)2, K2CrO4, MgSO4, AlCl3.
Какой из добавленных электролитов имеет наименьший порог коагуляции, наименьшую коагулирующую способность? Ответ мотивируйте. Напишите формулу мицеллы.
346. Золь AgI получен при добавлении 8 мл водного раствора KI концентрацией 0,05 моль/л к 10мл водного раствора AgI концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя. Как заряжена частица? Каким методом можно определить этот заряд?
347. Порог коагуляции золя гидроксида алюминия дихромат-ионами равен 0,63 ммоль/л. Какой объем 10%-ного раствора дихромата калия (пл. 1,07 г/мл) требуется для коагуляции золя объемом 1,5л?
348. Золь сернокислого бария получен смешением равных объемов растворов азотнокислого бария и серной кислоты. Написать формулу мицеллы золя и ответить на вопрос, одинаковы ли исходные концентрации электролитов, если в электрическом поле гранула перемещается к аноду.
349. Коллоидный раствор получен в результате реакции обмена при смешивании равных объемов растворов FeCl3 с концентрацией 0,01 моль/л и NaOH с концентрацией 0,005 моль/л. Напишите формулу мицеллы коллоидного раствора и схему ее строения. В каком направлении (к катоду или аноду) будет перемещаться гранула? Определите, какой из электролитов K2SO4 или KCl будет иметь меньший порог коагуляции?
350. Какой минимальный объем раствора дихромата калия с концентрацией 0,01 моль/л требуется для коагуляции гидрозоля гидроксида железа (III) объемом 1 л, если порог коагуляции этого золя дихромат-ионом равен 0,06 моль/л?
351. Пороги коагуляции гидрозоля гидроксида железа (III) сульфатом натрия и хлоридом алюминия соответственно равны 0,32 и 20,50 ммоль/л. Определите знак заряда коллоидных частиц золя. Вычислите величины коагулирующей способности этих электролитов и сопоставьте их отношение с вычисленными по правилу Шульце-Гарди.
352. Какой минимальный объем раствора сульфида аммония с концентрацией 0,001 моль/л следует добавить к раствору хлорида марганца (II) объемом 15 мл с концентрацией 0,003 моль/л для того, чтобы получить золь с отрицательно заряженными частицами? Напишите схему строения мицеллы золя.
353. Золь иодида серебра был получен при смешивании растворов нитрата серебра и иодида аммония. Коагулирующая способность хлорида магния по отношению к этому золю больше коагулирующей способности сульфата натрия. Напишите формулу мицеллы этого золя и назовите ее составные части.
354. Порог коагуляции золя иодида серебра сульфат-ионами равен 2,12 ммоль/л. Какой объем раствора сульфата алюминия с концентрацией 0,4 моль/л требуется для коагуляции золя объемом 0,5 л? Напишите формулу золя иодида серебра.
355. Пороги коагуляции золя Fe(OH)3 для электролитов KI и K2Cr2O7 соответственно равны 10,0 и 0,195 ммоль на 1 л золя. Во сколько раз коагулирующая способность двухромового калия больше, чем у иодистого калия?
356. Для получения коллоидного раствора сульфата бария к раствору BaCl2 с С(BaCl2) = 0,005 моль/л и объемом 10 мл добавили 20 мл K2SO4 с С(K2SO4) = 0,002 моль/л. Укажите: 1. Метод и способ получения коллоидного раствора. 2. Потенциалобразуюшие ионы, противоионы. 3. Формулу мицеллы; назвать ее составные части. 4. Знак заряда золя.
5. К какому электроду будет перемещаться дисперсная фаза при электрофорезе. 6. Какой ион электролита KNO3 вызывает коагуляцию золя?
357. Коагуляция золя сульфида золя объемом 650 мл наступила при добавлении раствора сульфата хрома (III) объемом 1,18 мл с концентрацией 0,025 моль/л. Вычислите порог коагуляции золя сульфат-ионами. Напишите формулу мицеллы золя сульфида золота.
358. Порог коагуляции золя сульфида золота ионами кальция равен 0,69 ммоль/л. Какой объем раствора хлорида кальция с концентрацией 0,5 моль/л требуется для коагуляции золя объемом 100 мл? Напишите формулу мицеллы золя сульфида золота.
359. К 5 см 3 золя гидроксида железа (III) для начала явной коагуляции необходимо добавить один из следующих растворов: 4 см 3 3н раствора хлористого калия; 0,5 см 3 0,01н раствора сернокислого калия; 3,9 см 3 0,0005 н раствора железистосинеродистого калия. Вычислить порог коагуляции для этих электролитов. Во сколько раз коагулирующая способность К4[Fe(CN)6] выше, чем у K2SO4 и KCl?
360. Пороги коагуляции золя сульфида мышьяка для нитрата калия, хлорида магния и хлорида алюминия соответственно равны 50, 0,72 и 0,093 ммоль/л. Как соотносятся между собой коагулирующие способности электролитов? Катионы или анионы вызывают коагуляцию? Ответ обоснуйте.
Напишите формулу мицеллы золя сульфида мышьяка.
Источник: studopedia.su
Тема 10. Коллоидные растворы. Строение мицеллы. Коагуляция

Основные понятия: коллоидные растворы, виды устойчивости коллоидных растворов, их причину и факторы, вызывающие ее нарушении, мицелла, правило Панета-Фаянса правило Шульце-Гарди.
Мицелла состоит из электронейтрального агрегата, окруженного двойным электрическим слоем. Агрегат и потенциалопределяющие ионы образуют ядро. Агрегат вместе с адсорбционным слоем называют гранулой (частицей). Заряд гранулы равен сумме зарядов потенциалопределяющих ионов и прочно связанных противоионов. Если гранула заряжена положительно, при электрофорезе она движется к катоду; если гранула заряжена отрицательно – к аноду.
В общем виде строение мицеллы можно представить следующим образом:
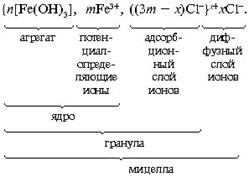 |
Пример 30. Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
Коллоидная мицелла золя иодида серебра образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag + или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag + . В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы.
Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I – , противоионы – ионы К + ) может быть изображена следующим образом:
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд: < m [AgI] · nAg + · (n-x)NO3 – > x + · x NO3 –
Пример 31. Коллоидный раствор гидроксида железа (III)получен по реакции:
При некотором избытке а) FeCl3, б) NaOH. Составьте схему строения мицеллы золя гидроксида железа (III) для случая а) и б). Определите знак заряда коллоидных частиц.
Решение. а) FeCl3→ Fe 3+ + 3Cl —
3] · nFe 3+ · 3(n-x)Cl — > 3 x + 3xCl —
Знак заряда гранулы положительный.
3] · nOH — · (n-x)Na + > x- xNa +
Знак заряда коллоидных частиц отрицательный.
Коагуляция – потеря коллоидными системами агрегативной устойчивости. Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
Наибольшее теоретическое и практическое значение имеет разрушение золя при добавлении электролита. Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции.
где V0 – объем золя, л; Vmin – минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С – концентрация электролита в растворе, моль/л. Величина, обратная, порогу коагуляции, называется коагулирующей способностью: КС = 1/Спор
Коагулирующее действие электролитов подчиняется правилу Шульце-Гарди, теоретически обоснованному Дерягиным и Ландау: коагуляцию вызывают ионы с зарядом, противоположным заряду гранулы, и коагулирующая способность тем выше, чем выше заряд коагулирующего иона.
Пример 32. Для коагуляции 100мл золя иодида серебра потребовалось 3мл 0,2М сульфата натрия и 4мл 0,3М хлорида натрия. Коагулирующая способность какого электролита – коагулятора (ЭК) больше? Каков знак заряда частица золя? Катионы или анионы вызывают коагуляцию золя?
Решение.
1. Вычислим порог коагуляции каждого электролита-коагулятора так:
2. Определим коагулирующую способность:
Коагулирующая способность Na2SO4>NaCl. Так как заряд катионов одинаков, а коагулирующая способность различна, значит, коагуляцию золя вызывают анионы: SO4 2- >Cl — . Следовательно, согласно правилу Шульце-Гарди золь иодида серебра заряжен положительно и частица при электрофорезе перемещается к катоду.
Пример 33. Коагуляция 10 мл гидрозоля железа (III) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 1,25ммоль/л. Вычислите порог коагуляции и коагулирующую способность электролита.
Решение. Для расчета порога коагуляции воспользуемся формулой:
Применительно к данной задаче ;
Где С(SO4 2- ) = C(Na2SO4 2- ) = 1,25ммоль/л = 1,25·10 -3 моль/л
Величину коагулирующей способности вычисляют по формуле:
Ответ: Спор=0,208ммоль/л, КС = 4,8л/моль
Пример 34. Для коагуляции золя хлорида серебра, полученного при недостатке нитрата серебра, использовались растворы хлоридов калия, железа (III) и магния. Какой из них будет иметь наиболее низкий порог коагуляции? почему?
Решение. Мицелла в данном случае несёт отрицательный заряд, поэтому коагуляция вызывается катионом. Чем выше заряд катиона — тем ниже порог коагуляции. Следовательно, самый низкий порог будет у хлорида железа(III).
Пример 35. Порог коагуляции отрицательно заряженного гидрозоля As2S3 под действием KCl равен 4,9*10 -2 моль/л. С помощью правил Шульца-Гарди и Дерягина-Ландау для этого золя рассчитайте пороги коагуляции, вызываемой следующими электролитами: K2SO4, MgCl2, MgSO4, AlCl3 и Al2(SO4)3.
Решение. Согласно правилу Шульца-Гарди, теоретически обоснованному Дерягиным и Ландау, порог коагуляции обратно пропорционален заряду противоиона в шестой степени. Для KCl (заряд K = +1) порог составляет 4,9*10 -2 моль/л K2SO4 – противоион тот же, порог тот же. Для MgCl2, MgSO4 – противоион Mg 2+ , порог равен 4,9*10 -2 /2 6 = 7,6*10 -4 . AlCl3 и Al2(SO4)3 – противоион Al 3+ , порог равен 4,9*10 -2 /3 6 = 6.7*10 -5 .
Пример 36. В электрическом поле гранула золя карбоната железа перемещается к аноду(+). Напишите формулу мицеллы золя, если он был получен смешиванием растворов нитрата железа и карбоната калия. Одинаковы ли исходные концентрации электролитов, если объемы растворов одинаковы?
Решение. 3] · mCO3 2- · (m-2x)K + > 2x- 2xK +
Концентрации разные (концентрация карбоната калия выше, чем соли железа).
Пример 37. Коагулирующая способность сульфата натрия по отношению к данному коллоидному раствору выше коагулирующей способности хлорида кальция. Как заряжены частицы золя?
Решение. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов (SO4 2- ) больше, чему CaCl2 (ионов Cl — ), значит, коагулирующими ионами являются анионы. Следовательно, частицы коллоидного раствора заряжены положительно.
Пример 38. Коллоидный раствор иодида серебра получен при некотором избытке KI по реакции:
Его коагулируют растворами сульфата натрия и ацетата кальция. У какого электролита коагулирующая способность выше?
Решение. Т.к. стабилизатором является KI (AgI→ Ag + + I — ), то мицелла имеет строение:
Коллоидная частица (гранула) заряжена отрицательно. Следовательно, коагулирующими ионами являются катионы. Т.к. заряд иона Са 2+ больше заряда иона Na + , то коагулирующая способность ацетата кальция выше, чем сульфата натрия.
Пример 39. Какие золи: гидроксида железа(III) (при избытке FeCl3), иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
Решение. Взаимная коагуляция возможна при смешивании золей с противоположными знаками заряда гранул. Гранулы золя гидроксида железа (III) заряжены положительно
3] · nFe 3+ · 3(n-x)Cl — > 3 x +
Гранулы золя иодида серебра при избытке AgNO3 (потенциалопределяющие ионы Ag + ) заряжены положительно: · nAg + · (n-x)NO3 — > x , а при избытке KI (потенциал-определяющие ионы I — ) заряжены отрицательно: · nI — · (n-x)K + > x — .
Следовательно, взаимная коагуляция возможна при сливании золей а) гидроксида железа(III) и иодида серебра при избытке KI, и б) иодида серебра (при избытке AgNO3) и иодида серебра (при избытке KI).
Типовые задачи.
36. Коагуляция 1,5 мл золя сульфида золота наступила при добавлении к нему 570 мл раствора хлорида натрия концентрацией 0,2 моль/л. Вычислите порог коагуляции золя ионами натрия и коагулирующую способность электролита.
37. Частицы золя при электрофорезе перемещаются к аноду. Коагулирующая способность какого из веществ: Na2SO4, CaCl2 или K3PO4 – будет наибольшей по отношению к данному золю? Дайте пояснения.
38. Получены два золя иодида серебра из раствора AgNO3 и KI с молярными концентрациями по 0,05моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16мл к раствору KI объемом 20мл, другой раствора KI объемом 16мл к раствору AgNO3 объемом 20мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте. Напишите формулы мицелл золя.
39. Золь кадмия сульфида получен смешиванием растворов Na2S и Cd(NO3)2. Пороги коагуляции электролитов к данному золю оказались равными (ммоль/л): Спор(Ca(NO3)2)=265, Cпор (NaCl) = 250, Cпор (MgCl2) = 290, Cпор (Na3PO4) = 0,4, Cпор (Na2SO4) = 15, Cпор (AlCl3) = 300. Какой из электролитов Na2S или Cd(NO3)2, взят в избытке для получения золя? Составьте схему строения мицеллы золя.
Источник: megaobuchalka.ru
Каково строение мицеллы золя иодида серебра, полученного добавлением к 30 мл раствора иодида калия (С(КI) = 0,006 моль/л) 40 мл


решение задания по химии
Похожие вопросы:

Другие предметы, 16.04.2019 23:50
Разновидность целей, которые организация формирует как безличная структура, т. е. цели, которые встроены в природу

Другие предметы, 16.04.2019 23:50
_стандартизация проводится специальными международными организациями или группой государств с целью облегчения взаимной

Другие предметы, 16.04.2019 23:50

Другие предметы, 17.04.2019 00:00
Кривая ……..демонстрирует различные комбинации двух благ, которые могут быть произведены в экономике при полном использовании

Другие предметы, 17.04.2019 00:00
Эффект мультипликатора отражает взаимосвязь между увеличением инвестирования и ростом уровня экономической

Другие предметы, 17.04.2019 00:00
Уровень валового выпуска, который обеспечивается в условиях неполной занятости, называется уровнем естественного

Другие предметы, 17.04.2019 00:00
Из перечисленного — основания прекращения договора простого товарищества: 1) достижение предусмотренной договором цели

Другие предметы, 17.04.2019 00:00
Тип проверки, включающий проверку правильности проставленных цен в документе, произведенных наценок, скидок, вычислений

Другие предметы, 17.04.2019 00:00
Неотвратимость и справедливость применения уголовного закона входят в _ функцию уголовного закона

Другие предметы, 17.04.2019 00:00
Постановление о возвращении уголовного дела о применении принудительных мер медицинского характера прокурору может быть обжаловано

Другие предметы, 17.04.2019 00:00
_ налоговая проверка – это проверка, которая проводится по месту нахождения налогового органа должностными лицами этого органа

Другие предметы, 17.04.2019 00:00
Договор, заключенный государственным заказчиком с исполнителем, предусматривающий обязательства сторон и их ответственность
У тебя есть свой ответ?
Каково строение мицеллы золя иодида серебра, полученного добавлением к 30 мл раствора иодида калия (.
Отправлено
Вопросы по другим предметам:

История, 02.10.2019 14:50
Увидеть вопрос и ответы

Русский язык, 02.10.2019 14:50
Увидеть вопрос и ответы

География, 02.10.2019 14:50
Увидеть вопрос и ответы

Химия, 02.10.2019 14:50
Увидеть вопрос и ответы

Геометрия, 02.10.2019 14:50
Увидеть вопрос и ответы

Английский язык, 02.10.2019 14:50
Увидеть вопрос и ответы

Математика, 02.10.2019 14:50
Увидеть вопрос и ответы

Русский язык, 02.10.2019 14:50
Увидеть вопрос и ответы

Обществознание, 02.10.2019 14:50
Увидеть вопрос и ответы

Литература, 02.10.2019 14:50
Увидеть вопрос и ответы
Популярные статьи сегодня

Питомцы-и-животные, 15.11.2019 14:27

Компьютеры-и-электроника, 15.11.2019 14:27

Кулинария-и-гостеприимство, 15.11.2019 14:27

Стиль-и-уход-за-собой, 15.11.2019 14:27

Молодежь, 15.11.2019 14:27

Компьютеры-и-электроника, 15.11.2019 14:27

Стиль-и-уход-за-собой, 15.11.2019 14:27

Образование-и-коммуникации, 15.11.2019 14:27

Дом-и-сад, 15.11.2019 14:27

Финансы-и-бизнес, 15.11.2019 14:27
Регистрация
Ваш вопрос
Слишком короткий вопрос
Вход на сайт
Неверный логин или пароль
Вы зарегистрированы.
Доступ на сайт будет открыт после проверки и публикации вопроса.
Восстановление пароля
Новый пароль отправлен на почту
Используя этот сайт, Вы даете согласие на использование cookies. Вы можете отказаться от использования cookies, настроив необходимые параметры в своем браузере.
Продолжить
- О нас
- Блог
- Карьера
- Условия пользования
- Авторское право
- Политика конфиденциальности
- Политика использования файлов cookie
- Предпочтения cookie-файлов
Источник: otvetovik.com