Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических Элементов
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
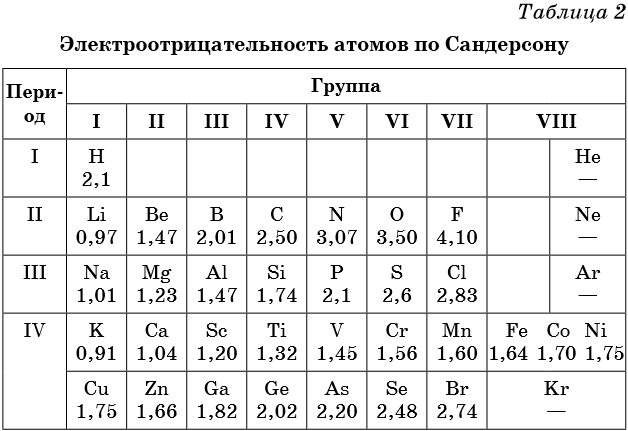
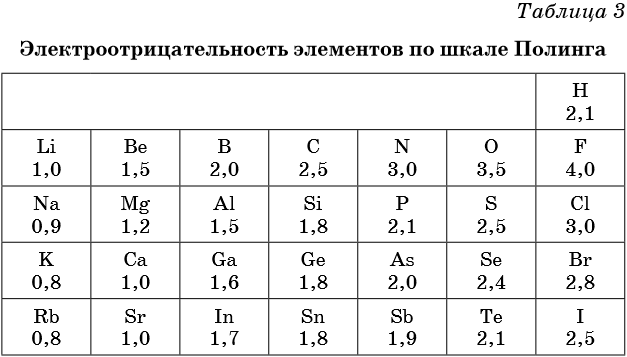
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
СТАРТ ИНТЕНСИВА «XO» | День 1 | Общая химия теория и тестовая часть | Екатерина Строганова
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия.
В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
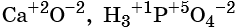
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K + — +1, Ba 2+ — +2, Br – — –1, S 2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO4 2– . Ион SO4 2– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
2. В каком соединении степень окисления фосфора равна –3?
3. В каком соединении степень окисления азота равна +4?
4. В каком соединении степень окисления азота равна –2?
5. В каком соединении степень окисления серы равна +2?
6. В каком соединении степень окисления серы равна +6?
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
11. Фосфор проявляет минимальную степень окисления в соединении
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Источник: himi4ka.ru
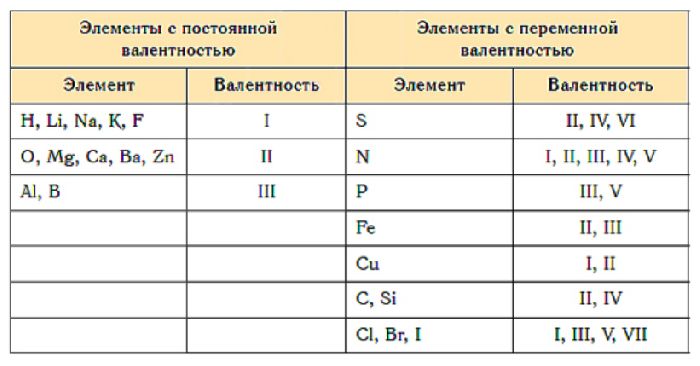
Таблица валентности химических элементов

Валентность простых веществ можно определить по таблице Менделеева или таблице валентности химических элементов. Что такое валентность и как определить валентность элемента – на эти вопросы отвечает наша статья.
Что такое валентность
Валентность – способность атома элемента образовывать связь с другими атомами за счёт электронов, находящихся на внешнем энергетическом уровне.
Любой элемент состоит из атома, в центре которого находится положительно заряженное ядро. Заряд ядра соответствует порядковому номеру элемента в периодической таблице. Он всегда положителен, так как количество протонов превышает количество нейтронов.
Вокруг ядра движутся на разном расстоянии от ядра отрицательно заряженные электроны. Их количество также соответствует порядковому номеру элемента. Самый последний уровень занимают валентные электроны. Из-за большого расстояния от ядра они теряют с ним связь и легко спариваются с внешними электронами другого атома. За счёт образовавшейся ковалентной связи формируется новое вещество, состоящее из нескольких атомов.
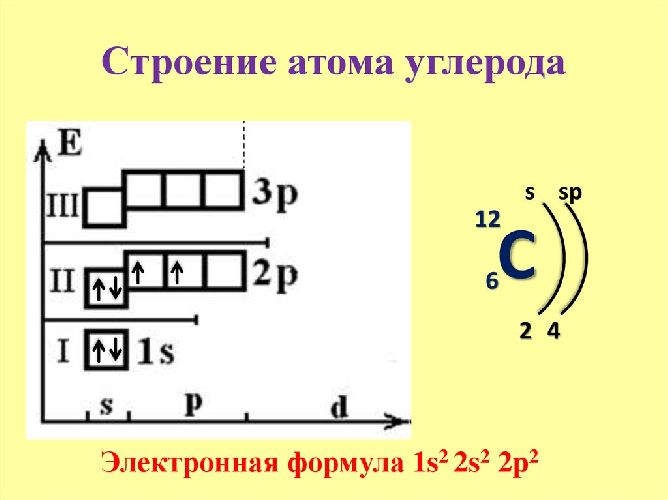
Количество электронов на внешнем уровне определяет валентность элемента и, соответственно, количество возможных химических связей.
Валентность элементов
Все элементы можно разделить на три группы:
- с постоянной валентностью;
- с переменной валентностью;
- с нулевой валентностью.
Постоянная валентность химических элементов не меняется:
- у щелочных металлов, фтора (I);
- у щелочноземельных металлов, кислорода (II);
- у алюминия (III).
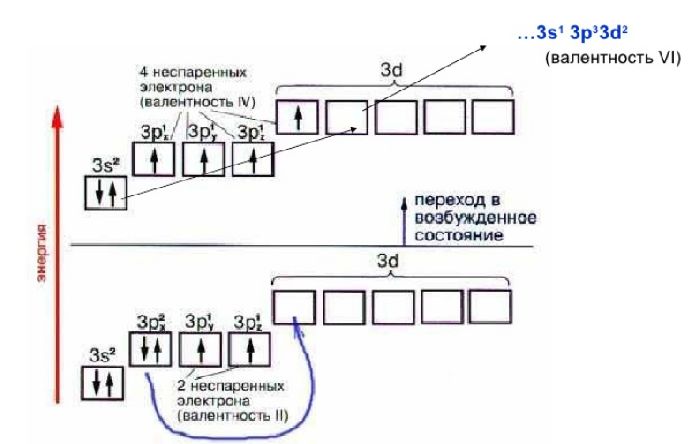
Переменная валентность характерна остальным элементам. Атомы этих элементов содержат d-подуровень, который может принимать электроны с s- и p-подуровней. В результате спаренные электроны распариваются и образуют дополнительные связи. Один элемент может проявлять I-VII валентности.
Так называемую нулевую валентность имеют инертные или благородные газы. На внешнем энергетическом уровне могут содержать до восьми электронов. Однако эти элементы химически неактивны и не образуют связи с другими атомами.
Валентность показывает, сколько атомов элементов находится в веществе. Индексы элементов высчитываются как кратное валентностей, поочерёдно поделённое на значение валентности элементов. Например, валентность Na – I, O – II, общее кратное – 2 (1 ∙ 2). Поделив 2 сначала на I, затем на II, получаем формулу соединения Na2O.
Как определить
Запоминать валентность каждого элемента необязательно. Достаточно посмотреть в таблицу Менделеева или использовать специальную таблицу валентности. В периодической таблице высшей валентности соответствует номер группы. Низшую валентность можно узнать, отняв от восьми номер группы.
Однако могут быть исключения. Например, кремний находится в IV группе, его высшая валентность – IV. Воспользовавшись формулой вычисления высшей валентности, можно прийти к выводу, что низшей валентности у кремния нет, она всегда равна IV. Однако это не так. Низшая валентность кремния – II.
Другой пример: высшая валентность азота – V. Но элемент эту валентность проявляет редко, гораздо чаще – II и III.
По формуле вещества можно определить переменную валентность одного из элементов. Для этого известную (постоянную) валентность одного элемента умножают на соответствующий ему индекс. Получившееся число делят на индекс определяемого элемента. Например, вычисление валентности фосфора в соединении P2O5: 2 ∙ 5 / 2 = 5 (V).
Что мы узнали?
Из урока 8 класса узнали, что такое валентность элементов. Выяснить значение валентности можно из периодической (соответствует номеру группы) или специальной таблицы валентности. Большинство элементов проявляет переменную валентность, которая обуславливается наличием в атомах таких элементов d-подуровня. Постоянную валентность имеют металл I-II групп, кислород, фтор, алюминий. Знать валентность необходимо для составления формул сложных веществ.
Источник: obrazovaka.ru
Таблица валентности химических элементов
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле – мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
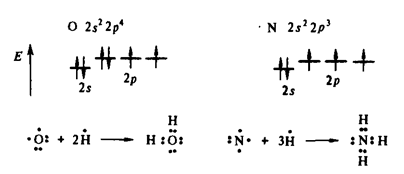
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трем, углерода – четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN2O, CO, SiO2, SO3валентность по кислороду азота равна единице, углерода – двум, кремния – четырем, серы – шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H2S), а по кислороду – шести (SO3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO2. В первом из которых валентность углерода равна II, а во втором – четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая – I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Русское / англ. название
Источник: ru.solverbook.com