
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда — вязкие, «маслообразные» жидкости; начиная с С10 — твердые вещества.
Простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3 COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4°С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Карбоновые кислоты | Органическая химия | Химия ЕГЭ, ЦТ
Карбоксильная группа сочетает в себе две функциональные группы – карбонил > C = O и гидроксил — OH , взаимно влияющие друг на друга:
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
Названия солей составляют из названий остатка RCOO – (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
I . Общие с другими кислотами
1. Диссоциация:
R — COOH ↔ RCOO — + H +
-Сила кислот уменьшается в ряду:
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с основными оксидами и основаниями:
R-COOH + NaOH → R-COONa + H2O
4. Взаимодействие с солями слабых кислот:
-Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + H С l → NaCl + R-COOH
-В водных растворах гидролизуются:
R — COONa + H 2 O ↔ R — COOH + NaOH
5. Образование сложных эфиров со спиртами:
II . Специфические свойства
1. Образование функциональных производных R — CO — X
Эта СУПЕРКИСЛОТА Растворит Все что угодно!
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2 . Образование амидов
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):

4. Особенности муравьиной кислоты H — COOH :
· Даёт реакцию «Серебряного зеркала» :
· Вступает в реакцию с гидроксидом меди( II ):
· Разлагается при нагревании:
HCOOH t,H2SO4 → CO↑ + H2O
(получение алканов):
R -COONa + NaOH t → Na2CO3 + R-H ( алкан )
6. Окисление в атмосфере кислорода:
Источник: www.yoursystemeducation.com
Карбоновые кислоты

Карбоновыми кислотами называют соединения, в которых карбонильный атом углерода связан с гидроксильной группой.
В зависимости от природы R карбоновые кислоты подразделяются на
предельные (насыщенные, R — алкил), непредельные (ненасыщенные, R — алкенил), ароматические (R — арил), циклические (R — циклоалкил) и др.

Предельные и непредельные кислоты часто называют жирными (по происхождению).
Спецификой номенклатуры карбоновых кислот является широкое применение в обиходе тривиальных названий наряду с названиями, основанными на систематической и рациональной номенклатурах. Положение заместителей при использовании тривиальных названий указывают буквами греческого алфавита.
Многообразие карбоновых кислот также связано с наличием
иных функциональных групп, таких, как галогены, гидрокси-, алкокси-, амино-, нитро-, карбонильные, две и более карбоксильные
и др.



Следовательно, можно прогнозировать для карбоновых кислот следующие типы химических реакций:
Кислотно-основные свойства

Карбоновые кислоты, имеющие Ка ~ 10 -5 , как кислоты слабее таких минеральных кислот, как НСl, HBr, HF, H2SO4, HNO3, Н3РО4, но намного сильнее спиртов, фенолов, угольной кислоты (табл. 20-3).


Карбоксилат-ион в отличие от алкоголят-иона стабилизирован сопряженней, что доказано рентгеноструктурным анализом (длины обеих связей С -О одинаковы).

Заместители в фрагменте R , стабилизирующие карбоксилатион, то есть облегчающие его образование, сильно увеличивают кислотность алифатических кислот (рКа по абсолютной величине уменьшается). Такую роль играют электроноакцепторные заместители.
Влияние заместителей в ароматических карбоновых кислотах менее заметно, чем в алифатических (табл. 20-3), но ожидаемое; электроноакцепторные заместители и сопряжение усиливают кислотность (n-нитробензойная кислота сильнее бензойной и м-нитробензойной кислот).
Как известно, кислотно-основные взаимодействия идут с образованием более слабых кислот и оснований, чем исходные, поэтому карбоновые кислоты реагируют с оксидами, гидроксидами щелочных, щелочноземельных металлов, карбонатами, фенолятами, алкоголятами, аминами и др. с образованием солей — карбоксилатов— и более слабых кислот — воды, угольной кислоты, фенолов,
спиртов, аммиака и др.

Образование карбоксилат-аниона сопровождается усиление нуклеофильности карбоновых кислот и облегчает процесс декарбоксилирования.
Карбоновые кислоты, реагируя с сильными кислотами, ведут себя как слабые основания, при этом возможно протонирование как карбонильного, так и гидроксильного атома кислорода.

Нуклеофильная атака карбонильного атома углерода карбоновой кислоты, как и в случае спирта, конкурирует с атакой нуклеофилом как основанием гидроксильного атома водорода. Вследствие этого известно очень ограниченное число нуклеофильных реагентов, способных присоединяться по карбонильной группе.
К их числу отаосятся вода, спирты, галогенангидриды минеральных кислот, например, PCl5, PCl3, SOCl2 и др., являющиеся слабыми нуклеофилами. Карбоновые кислоты со спиртами образуют сложные эфиры. Реакция этерификации (изучалась методом меченых атомов) катализируется более сильными кислотами, обычно это H2SO4, хлороводород и др. Сильная кислота, протонируя карбонильный атом кислорода, увеличивает электрофильность карбонильного углерода и облегчает присоединение слабого нуклеофила, в данном случае спирта. Потеря воды продуктом присоединения А приводит к сложному эфиру (этилацетат).
Особенностью реакции этерификации является обратимость, причем константа равновесия достаточно мала. Сместить равновесие в сторону образования сложного эфира и тем самым увеличить его выход, согласно принципу Ле Шателье, можно, используя избыток одного из реагентов (обычно спирта) и удаляя из зоны реакции один из продуктов, например, воду (азеотропной отгонкой с бензолом) или сложный эфир (отгонкой).

Карбоновые кислоты с PCl5, PCl3, SOCl2 образуют с хорошим выходом соответствующие галогенангидриды. Механизм взаимодействия карбоновой кислоты, например, с SOCl2 можно представить следующим образом:

Этот механизм, в рамках которого нуклеофильная атака на
карбонильный атом углерода происходит внутри- или межмолекулярно на заключительной стадии процесса (см. реакции ниже), подтверждается тем, что соли карбоновых кислот образуют галогенангидриды еще легче.

Восстановление карбоновых кислот обычными методами —
каталитическим гидрированием, натрием в спирте — идет с большим трудом, но действием LiAlH4 удается относительно легко осуществить восстановление до спирта. Реакция, видимо, идет следующим образом.

В первую очередь образуется комплексная соль алюминия, которая далее внутри- или межмолекулярным гидрированием, аналогично образованию галогенангидридов при взаимодействии карбоновых кислот с SOCl2, восстанавливается до альдегида. Альдегид далее легко превращается в спирт, который и является конечным продуктом реакции.
Поделиться ссылкой:
- Нажмите, чтобы поделиться записями на Tumblr (Открывается в новом окне)
- Нажмите, чтобы открыть на Facebook (Открывается в новом окне)
- Нажмите, чтобы поделиться на LinkedIn (Открывается в новом окне)
- Нажмите, чтобы поделиться в Telegram (Открывается в новом окне)
- Нажмите, чтобы поделиться на Twitter (Открывается в новом окне)
- Нажмите, чтобы поделиться в Skype (Открывается в новом окне)
- Нажмите, чтобы поделиться в WhatsApp (Открывается в новом окне)
- Нажмите для печати (Открывается в новом окне)
Источник: himfaq.ru
1. Кислотные свойства – замещение атома н в карбоксильной группе на металл или ион аммония.

6.Образование галоген-ангидридов – с помощью хлоридов фосфора (III) и (V).

7. Образование амидов:
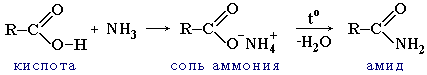
8. Получение ангидридов.
С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид.
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе ( -углеродный атом)
9.Галогенирование кислот – реакция идёт в присутствии красного фосфора или на свету.
Особенности муравьиной кислоты.
1. Разложение при нагревании.
2. Реакция серебряного зеркала и с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов.
3. Окисление хлором и бромом, а также азотной кислотой.
Особенности бензойной кислоты.
1. Разложение при нагревании – декарбоксилирование.

При нагревании бензойной кислоты она разлагается на бензол и углекислый газ:


 Карбоксильная группа является электроноакцепторной, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
Карбоксильная группа является электроноакцепторной, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
Особенности щавелевой кислоты.
1. Разложение при нагревании

2. Окисление перманганатом калия.
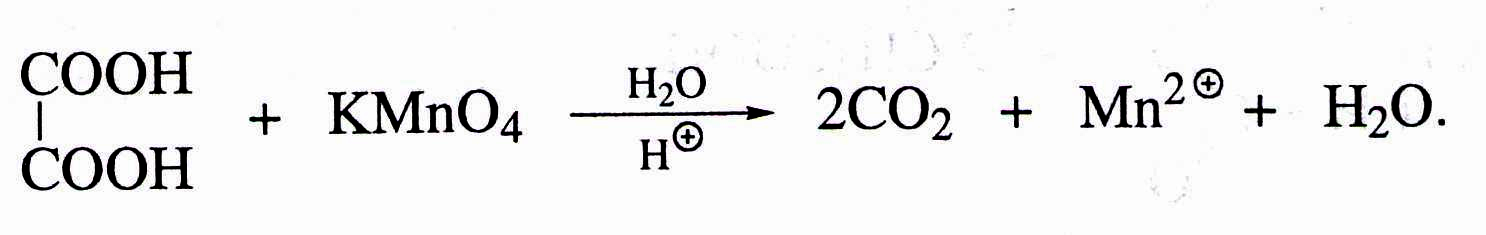
Особенности непредельных кислот (акриловой и олеиновой).
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
Также к непредельным кислотам можно присоединять галогены и водород:
При мягком окислении акриловой кислоты образуется 2 гидроксогруппы:
Свойства солей карбоновых кислот.
1. Обменные реакции с более сильными кислотами и со щелочами.
CH3-COONa + HCl CH3-COOH + NaCl
2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария)- образуются кетоны.
3. Сплавление солей щелочных металлов со щелочью (реакция Дюма)- получаются алканы.
4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе).
Свойства галогенангидридов
1. Гидролиз – получается кислота.
C
 H3-COCl+ -(AlCl3)HCl+
H3-COCl+ -(AlCl3)HCl+
3. Получение амидов и сложных эфиров
Источник: studfile.net