Японские и китайские химики получили катализатор на основе «замороженной», устойчивой к окислению, меди, обладающий свойствами аналогичных катализаторов на основе благородных металлов, например, золота или серебра. Новый катализатор получился дешевле и эффективнее. Его можно использовать для получения спиртов и эфиров из угля и синтез-газа, в частности, для селективного гидрирования продуктов реакции последних. Статья с результатами исследования опубликована в журнале Science Advances.
Экологические и энергетические требования заставляют химическую промышленность как можно полнее перерабатывать уголь. Один из путей переработки — получение спиртов из угля и синтез-газа с использованием катализаторов, которые должны быть дешевыми, обеспечивать высокий выход целевого продукта, селективность реакции. Промежуточным продуктом синтеза является сложный эфир (диметилоксалат), который при каталитическом гидрировании может превращаться в три продукта: в другой сложный эфир (метилгликолят) или при дальнейшем его гидрировании — в спирты (этиленгликоль и этанол). Спирты получать относительно легко с помощью катализаторов на основе меди, а метилгликолята в таких реакциях получается относительно мало.
Цзянь Сунь и Цзяфэн Юй из Китайской академии наук получили катализатор на основе «замороженной» меди. Он сочетает в себе свойства катализатора на основе благородных металлов (устойчивость к окислению и стабильность при высоких температурах) и меди (направление тандемной реакции в сторону образования метилгликолята). Ученые нанесли наночастицы меди на носитель из диоксида кремния методом плазменного напыления. Медь в катализаторе, полученном таким способом, не окисляется даже при высоких температурах в присутствии окисляющих агентов, а сам он приобретает свойства, схожие с катализаторами из серебра или золота за счет изменения электронного строения меди при воздействии высокоэнергетической плазмой. Методом рентгеновской фотоэлектронной спектроскопии авторы изучили электронное строение получаемой меди.
При бомбардировке высокоэнергетической плазмой происходит переход Костера-Кронига (особый случай Оже-эффекта), в котором образующаяся вакансия в электронной оболочке меди заполняется электроном внешнего подуровня той же оболочки. Это приводит к увеличению электронной плотности на внутренних оболочках во время бомбардировки.
Также на повышение электронной плотности может влиять провал электрона — произвольный переход с внешнего на внутренние оболочки. Медь — один из элементов, для которого провал электрона энергетически выгоден в связи с ее электронным строением. Суммарно два этих эффекта мешают электрону покинуть атом меди и обеспечивают более высокую устойчивость меди к окислению, как бы «замораживая» медь в металлическом состоянии, что делает ее свойства схожими со свойствами благородных металлов. Ученые подтвердили это с помощью ультрафиолетовой спектроскопии: для наночастиц меди, полученных плазменным напылением, наблюдается явление плазмонного резонанса, которое обычно свойственно электронам благородных металлов, в особенности серебру и золоту.
Как разделить золото, палладий и платину в присутствии меди. Первый опыт
Процесс гидрирования диметилоксалата — это терморегулируемая реакция, так как гидрирующие способности медного катализатора очень чувствительны к изменению температуры. Реакция получения метилгликолята на катализаторе из «замороженной» меди за счет ее термической устойчивости и низкой гидрирующей способности обладает хорошей селективностью от 50 до 87 процентов при температурах 230-280 градусов Цельсия, в отличие от обычных медных катализаторов, для которых эта цифра резко уменьшается (менее 20 процентов) при температуре выше 175 градусов.
Исследования авторов показывают, что свойства полученных катализаторов отличаются от свойств катализаторов на основе обычной меди благодаря разнице в электронном строении и окислительно-восстановительных способностях. Свойства «замороженной» меди близки к свойствам благородных металлов, и, в случае гидрирования, могут даже превосходить их. Поэтому созданные Цзянь Сунь и Цзяфэн Юй катализаторы могут стать дешевой и эффективной заменой катализаторов из благородных металлов.
Ранее исследование свойств и поиск способов применения медных катализаторов проводили канадские и американские химики. В частности, они разработали метод синтеза катализатора с дендритной структурой на основе меди, который позволяет селективно восстанавливать углекислый газ до этилена.
Источник: nplus1.ru
Каталитическое дегидрирование спиртов
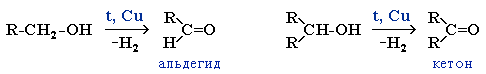
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 — 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al2O3, SnO2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.
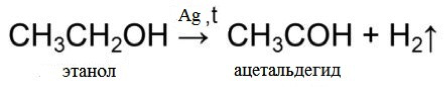
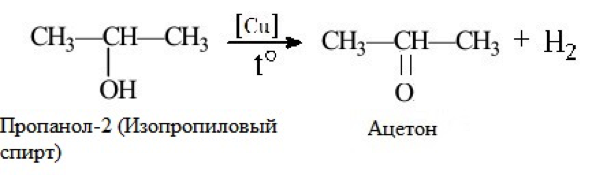
2. Дегидрирование пропанола может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 — 450 °С.
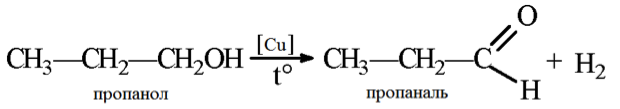
3. Дегидрирование бутанола так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).
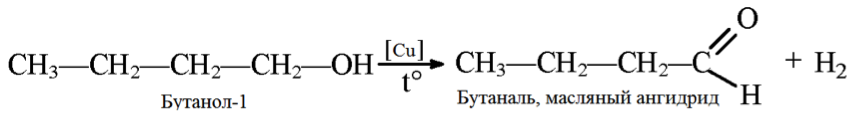
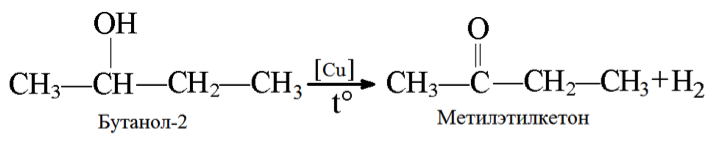
4. Дегидрирование метанола. Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 — 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.
Источник: www.czl.ru
Платиновый катализатор

Платиновый катализатор это порошкообразное и грануло-подобное вещество, в зависимости от сферы применения может быть в виде сеток или в сплаве с другими металлами платиновой группы наноситься на керамический или металлический блок.
Примером такого применения, катализаторы установленные на автомобилях для дожигания и обезвреживания выхлопных газов.

В производственных масштабах платиновый катализатор используется для окисления аммиака до оксида азота, а также в производстве серной кислоты.
Что такое платиновый катализатор
Лучший катализатор реакции окисления аммиака до окиси азота NО в одном из главных процессов производства азотной кислоты.
Катализатор здесь предстает в виде сетки из платиновой проволоки диаметром 0,05—0,09 мм. В материал сеток введена добавка родия (5—10%).
Используют и тройной сплав — 93% Pt, 3% Rh и 4% Pd. Добавка родия к платине повышает механическую прочность и увеличивает срок службы сетки, а палладий немного удешевляет катализатор и немного (на 1—2%) повышает его активность.
Срок службы платиновых сеток — год-полтора. После этого старые сетки отправляют на аффинажный завод на регенерацию и устанавливают новые. Производство азотной кислоты потребляет значительные количества платины.
Для чего применяют катализатор
Платиновый катализатор ускоряет многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SО2 в SО3 в сернокислотном производстве.
Их используют также при синтезе витаминов и некоторых фармацевтических препаратов. Известно, что в 1974 г. на нужды химической промышленности в США было израсходовано около 7,5 т платины.
Не менее важны платиновые катализаторы в нефтеперерабатывающей промышленности. С их помощью на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти.
Применение платинового катализатора
Здесь платину обычно используют в виде мелкодисперсного порошка, нанесенного на окись алюминия, керамику, глину, уголь.
В этой отрасли работают и другие катализаторы (алюминий, молибден), но у платиновых — неоспоримые преимущества: большая активность и долговечность, высокая эффективность. Нефтеперерабатывающая промышленность США закупила в 1974 г. около 4 т платины.
Еще одним крупным потребителем катализатора стала автомобильная промышленность, которая, как это ни странно, тоже использует именно каталитические свойства этого металла — для дожигания и обезвреживания выхлопных газов.
Четвертым и пятым по масштабам потребления покупателями платины в США были электротехника и стекольное производство.
Стабильность электрических, термоэлектрических и механических свойств платины плюс высочайшая коррозионная и термическая стойкость сделали этот металл незаменимым для современной электротехники, автоматики и телемеханики, радиотехники, точного приборостроения.
Из платины делают электроды топливных элементов. Такие элементы применены, например, на космических кораблях серии «Аполлон».
Из сплава платины с 5—10% родия делают фильеры для производства стеклянного волокна. В платиновых тиглях плавят оптическое стекло, когда особенно важно ничуть не нарушить рецептуру.
В химическом машиностроении платина и ее сплавы служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Очень незначительная часть платины идет в медицинскую промышленность. Из платины и ее сплавов изготавливают хирургические инструменты, которые, не окисляясь, стерилизуются в пламени спиртовой горелки; это преимущество особенно ценно при работе в полевых условиях.
Сплавы платины с палладием, серебром, медью, цинком, никелем служат также отличным материалом для зубных протезов.
Спрос науки и техники на платину непрерывно растет и далеко не всегда бывает удовлетворенным. Дальнейшее изучение свойств платины еще больше расширит области применения и возможности этого ценнейшего металла.
Платина интересные факты
«СЕРЕБРИШКО»? Современное название элемента № 78 происходит от испанского слова plata — серебро. Название «платина» можно перевести как «серебришко» или «сребрецо».
ЭТАЛОН КИЛОГРАММА. Из сплава платины с иридием в нашей стране наготовлен эталон килограмма, представляющий собой прямой цилиндр диаметром 39мм и высотой тоже 39 мм. Он хранится в Санкт-Петербурге (Ленинграде), во Всесоюзном научно-исследовательском институте метрологии им. Д. И. Менделеева. Раньше был эталоном и платино-иридиевый метр.
МИНЕРАЛЫ ПЛАТИНЫ. Сырая платина —это смесь различных минералов платины. Минерал поликсен содержит 80—88% Pt и 9-10% Fe; купроплатина — 65-73% Pt, 12-17% Fe и 7,7—14% Сu; в никелистую платину вместе с элементом № 78 входят железо, медь и никель.
Известны также природные сплавы платины только с палладием или только с иридием — прочих платиноидов следы. Есть еще и немногочисленные минералы — соединения платины с серой, мышьяком, сурьмой. К ним относятся сперрилит PtAs2 куперит PtS, брэггит (Pt, Pd, Ni)S.
САМЫЕ КРУПНЫЕ. Самые крупные самородки платины, демонстрируемые на выставке Алмазного фонда Россия, весят 5918,4 и 7860,5 г.
ПЛАТИНОВАЯ ЧЕРНЬ. Платиновая чернь — мелкодисперсный порошок (размеры крупинок 25—40 мкм) металлической платины, обладающий высокой каталитической активностью. Ее получают, действуя формальдегидом или другими восстановителями на раствор комплексной гексахлорплатиновой кислоты Н2[РtСl6].
ИЗ «СЛОВАРЯ ХИМИЧЕСКОГО», ИЗДАННОГО В 1812 ГОДУ. «Профессор Снядецкий в Вильне открыл в платине новое металлическое существо, которое названо им Вестий»…
«Фуркруа читал в Институте сочинение, в коем извещает, что платина содержит железо, титан, хром, медь и металлическое существо, доселе еще неизвестное»…
«Золото хорошо соединяется с платиною, но когда количество сей последней превышает 1 к 47 , то белеет золото, не умножая чувствительно тяжести своей и тягучести. Испанское правительство, опасавшееся сего состава, запретило выпуск платины, потому что не знало средств доказать подлога»-.
ОСОБЕННОСТИ ПЛАТИНОВОЙ ПОСУДЫ. Казалось бы, посуда из платины в лаборатории пригодна на все случаи жизни, но это не так. Как пи благороден этот тяжелый драгоценный металл, обращаясь с ним, следует помнить, что при высокой температуре платина становится чувствительной к многим веществам и воздействиям.
Нельзя, например, нагревать платиновые тигли в восстановительном и тем более коптящем пламени: раскаленная платина растворяет углерод и от этого становится ломкой. В платиновой посуде не плавят металлы: возможно образование относительно легкоплавких сплавов и потери драгоценной платины.
Нельзя также плавить в платиновой посуде перекиси металлов, едкие щелочи, сульфиды, сульфиты и тиосульфаты: сера для раскаленной платины представляет определенную опасность, так же, как фосфор, кремний, мышьяк, сурьма, элементарный бор.
А вот соединения бора, наоборот, полезны для платиновой посуды. Если надо как следует вычистить ее, то в ней плавят смесь равных количеств KBF4 и Н3ВО3. Обычно же для очистки платиновую посуду кипятят с концентрированной соляной или азотной кислотой.
Статья на тему платиновый катализатор
Похожие страницы:
Платина (Platinum) Aт. вес 195,09. В природе платина, подобно золоту, встречается в россыпях в виде крупинок, всегда содержащих примесь других.
Палладий это химический элемент простое вещество, благородный металл, входит в группу платиновых металлов. Химическая формула палладия Pd, при нагревании поглощает.
Агломерация платиновых металлов Азотнокислое серебро Амальгамация золотых руд Аффинаж золота и серебра Аффинаж платиновых металлов Аффинаж серебра Вторичное серебро и.
ПЛАТИНОВЫЕ МЕТАЛЛЫ Элемент Символ Атомный вес Порядковый номер Распределение электронов По слоям Рутений Ru 101,1 44 2 8 18 15.
Что такое платина самородная Это Pt — минерал класса самородных металлов. К группе платине самородной относятся минералы, представляющие собой природные.
Куперит это минерал, сложное вещество, входит в группу куперита, химическая формула PtS, иногда частично платина замещена палладием. Применяется как важнейшая.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com