Ко второй аналитической группе относятся катионы, дающие малорастворимые соединения при взаимодействии с соляной кислотой и ее солями. К ним относятся ионы Ag + , Hg2 2+ , Pb 2+ . Катионы этой группы с сульфат-, сульфит-, сульфид-, фосфат-, хромат-, карбонат- и галогенид-анионами образуют нерастворимые соли. При взаимодействии со щелочами также образуются нерастворимые вещества. Гидроксиды, образуемые данными катионами, обладают слабоосновными свойствами, поэтому при растворении в воде их соли легко гидролизуются и имеют кислую реакцию.
Групповым реактивом является соляная кислота HCl. При взаимодействии катионов второй группы с разбавленной соляной кислотой или ее солями образуются осадки хлоридов, малорастворимые в холодной воде и кислотах согласно реакциям:
Pb 2+ + 2Cl — = PbCl2 (тв).
Растворимость хлоридов в воде различна:
ПР = 1,6∙10 -5 ; ПР = 1,7∙10 -10 , ПР = 2,0∙10 -18 .
Растворимость хлорида свинца с повышением температуры заметно растет, растворимость же остальных хлоридов при этом практически не меняется, что используется для отделения Pb 2+ от остальных катионов первой группы.
Распознавание катионов и анионов в растворах
Осадок хлорида серебра легко растворяется в растворах аммиака с образованием растворимого в воде комплексного соединения — хлорида диаминсеребра:
Хлорид ртути взаимодействует с раствором аммиака, образуя хлорид меркуроаммония [Hg(NH2)]Cl и металлическую ртуть, вследствие чего осадок чернеет:
Ag + + Cl — = AgCl(тв) (белый осадок),
Ag + + Br — = AgBr(тв) (бледно-желтый осадок),
Ag + + I — = AgI(тв) (светло-желтый осадок).
С увеличением концентрации галогенид-ионов увеличивается растворимость галогенидов серебра в аммиаке из-за образования хорошо растворимых комплексных ионов [AgX2] — и [AgX4] 3- . Причем, растворимость в водном растворе аммиака уменьшается в ряду AgCl, AgBr, AgI, что соответствует уменьшению величины произведения растворимости.
Методика проведения реакции. В три пробирки помещают по 3-4 капли раствора, содержащего ионы Ag + , добавляют по 2-3 капли 2 н. раствора HNO3. В первую пробирку добавляют 3-4 капли 2 н. HCl, во вторую — 3-4 капли раствора KBr, в третью — 3-4 капли раствора KI. Отмечают цвет образовавшихся осадков. Проверяют растворимость осадков в растворе гидроксида аммония.
2. Растворение галогенидов серебра в растворах KCN или Na2S2O3 за счет образования цианидных или тиосульфатных комплексов, более устойчивых по сравнению с аммиачными комплексами.
AgBr + 3CN — = [Ag(CN)3] 2- + Br — .
+++3. Реакция с хроматом калия K2CrO4.
Образуется кирпично-красный осадок хромата серебра, растворимый в азотной кислоте и гидроксиде аммония.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы серебра, добавляют 3 капли раствора хромата калия. Наблюдают цвет образовавшегося осадка.
4. Реакция восстановления до металлического серебра при действии формальдегида на аммиачный раствор соли серебра. Ионы серебра в присутствии восстановителей (формальдегид, Mn 2+ , Sn 2+ ) легко восстанавливаются до металлического серебра:
КАК ОПРЕДЕЛИТЬ ВЕЩЕСТВО В ПРОБИРКЕ? | КАЧЕСТВЕННЫЕ РЕАКЦИИ | Видеоурок по химии №6
При проведении реакции с формальдегидом на стенках пробирки образуется блестящий налет металлического серебра (реакция «серебряного зеркала»).
Методика проведения реакции. В пробирки помещают 3 капли раствора, содержащего ионы Ag + , 3 капли раствора NH4OH, добавляют 3 капли 10%-ного раствора формальдегида и погружают пробирку в теплую воду. Наблюдают образование зеркала металлического серебра.
5. Реакция с дитизоном (С6H5)2CSN4H2. Дитизон образует с ионом Ag + внутрикомплексное соединение, окрашенное в желтый цвет и экстрагируемое хлороформом или четыреххлористым углеродом:
Методика проведения реакции. К 1-2 каплям анализируемого раствора добавляют 2-3 капли 2 н. раствора H2SO4 и экстрагируют 0,002%-ным раствором дитизона в CCl4. В присутствии ионов серебра органический слой окрашивается в желтый цвет. Определению мешают ионы Hg 2+ и Cu 2+ , которые можно замаскировать, прибавив перед началом выполнения реакции раствор ЭДТА.
Методика проведения реакций. а) К 2 каплям анализируемого раствора добавляют 2 капли раствора хлорида олова (II). Через минуту добавляют еще 2 капли реагента. Наблюдают выпадение осадка черного цвета. б) На медную пластинку наносят 2 капли раствора, содержащего ионы Hg2 2+ . Через несколько минут пластинку промывают водой, протирают и наблюдают блестящее пятно ртути.
Реакция с иодидом калия KI.
Образуется грязно-зеленый осадок Hg2I2, растворимый в избытке реагента с образованием тетраиодомеркурата(II) калия и черного осадка металлической ртути:
Методика проведения реакции. К 3 каплям анализируемого раствора добавляют 3 капли раствора иодида калия. После образования грязно-зеленого осадка добавляют еще 5 капель иодида калия и наблюдают растворение зеленого и появление черного осадка.
Реакция со щелочами.
В результате реакции катион Hg2 2+ диспропорционирует на оксид ртути(II) и дисперсную ртуть черного цвета.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы Hg2 2+ , добавляют 3 капли раствора щелочи и наблюдают выпадение черного осадка.
4. Реакция с хроматом калия K2CrO4.
Образуется осадок хромата ртути красного цвета, растворимый в азотной кислоте.
5. Реакция с соляной кислотой (люминесцентная реакция). Для обнаружения ртути (I) можно использовать реакцию образования каломели Hg2Cl2, способной люминесцировать оранжево-красным светом в ультрафиолетовом свете.
Методика проведения реакции. На предметное стекло наносят каплю раствора, содержащего ионы ртути (I), и каплю 2 н. HCl. Наблюдают оранжево-красное свечение в ультрафиолетовом свете.
+++1. Реакция с хроматом K2CrO4 или дихроматом K2Cr2O7 калия
в результате которой образуется желтый осадок хромата свинца, нерастворимый в NH4ОН, в отличие от хромата серебра. Осадок хромата свинца растворим в растворе щелочи по реакции:
Методика проведения реакции. К 2-3 каплям раствора, содержащего ионы свинца, добавляют 2-3 капли раствора CH3COOH или CH3COONa и 2-3 капли K2Cr2O7. Образуется желтый осадок. Пробу центрифугируют, отделяют осадок от раствора и к осадку добавляют 3-5 капель 2 н. NaOH. Наблюдают растворение осадка. Мешают определению ионы: Ba 2+ , Sr 2+ , Bi(III), Hg 2+ , Ag + .
+++2. Реакция со щелочами.
Pb 2+ + 2OH — ↔ Pb(OH)2 (тв).
Образуется белый осадок гидроксида свинца, растворимый в избытке реагента:
Методика проведения реакции. К 3 каплям раствора, содержащего ионы Pb 2+ , добавляют 3 капли раствора щелочи. После образования белого осадка добавляют еще несколько капель реагента и наблюдают растворение осадка.
3. Реакция с дитизоном (C6H5)2CSN4H2.В нейтральных и слабощелочных растворах дитизон реагирует с ионами свинца, образуя внутрикомплексное соединение красного цвета. Дитизонат свинца нерастворим в воде, но растворим в органических соединениях (CHCl3, CCl4):
Проведению реакции мешают другие катионы, поэтому целесообразно отделить катионы свинца от других, используя хорошую растворимость в горячей воде хлорида свинца.
Методика проведения реакции. В пробирку помещают 2-3 капли исследуемого раствора, добавляют 2 н. раствора NH4OH, доводя рН до 8-10, и 2-3 капли дитизона в CCl4. Смесь сильно встряхивают в течение 30 с. В присутствии свинца зеленая окраска реагента переходит в красную.
Некоторые реакции катионов второй аналитической группы приведены в табл. 6.
Сводная таблица реакций катионов второй аналитической группы
Источник: allrefrs.ru
Химия


Прибавили раствор соляной кислоты (1-2 капли). Наблюдали – выпадение осадков белого цвета.
Ag+ + Cl- = AgCl↓
Pb2+ + 2Cl- = PbCl2↓
Опыт 2. качественная реакция на катионы
Опыт 2. качественная реакция на катионы СЕРЕБРА
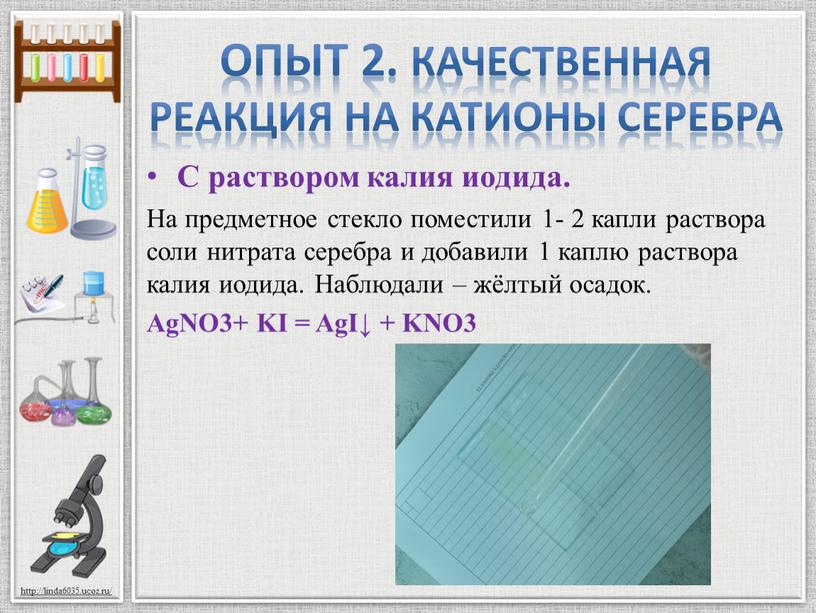
С раствором калия иодида.
На предметное стекло поместили 1- 2 капли раствора соли нитрата серебра и добавили 1 каплю раствора калия иодида. Наблюдали – жёлтый осадок.
AgNO3+ KI = AgI↓ + KNO3
С раствором натрия тиосульфата
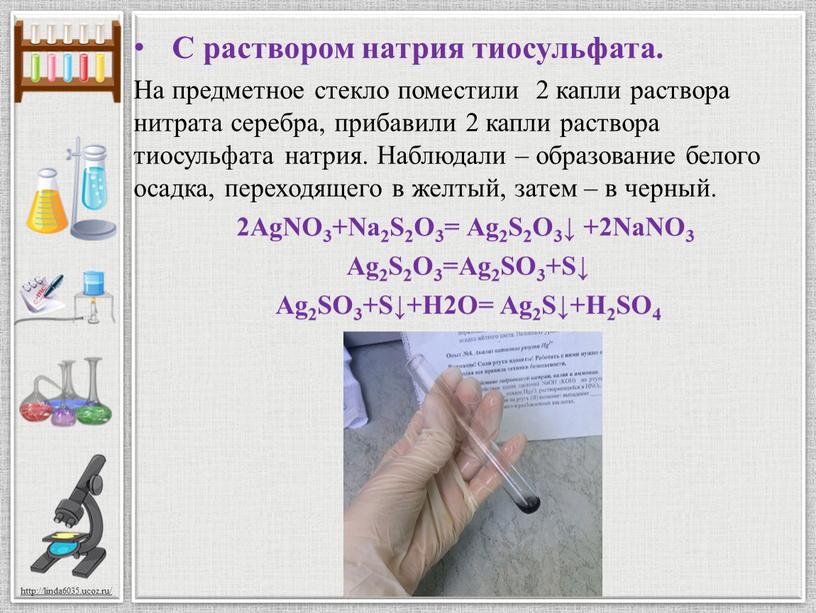
С раствором натрия тиосульфата.
На предметное стекло поместили 2 капли раствора нитрата серебра, прибавили 2 капли раствора тиосульфата натрия. Наблюдали – образование белого осадка, переходящего в желтый, затем – в черный.
2AgNO3+Na2S2O3= Ag2S2O3↓ +2NaNO3
Ag2S2O3=Ag2SO3+S↓
Ag2SO3+S↓+H2O= Ag2S↓+H2SO4
С формальдегидом в аммиачной среде (реакция «серебряного зеркала»)

С формальдегидом в аммиачной среде (реакция «серебряного зеркала»).
В хорошо промытую пробирку прибавили 3 — 4 капель раствора соли серебра и 3-4 капель раствор аммиака, добавили 3-4 капель формальдегида и нагрели. Наблюдали белый осадок.
HCOH+2AgNO3+3NH4OH=2Ag↓+HCOONH4+ 2H2O+ 2NH4NO3
Действие карбоната натрия. При действии

Действие карбоната натрия.
При действии Na2CO3, на раствор соли серебра образовался AgCO3. Наблюдали жёлтый цвет, на воздухе буреет.
Действие хромата калия. Фильтровальную бумагу смочили раствором
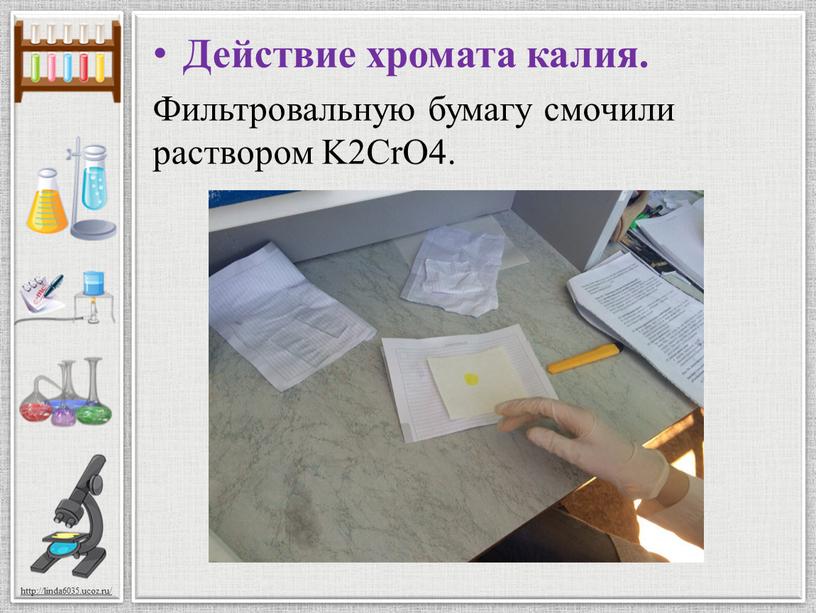
Действие хромата калия.
Фильтровальную бумагу смочили раствором K2CrO4.
Нанесли каплю раствора соли серебра

Нанесли каплю раствора соли серебра. Пятно окрасилось в фиолетовый цвет.
K2CrO4 + AgNO3 -> K2NO3 + AgCrO4
Опыт 3. качественная реакция на катионы

Опыт 3. качественная реакция на катионы СВИНЦА
С раствором калия иодида (реакция « золотой струи»)
В пробирку поместили по 3-4 капли раствора соли свинца (II) и раствора иодида калия. К полученному осадку прилили 3-4 капли очищенной воды и 3-4 капли разведенной уксусной кислоты, нагрели до растворения осадка, вылили полученный раствор в холодную воду. Наблюдали движение «золотой струи» при взбалтывании.
Pb(NO3)2+ 2KI=PbI2↓+2KNO3
С раствором калия хромата. На предметное стекло поместили 2 капли соли свинца раствора и 2 капли раствора хромата калия

С раствором калия хромата.
На предметное стекло поместили 2 капли соли свинца раствора и 2 капли раствора хромата калия. Наблюдали – образование желтого осадка.
Pb(NO3)2+K2CrO4=
PbCrO4↓ + 2KNO3
Действие гидроокисей натрия. В две пробирки налили по несколько капель соли свинца

Действие гидроокисей натрия.
В две пробирки налили по несколько капель соли свинца. В одну пробирку прибавили такой же объём раствора NaOH, а в другую NH4OH. Наблюдали – в первой пробирки обесцвечивание, а в другой пробирки образование белого осадка.
Pb(NO3)2 + 2NaOH=Pb(OH)2↓ + 2NaNO3
Pb(NO3)2 + NH4OH=PbOH+NH4(NO3)2
Действие с серной кислотой. При действии серной кислоты на соли свинца образовался

Действие с серной кислотой.
При действии серной кислоты на соли свинца образовался PbSO4 – очень мало растворимая соль.
Опыт 4. Анализ катионов ртути Действие гидроокисей натрия

Опыт 4. Анализ катионов ртути
Действие гидроокисей натрия.
При действии едкого щелоча NaOH на ртуть (I) образовался чёрный осадок Hg2O, растворяющийся в HNO3.
Hg2(NO3)2 + 2NaOH => Hg2O + Н2O+2NaNO3
Действие щелочей на ртуть (II) вызывал выпадение оранжевого (жёлтого) осадка HgO, растворяющийся в разбавленных кислотах.
Hg(NO3)2 + 2NaOH => HgO + H2O + 2NaNO3.
Гидроксид аммония с ртутью (I) дал осадок амидосоединения и металлической ртути (чёрный цвет осадка обусловлен выделением металлической ртути):

Гидроксид аммония с ртутью (I) дал осадок амидосоединения и металлической ртути (чёрный цвет осадка обусловлен выделением металлической ртути):
Hg2Cl2+2NH4OH=NH2HCl↓ +Hg↓ +NH4Cl+2H2O
Осадок нерастворим в избытке реактива.
При взаимодействии аммиака с ртутью (II) образовался белый осадок амидосоединения, растворяющийся в избытке реактива:
HgCl2+2NH4OH=NH2HgCl↓+NH4Cl+2H2O
Действие иодида калия. Иодид калия с ртутью (II) образовал красный осадок

Действие иодида калия.
Иодид калия с ртутью (II) образовал красный осадок HgJ2:
Hg(NO3)2+2KJ=HgJ2+2KNO3.
В избытке реактива происходило образование комплексной соли K2[HgJ4], при этом раствор обесцветился.
Иодид калия с ртутью (I) дал жёлтый осадок Hg2J2.
Hg2J2+2KJ=K2[HgJ4]+Hg↓.
Систематический ход анализа Исследуемую задачу разделяли на 2 пробирки

Систематический ход анализа
Исследуемую задачу разделяли на 2 пробирки. В пробирки добавили HCl 2n. После чего поместили в центрифугу на 3 минуты, разделили осадок и стали проверять на присутствие Pb и Ag.
В пробирку с центрифугатом добавили 2-3 капли аммиака

В пробирку с центрифугатом добавили 2-3 капли аммиака. После поместили 1-2 капли исследуемого раствора на предметное стекло и потерли палочкой и выявили в нашей задаче присутствие Pb и Ag. Наблюдали белые кристаллы.
Источник: znanio.ru
Задание 26 ЕГЭ ХИМИЯ

Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. ВЕЩЕСТВА РЕАКТИВ А) Бензол и гексен Б) Бутин–1 и бутин–2 В) Глюкоза и сорбит Г) Пропионовая кислота и пропанол 1) Бромная вода 2) Фенолфталеин 3) Соляная кислота 4) Раствор карбоната натрия 5) Аммиачный раствор оксида серебра Запишите в ответ цифры, расположив их в порядке, соответствующим буквам: А Б В Г
Картинками
Задания для подготовки
1. Задание 25 № 3666
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Бензол и гексен 1) Бромная вода
Б) Бутин–1 и бутин–2 2) Фенолфталеин
В) Глюкоза и сорбит 3) Соляная кислота
Г) Пропионовая кислота и пропанол 4) Раствор карбоната натрия
5) Аммиачный раствор оксида серебра
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
А) Бензол и гексен. Гексен реагирует с бромной водой (1).
Б) Бутин–1 и бутин–2. Бутин–1 реагирует с аммиачным раствором оксида серебра (5).
В) Глюкоза и сорбит. Глюкоза реагирует с аммиачным раствором оксида серебра (5).
Г) Пропионовая кислота и пропанол. Кислота реагирует с карбонатом натрия (4).
признаками качественной химической реакции и веществами, кото ‐
рые дают эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРИЗНАКИ РЕАКЦИИ ВЕЩЕСТВА
А) Исчезновение окраски раствора и 1) Водный раствор перманганата калия и выпадение белого осадка этилен
Б) Исчезновение окраски раствора и 2) Фенол и бромная вода выпадение бурого осадка 3) Раствор лакмуса и уксусная кислота
В) Обесцвечивание раствора без выпа ‐ 4) Пропен и бромная вода
дения осадка 5) Этиленгликоль и гидроксид меди (II)
Г) Образование раствора с интенсивной синей окраской
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) При взаимодействии фенола с бромной водой обесцвечивается бромная вода (исчезает окраска раствора) и выпадает белый осадок 2,4,6-трибромфенола (2).
Б) При окислении алкенов (этилен) водным раствором перманганата калия он обесцвечивается
(исчезает окраска раствора) и образуется бурый осадок оксида марганца (IV) (1). В) Алкены (пропен) обесцвечивают бромную воду (4).
Г) Многоатомные спирты (этиленгликоль) взаимодействуют с гидроксидом меди(II), образуя с ним раствор интенсивной синей окраски (5).
веществом и качественной реакцией на вещества этого класса: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА КАЧЕСТВЕННЫЕ РЕАКЦИИ
А) Ацетальдегид 1) Фиолетовое окрашивание раствора хлорида железа (III)
Б) Сорбит 2) Осадок с аммиачным раствором оксида серебра
В) Фенол 3) Образование фиолетового раствора с гидроксидом меди
4) Образование раствора с интенсивной синей окраской сгидроксидом меди (II)
5) Реакция «серебряного зеркала»
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) Качественная реакция на альдегиды (ацетальдегид) — реакция «серебряного зеркала»
(образование налёта серебра на стенках пробирки) с аммиачным раствором оксида серебра.
Б) Сорбит — многоатомный спирт (гексангексаол). Качественная реакция на многоатомные спирты — образование васильково-синего раствора с гидроксидом меди (II).
В) Фенол при взаимодействии с хлоридом железа (III) даёт фиолетовое окрашивание.
Г) Ацетилен вступает в реакцию с аммиачным раствором оксида серебра, в которой происходит образование осадка ацетиленида серебра.
реактивом и веществами которые можно различить с его помощью:
к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Медь с конц. 1)
Б) Раствор при нагревании 2)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) Реакция с медью при участии концентрированной серной кислоты — качественная реакция на нитрат-ион. В кислой среде нитрат-ион окисляет медь. Признак реакции — образование бурого газа :
Б) При нагревании щёлочи с солями аммония выделяется аммиак (качественная реакция на соли аммония):
В) С помощью растворимых солей бария можно обнаружить в растворе сульфат-ион, образующий с катионом бария нерастворимый в азотной кислоте белый осадок:
Осадки хлорида и сульфата свинца имеют белый цвет.
соответствие , которые необходимо различить, и реактивом, с помощью которого можно это сделать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Бутен–1 и бутан
Б) Растворы глицерина и пропанола
В) Растворы глюкозы и этаналя
Г) Уксусная и муравьиная кислоты
3) Гидроксид меди (II)
4) Раствор карбоната натрия
5) Аммиачный раствор оксида серебра
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) Бутен–1 и бутан — бутен реагирует с бромной водой.
Б) Растворы глицерина и пропанола — глицерин образует окрашенный ярко-синий комплекс при реакции с гидроксидом меди (II).
В) Растворы глюкозы и этаналя — глюкоза, как многоатомный спирт, образует окрашенный яркосиний комплекс при реакции с гидроксидом меди (II).
Г) Уксусная и муравьиная кислоты — муравьиная кислота реагирует с аммиачным раствором оксида серебра (реакция серебряного зеркала).
веществами, которые необходимо различить, и реактивом, с помо ‐
щью которого можно это сделать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Бензол и толуол 1) Лакмус
Б) Ацетилен и этилен 2) Бромная вода
В) Глюкоза и фруктоза 3) Соляная кислота
Г) Растворы фенола и пропанола 4) Аммиачный раствор оксида серебра
5) Подкисленный раствор перманганата калия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) Бензол и толуол — толуол может быть окислен подкисленным раствором перманганата калия.
Б) Ацетилен и этилен — ацетилен реагирует с аммиачным раствором оксида серебра.
В) Глюкоза и фруктоза — глюкоза реагирует с с аммиачным раствором оксида серебра.
Г) Растворы фенола и пропанола — фенол дает осадок с бромной водой.
7. Задание 25 № 3978
Установите соответствие между веществами и реактивом, с помощью которого их можно отличить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) карбонат натрия и сульфат натрия
Б) хлорид алюминия и хлорид калия
В) сульфат аммония и сульфат лития
Г) карбонат натрия и силикат натрия
1) гидроксид меди (II)
3) соляная кислота
5) гидроксид калия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Карбонат натрия при взаимодействии с соляной кислотой выделит углекислый газ, хлорид алюминия образует нерастворимый гидроксид в реакции с гидроксидом калия.
Сульфат аммония перейдет в водный раствор аммиака при взаимодействии с гидроксидом калия.
Силикат натрия образует нерастворимую кремниевую кислоту при взаимодействии с соляной кислотой.
и реактивом с помощью которого можно различить эти
вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) сульфид натрия и бромид натрия
Б) сульфат калия и нитрат калия
В) хлорид алюминия и хлорид магния
Г) гидроксид лития и гидроксид калия
1) гидроксид натрия
2) соляная кислота
4) гидроксид меди(II)
5) фосфат натрия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реакции сульфида натрия с соляной кислотой пойдет неприятный запах. Сульфат анионы связываются с катионами бария образуя нерастворимую соль. После реакции хлорида алюминия с гидроксидом натрия образуется нерастворимый гидроксид алюминия, который растворится в избытке щелочи (в отличие от гидроксида магния). Фосфат ионы образуют единственную нерастворимую соль лития — фосфат лития.
9. Задание 25 № 3983
Установите соответствие между веществами и реактивом, с помощью которого их можно отличить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) метан и этилен
Б) этаналь и метанол
В) бензол и уксусная кислота
Г) этанол и фенол
1) оксид серебра (аммиачный раствор)
2) гидрокарбонат натрия
5) хлороводородная кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Этилен — ненасыщенный углеводород, вступает в реакции бромирования, этаналь вступает в реакции серебряного зеркала. Уксусная кислота взаимодействует с гидрокарбонатом натрия. Фенол участвует в реакции бромирования.
веществами и с помощью которого их можно отличить: к
каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) уксусная кислота и этанол
Б) метанол и диэтиловый эфир
В) этаналь и диметилкетон
Г) этилен и этан
2) оксид серебра (аммиачный раствор)
4) гидрокарбонат натрия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Уксусная кислота реагирует с гидрокарбонатом натрия, спирт не реагирует. Метанол взаимодействует с металлом. Этаналь вступает в реакцию серебряного зеркала. Этилен подвергается галогенированию (в данном случае — бромированию).
11. Задание 25 № 3987
Установите соответствие между веществами и реактивом, с помощью которого их можно отличить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) уксусная и муравьиная кислота 1) фенолфталеин
Б) пропанол и пропанон 2) гидроксид натрия
В) этаналь и пропанон 3) бромная вода
Г) этилен и этан 4) оксид серебра (аммиачный раствор)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Муравьиная кислота, в силу своих особенностей, как и альдегиды, вступает в реакцию серебряного зеркала с оксидом серебра, калий реагирует со спиртом, этаналь — альдегид, тоже вступает в реакцию серебряного зеркала, этилен — ненасыщенный углеводород, вступает в реакцию бромирования.
соответствия и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) сульфит калия (р-р) и азотная кислота (р-р)
Б) гидроксид алюминия и гидроксид натрия
В) хлорид аммония и гидроксид кальция
Г) нитрат бария (р-р) и соляная кислота
1) растворение осадка
2) без видимых изменений
3) образование осадка
4) выделение газа
5) обесцвечивание раствора
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Сульфит калия образован слабой сернистой кислотой, при образовании нитрата калия сернистая кислота распадется на воду и оксид серы(IV), в реакции с щелочью гидроксид алюминия будет проявлять амфотерность, образовывать растворимый комплекс. В реакции хлорида аммония с гидроксидом кальция будет образовываться неустойчивый гидроксид аммония, который будет выделять аммиак. При реакции растворимой соли нитрата бария и соляной кислоты будет образовываться растворимая соль — хлорид бария (а точнее раствор ионов), а значит, никаких видимых изменений мы не увидим.
13. Задание 25 № 3990
Установите соответствие между веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Реагирующие вещества Признак реакции
А) бутадиен и бром (р-р) 1) растворение осадка
Б) уксусная кислота и гидроксид меди (II) 2) образование кирпично-красного осадка
В) этилен и перманганат калия (кислая 3) обесцвечивание раствора
среда) 4) появление фиолетовой окраски раствора
Г) белок и азотная кислота 5) жёлтое окрашивание
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Бутадиен присоединяет бром по месту разрыва двойных связей. Уксусная кислота реагирует с основаниями, образуется растворимая соль. Раствор перманганата калия имеет малиновый цвет, разрывает двойную связь алкенов, раствор обесцвечивается. Взаимодействие белка и азотной кислоты окрашивает раствор в желтый цвет.
между ионом и использующимся для его качественного
определения: к позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
РЕАКТИВ ДЛЯ КАЧЕСТВЕННОГО
A) силикатный анион 1) соляная кислота
Б) катион бария 2) гидроксид натрия
В) катион меди (II) 3) сульфат натрия
Г) катион алюминия 4) хлорид калия
5) ацетат аммония
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: znanio.ru