Карбонильные соединения Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Альдегиды Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. Структурная формула альдегидов:
Кетоны Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. Структурная формула кетонов:
Строение карбонильных соединений Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации.
Номенклатура карбонильных соединений Нумерация ведется от атома углерода карбонильной группы. По систематической номенклатуре к названию альдегида добавляют суффикс «-АЛЬ». 2-метилпропаналь
К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы. пентанон-2
Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. Практическая часть. 11 класс.
Тривиальные названия альдегидов и кетонов.
Изомерия карбонильных соединений Изомерия альдегидов Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия. Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул. Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета Бутаналь 2-Метилпропаналь
Изомерия альдегидов Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО. Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Изомерия альдегидов Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 Пропаналь Ацетон ( пропанон )
Изомерия кетонов Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия. Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета Пентанон-2 3-Метилбутанон-2
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода. Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО. Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
39. Альдегиды и кетоны (часть 2)
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 Пропаналь Ацетон ( пропанон )
Физические свойства альдегидов и кетонов Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
1.1. Гидрирование Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре .
1.3. Присоединение спиртов При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали . В качестве катализаторов процесса используют кислоты или основания . Полуацетали существует только при низкой температуре .
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами . Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя :
1.4. Присоединение циановодородной (синильной) кислоты Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил ( циангидрин ):
При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота Метаналь окисляется сначала в муравьиную кислоту, затем в углекислый газ: Формальдегид→ муравьиная кислота→ углекислый газ Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I ). Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II) Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды .
муравьиный альдегид окисляется гидроксидом меди ( II) HCHO + Cu(OH)2 = Cu + HCOOH + H2O Чаще в этой реакции образуется оксид меди ( I): HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»). Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
2.3. Жесткое окисление При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде ). при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов . Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
2.4. Горение карбонильных соединений При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты. CnH2nО + 3n/2O2 → nCO2 + nH2O + Q CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон . при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Получение карбонильных соединений
1. Окисление спиртов При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II) при окислении этанола оксидом меди образуется уксусный альдегид
при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны .
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении :
1.3. Окисление спиртов сильными окислителями Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции ).
2. Дегидрирование спиртов При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения . при дегидрировании этанола образуется этаналь
3. Гидратация алкинов Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений . при гидратации ацетилена образуется уксусный альдегид
при гидратации пропина образуется ацетон
4. Гидролиз дигалогенпроизводных алканов Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон . при гидролизе 1,1-дихлорэтана образуется этаналь
5. Каталитическое окисление алкенов При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид .
По теме: методические разработки, презентации и конспекты
Лекция по органической химии 11 класс: Альдегиды и кетоны
Лекция по органической химии 11 класс: Альдегиды и кетоны.

Технологическая карта к уроку «Альдегиды и кетоны» 10 класс О.С. Габриелян
Представлена система заданий, которую нужно выполнить учащимся в течении урока, по новой теме. Работа с учебником О.С. Габриелян. Химия. 10 класс.

Практическая работа « Альдегиды и кетоны».
ЗАКРЕПИТЬ ЗНАНИЯ О СВОЙСТВАХ АЛЬДЕГИДОВ И С ПОМОЩЬЮ КАЧЕСТВЕННЫХ РЕАКЦИЙ РАСПОЗНАВАТЬ АЛЬДЕГИДЫ СРЕДИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.

План урока в 10 классе по теме «Альдегиды и кетоны» с презентацией.
Урок построен с использованием технологии развития критического мышления, используется прием «кластер» с презентацией. Для базового уровня.
Конспект открытого урока по теме: «Альдегиды и кетоны» вводный урок
Место урока в учебном плане – урок введения нового материала.
Информационная карта по теме: «Альдегиды и кетоны»
Данная карта была использована при подготовке к зачёту по теме: «Альдегиды и кетоны» в 11 классе,заочная форма обучения.

тест Альдегиды и кетоны 10 класс
Тест составлен по учебнику Минченкова Е.Е. 10 класс Химия. Тест разноуровневый. Третий вариант упрощенный, четвертый — слегка усложненный. Тест можно использовать не только для контроля, но и для изуч.
Источник: nsportal.ru
Альдегиды

Органические соединения, содержащие альдегидную группу -СН=О, называются альдегидами. Вместе с кетонами они относятся к карбонильным веществам. Общая формула альдегидов и кетонов – CnH2nO или R-CHO.
Гомологи
Гомологический ряд альдегидов С-С10:
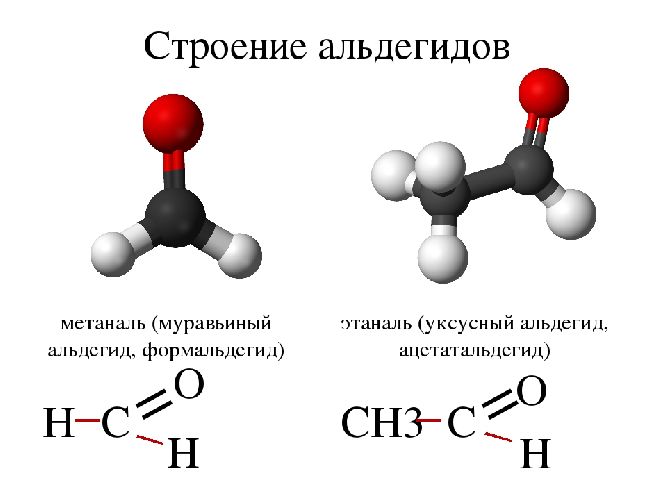
- метаналь или формальдегид (CH2O);
- этаналь или ацетальдегид (C2H4O);
- пропаналь (C3H6O);
- бутаналь (C4H8O);
- пентаналь (C5H10O);
- гексаналь (C6H12O);
- гептаналь (C7H14O);
- октаналь (C8H16O);
- нонаналь (C9H18O);
- деканаль (C10H20O).
Названия альдегидов, согласно номенклатуре ИЮПАК, образуются с помощью прибавления к названию алканов суффикса «аль» или «диаль» (у диальдегидов). Также в литературе встречаются тривиальные названия. Например, альдегид муравьиный (метаналь), уксусный (этаналь), валериановый (пентаналь).
Виды
Классификация альдегидов по двум признакам приведена в таблице.
Признак
Описание
Пример
Возможность образовывать новые связи
Содержат максимальное количество атомов водорода
Способны присоединять атомы водорода
Циклические соединения с тремя двойными связями
Количество карбонильных групп
Содержат только одну группу =С=О
Содержат две группы =С=О
Альдегидам, начиная с бутаналя, характерны два вида изомерии: межклассовая с кетонами и структурная. Например, изомерия углеродного скелета: СН3-СН2-СН2-СН=О (бутаналь) и СН3-СН(СН3)-СН=О (2-метилпентаналь). При присоединении к водороду метиленовой группы СН2 из пропаналя образуется пропанол (ацетон): СН3-СН2-СОН → СН3-СО-СН3.
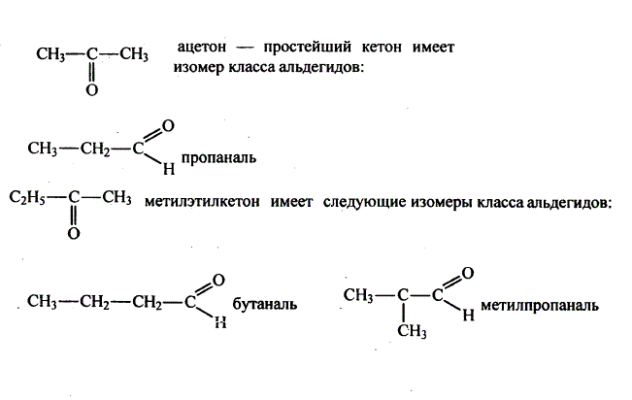
Получение
-
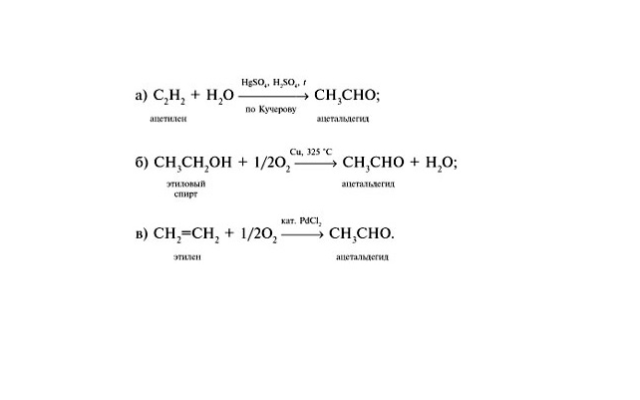
окислением спиртов оксидом меди (II):
R-CH2-OH + CuO → R-CHO + Cu + H2O;
H-С≡C-H + H2O → CH3CHO;
2C2H4 + O2 → 2CH3CHO;
CH4 + O2 → CH2O + H2O;
CH3-CH(OH)-CH3 → CH3-CO-CH3 + H2.
Физические свойства
Физическое состояние альдегидов зависит от количества атомов углерода:
- формальдегид – газообразное вещество;
- альдегиды, содержащие от двух до 12 атомов углерода, – жидкости;
- альдегиды с 13 и более атомами углерода – твёрдые вещества.
Температуры кипения альдегидов, имеющих линейное строение, выше, чем у разветвлённых изомеров. Плотность, вязкость, показатель преломления при нормальных условиях увеличиваются с возрастанием молекулярной массы.
Два первых альдегида в гомологическом ряду – формальдегид и этаналь – неограниченно смешиваются с водой. Далее в гомологическом ряду растворимость уменьшается с увеличением углеродного скелета. Альдегиды хорошо растворяются в спиртах, эфирах и других органических растворителях.
Гомологи С8-С13 используются в парфюмерной промышленности.
Химические свойства
Функциональная альдегидная группа определяет химические свойства альдегидов, которые аналогичны свойствам кетонов. Ниже описаны основные реакции с альдегидами.
Реакция
Описание
Уравнение
Альдегиды присоединяют молекулы воды, спиртов, тиололов, неорганических солей, аминов по двойной связи карбонильной группы
При взаимодействии с водородом образуются спирты
Качественные реакции оксидом серебра («серебряное зеркало») и гидроксидом меди (II) с образованием красного осадка
Что мы узнали?
Из урока химии 10 класса узнали, что такое альдегиды. Это родственные кетонам вещества, содержащие группу -СН=О. Альдегиды образуют гомологический ряд с общей формулой CnH2nO. Названия в ряду соответствуют названиям алканов с суффиксом «аль». Простейший альдегид – формальдегид или метаналь – бесцветный газ. Альдегиды ряда С2-С12 – жидкости.
Высшие альдегиды с 13 и более атомами углерода – твёрдые вещества. Альдегиды участвуют в реакциях окисления, восстановления, присоединения.
Источник: obrazovaka.ru
1. Окисление спиртов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрогенизация (дегидрирование) вторичных спиртов
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются — на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
3. Из одноосновных карбоновых кислот
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:

Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:

Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
4. Действие воды на дигалоидные соединения
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:

Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
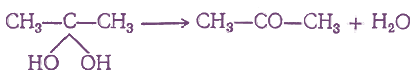
5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
6. Получение с помощью магний- и цинкорганических соединений
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
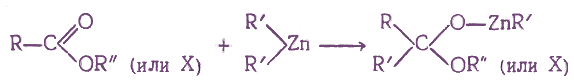
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
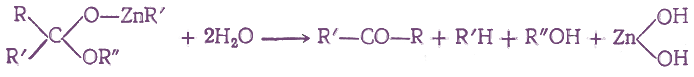
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
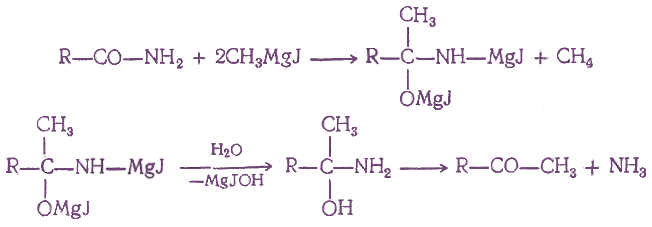
7. Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
Источник: examchemistry.com