Карбонильные соединения — органические вещества, содержащие в своей
Некоторые представители альдегидов и кетонов:
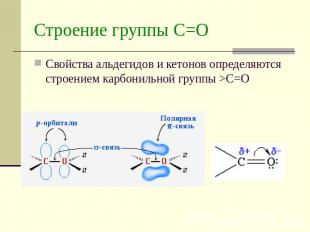
Атом углерода карбонильной группы находится в cостоянии sp 2 — гибридизации. Его конфигурация плоская, валентные углы между тремя -связями равны 120. -Связь образуется за счет перекрывания рz АО углерода и рz АО кислорода в плоскости, перпендикулярной плоскости -связей.
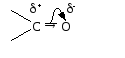
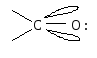
Связь С = О ковалентная, поляризованная. Электронная плотность связи смещается к более электроотрицательному атому кислорода. На атоме углерода возникает частичный положительный заряд. На ру АО кислорода находится неподеленная пара электронов. Таким образом, для карбонильной группы будут характерны реакции нуклеофильного присоединения АN.
Получение альдегидов и кетонов. 11 класс.
Реакционные центры:
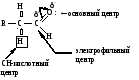
РАЗЛИЧИЯ В РЕАКЦИОННОЙ СПОСОБНОСТИ АЛЬДЕГИДОВ И КЕТОНОВ
Реакционная способность альдегидов и кетонов объясняется особенностями распределения электронной плотности, характером заместителей, связанных с карбонильной группой, пространственной доступностью реакционных центров.
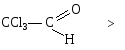
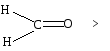
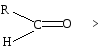
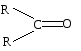

Снижение реакционной способности в реакциях АN

У кетонов, имеющих два радикала, обладающих +I эффектом, снижена электрофильность атома углерода, и АN реакции идут медленнее. При наличии объемных заместителей у кетонов создаются пространственные затруднения для атаки нуклеофила, и протекание АN реакций становится невозможным.
ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ.
Вследствие электрофильности атома углерода связь С—Н в карбонильной группе поляризуется и легко окисляется даже слабыми окислителями, такими как оксиды и гидроксиды металлов в щелочной среде, см. табл.3.
Кетоны, в отличие от альдегидов, окисляются сильными окислителями (НNО3, К2Сr2О7 в Н2SO4 и др.). Реакция окисления идет с разрывом углеродной цепи, при этом образуется смесь карбоновых кислот. Согласно правилу Попова, углеродная цепь разрывается преимущественно так, что карбонильная группа уходит с наименьшим радикалом.
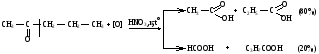
Химические свойства альдегидов и кетонов. 11 класс.
ОБЩИЙ МЕХАНИЗМ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ. СПОСОБЫ ПОВЫШЕНИЯ РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
Полярная связь C = О в альдегидах и кетонах склонна к гетеролитическому разрыву, и реакции протекают по механизму нуклеофильного присоединения. Атом углерода имеет электрофильный характер и восприимчив к атаке нуклеофильных реагентов.
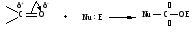
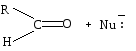
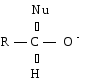
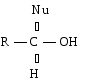
Примеры реакций нуклеофильного присоединения см. в табл.4.
Скорость протекания реакций АN зависит от величины эффективного положительного заряда на атоме углерода карбонильной группы и пространственной доступности электрофильного центра.
Повысить реакционную способность карбонильных соединений в АN реакциях можно двумя путями, направленными на повышение эффективного заряда на атоме углерода карбонильной группы:
1) Введением в радикал соединения сильных электроноакцепторов, как например, в 2,2,2-трихлорэтанале.
2) Использованием кислотного катализа:
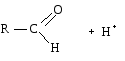

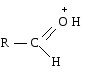

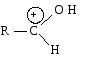
В результате взаимодействия протона с основным центром образуется карбокатион.
Качественные реакции на карбонильные соединения:
Источник: studfile.net
«Спирты, альдегиды, кетоны»(10-11 классы)
материал для подготовки к егэ (гиа) по химии (10 класс) на тему
Материал содержит краткое теоретическое введение, примеры решения заданий и задания для самостоятельной работы, которые можно использовать и для контроля знаний в 10 классе, но и для подготовки к ЕГЭ в 11 классе. К задачам приведены ответы.
Скачать:
| |
24.83 КБ |
Предварительный просмотр:
Спирты, альдегиды, кетоны
Спирты – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН.
Химические свойства спиртов определяются гидроксильной группой −ОН. Химические реакции спиртов могут протекать с участием всей группы (с разрывом связи С−О) или идти по водороду гидроксильной группы (с разрывом связи О−Н), например реакция этерификации.
Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца . Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце (С 6 Н 5 −ОН).
Фенол – твердое кристаллическое вещество с характерным запахом, плохо растворяющееся в воде. Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом.
Кислотные свойства. Фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами:
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2 ;
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O.
Качественная реакция на фенол . Фенол образует с FeCl 3 комплексную соль, окрашенную в фиолетовый цвет.
Под действием окислителей (K 2 Cr 2 O 7 , KMnO 4 ) в присутствии H 2 SO 4 спирты окисляются с образованием альдегидов и кетонов, например:
3С 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → Cr 2 (SO) 3 + K 2 SO 4 + 3СН 3 – СОН + 7Н 2 О
Альдегиды и кетоны содержат в молекуле карбонильную группу С = О
В молекулах альдегидов карбонильная группа соединена с углеводородным радикалом и атомом водорода. Первым членом гомологического ряда аль- дегидов является метаналь НСОН (формальдегид), 40 %-ный водный раствор формальдегида называется формалином.
В молекулах кетонов карбонильная группа соединена с двумя разными R−CO−R ′ или одинаковыми радикалами. Например, Н 3 С-С-СН 3
По своим химическим свойствам альдегиды являются восстановителями , которые легко окисляются в кислоты . Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра («реакция серебряного зеркала») и является качественной на альдегиды:
СН 3 -СН 2 -СОН + 2[Ag(NH 3 ) 2 ]OH → СН 3 -СН 2 -СООН + 2Ag↓ + 4NH 3 + H 2 O.
пропаналь пропановая кислота
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При этом происходит разрыв углеродной цепи и образование смеси продуктов. Кетоны не вступают в реакцию серебряного зеркала.
Примеры решения задач
Пример 1. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С 2 Н 4 → Х → Y → С 2 Н 5 −О−С 2 Н 5 .
Указать условия протекания реакций. Назвать вещества Х и Y.
Решение . Конечный продукт – диэтиловый эфир – получается из этилового спирта, следовательно, вещество Y – этанол. Перейти от этилена к этанолу можно через промежуточное соединение – галогенопроизводное этана (вещество Х).
При взаимодействии этилена с бромоводородом образуется бромэтан:
C 2 H 4 + HBr → C 2 H 5 Br.
Бромэтан гидролизуется до спирта действием водного раствора NaOH:
C 2 H 5 Br + NaOH → C 2 H 5 OH + NaBr.
При нагревании этанола до 140 °С в присутствии серной кислоты в качестве катализатора образуется диэтиловый эфир:
C 2 H 5 OH → С 2 Н 5 −О−С 2 Н 5 + H 2 O. (t ,Н + )
Пример 2. Какая масса пропилата натрия может быть получена при взаимодействии 15 г пропанола-1 с 9,2 г натрия?
Решение . Записываем уравнение реакции между пропанолом-1 и металлическим натрием:
2CH 3 −СH 2 −СН 2 −OH + 2Na → 2CH 3 −СH 2 −СН 2 −ONa + H 2 .
Определяем количества вещества пропанола-1 и натрия:
υ (С 3 Н 7 ОН) = m/ M = 15/60 = 0,25моль;
υ (Na) =m/M=9,2/23 = 0,4 моль (Na)
Из уравнения реакции следует, что число моль спирта и натрия должны быть равны, следовательно, натрий взят в избытке.
На основании уравнения реакции записываем:
υ (C 3 H 7 ONa) = υ(C 3 H 7 OH); υ (C 3 H 7 ONa) = 0,25 моль.
Определяем массу пропилата натрия, которую можно получить:
m (C 3 H 7 ONa) = υ(C 3 H 7 ONa) ∙ M (C 3 H 7 ONa);
m (C 3 H 7 ONa) = 0,25 ∙ 82 = 20,5 г.
Пример 3. Формалин представляет собой 40 %-ный водный раствор формальдегида. Рассчитать массу метанола, которую необходимо окислить для получения 600 г формалина.
Решение . Вычисляем массу формальдегида, который потребуется для приготовления формалина:
m (CH 2 O) = 40*600/100 = 240 г.
Количество вещества требуемого формальдегида равно
υ (CH2O) = 240/30 = 8 моль.
Составляем уравнение реакции окисления метанола:
CH 3 OH + [O] → CH 2 O + H 2 O.
Из уравнения реакции следует, что υ (CH 3 OH) = υ(CH 2 O); υ(CH 2 O) = 8 моль.
Масса требуемого метанола равна
m (CH 3 OH) = υ(CH 3 OH) ∙ M (CH 3 OH);
m (CH 3 OH) = 8 ∙ 32 = 256 г.
Задачи и упражнения для самостоятельного решения
1 . При взаимодействии бутанола-1 с избытком металлического натрия выделился водород, занимающий при нормальных условиях объем2,8 л. Определить количество вещества бутанола-1, которое вступило в реакцию.
( Ответ : 0,25 моль).
2. Назвать вещества Х и Y и написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) пропанол-1 → Х → пропанол-2;
б) этанол → Y → 1,2-дихлорэтан.
Указать условия протекания реакций.
3 . Для получения метанола использовали 2 м3 оксида углерода (II) и 5 м3 водорода при нормальных условиях. Получено 2,04 кг спирта. Определить выход спирта. ( Ответ : 71,4 %).
4 . Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
С → СН 4 → С 2 Н 6 → С 2 Н 4 → С 2 Н 5 ОН → С 2 Н 5 ОNa.
5. Определить массу фенолята натрия, который может быть получен при взаимодействии 4,7 г фенола с 4,97 мл 35 %-го раствора NaОН (ρ = 1,38 г/мл). ( Ответ : 5,8 г).
6. Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорэтан → этанол → этилен → пропаналь.
7. При окислении 13,8 г этанола избытком оксида меди (II) получен альдегид, масса которого составила 9,24 г. Определить выход продукта реакции. ( Ответ : 70 %).
8. Определить массу серебра, которая будет получена, если к избытку аммиачного раствора оксида серебра прибавить 50 г 11,6 %-го водного раствора пропаналя. ( Ответ : 21,6 г).
9. Какое количество вещества НСНО содержится в его 30 %-м водном растворе объемом 3 л и плотностью 1,06 г/мл? ( Ответ : 31,8 моль).
10. 280 мл ацетилена было использовано для получения ацетальдегида, выход которого составил 80 %. Какая масса серебра может образоваться при добавлении всего полученного альдегида к избытку аммиачного раствора оксида серебра? ( Ответ : 1,08 г).
11. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
С → СаС 2 → С 2 Н 2 → С 2 Н 4 → С 2 Н 6 → С 2 Н 5 Cl → С 2 Н 5 ОН.
12. При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра образовалось 20 г металла. Определить массовую долю (%) этаналя в техническом препарате. ( Ответ : 67,9 %). С О OН C O
13. Составить уравнения реакций, при помощи которых можно осуществить следующие превращения: метан → ацетилен → уксусный альдегид → этиловый спирт → уксусный альдегид.
14. Составить уравнения реакций, при помощи каких реакций можно осуществить следующие превращения:
С → СН 4 → С 2 Н 2 → С 6 Н 6 → С 6 Н 5 Cl → С 6 Н 5 ОН.
15. Рассчитать массу фенолята калия, которая может быть получена из 3,29 г фенола. ( Ответ : 4,62 г).
16. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения:
уксусный альдегид → этанол → этилен → ацетилен → уксусный альдегид.
17. Написать уравнения реакций, которые надо провести для осуществления следующих превращений:
а) СН4 → Х → СН3ОН → СН3−О−СН3;
б) этанол → этилен → Y → этанол.
Назвать вещества Х и Y.
18. При дегидратации пропанола-2 получили пропилен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2 %. Определить массу пропанола-2, взятого для реакции. ( Ответ : 2,4 г).
19. Рассчитать массу фенола, который можно получить гидролизом бромбензола массой 47,1 г, если массовая доля выхода продукта равна 40 %.
20. Составить уравнения реакций, которые необходимо провести для осуществления следующих превращений: пропин → Х → ацетон.
Назвать вещество Х, указать условия протекания реакций.
Источник: nsportal.ru
Презентация на тему: Альдегиды и кетоны

№ слайда 1
Описание слайда:
Альдегиды и кетоны
№ слайда 2
Описание слайда:
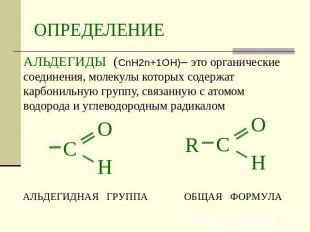
ОПРЕДЕЛЕНИЕ АЛЬДЕГИДЫ (СnH2n+1OН)– это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом водорода и углеводородным радикалом альдегидная группа общая формула

№ слайда 3
Описание слайда:
КЕТОНЫ КЕТОНЫ – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами R1 – C – R2 | | OОбщая формула
№ слайда 4
Описание слайда:
Строение группы С=ОСвойства альдегидов и кетонов определяются строением карбонильной группы >C=O
№ слайда 5
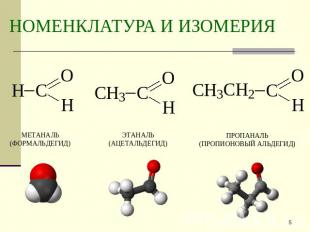
Описание слайда:
НОМЕНКЛАТУРА И ИЗОМЕРИЯ метаналь(формальдегид) этаналь(ацетальдегид) пропаналь(пропионовый альдегид)

№ слайда 6
Описание слайда:
№ слайда 7
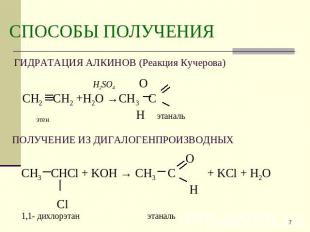
Описание слайда:
СПОСОБЫ ПОЛУЧЕНИЯ ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова) H2SO4 ОСН2 СН2 +Н2О →СН3 С этен Н этаналь ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ OСН3 СНСl + KOH → СН3 С + KCl + H2O H Cl 1,1- дихлорэтан этаналь

№ слайда 8
Описание слайда:
СПОСОБЫ ПОЛУЧЕНИЯ O Cu,t // CH3 – CH2 – CH2 – OH СH3 – CH2 – C + H2 H Cu,t СH3 – CH – CH3 CH3 – C – CH3 + H2 | | | OH O пропанон — 2 (ацетон)
№ слайда 9
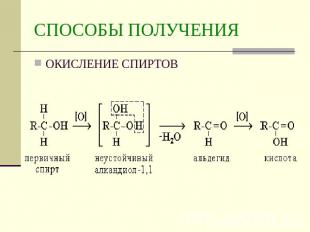
Описание слайда:
СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ СПИРТОВ
№ слайда 10
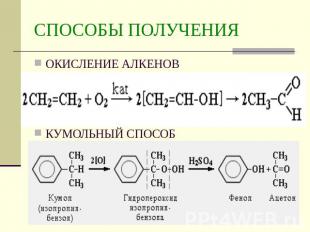
Описание слайда:
СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ АЛКЕНОВКУМОЛЬНЫЙ СПОСОБ

№ слайда 11
Описание слайда:
ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ ОКИСЛЕНИЯ Реакция серебряного зеркала ООСН3 С + 2[Ag(NH3)2]OH → СН3 С + Ag + 4NH3 + 2H2O Н OН
№ слайда 12
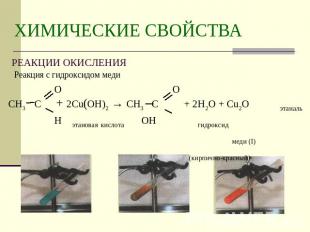
Описание слайда:
ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ ОКИСЛЕНИЯ Реакция с гидроксидом меди О ОСН3 С + 2Cu(OH)2 → СН3 С + 2H2O + Cu2O этаналь Н этановая кислота OН гидроксид меди (I) (кирпично-красный)
№ слайда 13
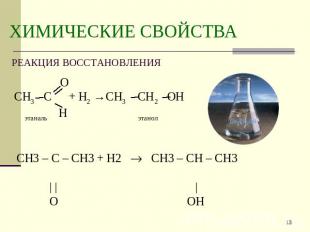
Описание слайда:
ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИЯ ВОССТАНОВЛЕНИЯ ОСН3 С + Н2 →СН3 СН2 ОН этаналь Нэтанол CH3 – C – CH3 + H2 CH3 – CH – CH3 | | | O OH
Описание слайда:

№ слайда 15
Описание слайда:
ХИМИЧЕСКИЕ СВОЙСТВАПрисоединение гидросульфитовРеактив Гриньяра
№ слайда 16
Описание слайда:
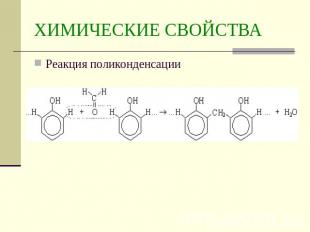
ХИМИЧЕСКИЕ СВОЙСТВАРеакция поликонденсации

№ слайда 17
Описание слайда:
ПРИМЕНЕНИЕ АЛЬДЕГИДОВ Парфюмерия Альдегид анисовый, обепин – жидкость с приятным запахом мимозыАльдегид дециловый, деканаль – при разбавлении появляются нотки запаха апельсиновой корки

№ слайда 18
Описание слайда:
ПРИМЕНЕНИЕ АЛЬДЕГИДОВ Полимерные материалы Фенолформальдегидные смолы

№ слайда 19
Описание слайда:
ПРИМЕНЕНИЕ АЛЬДЕГИДОВ Производство веществ Уксусная кислотаЭтилацетатФормалин
Источник: ppt4web.ru