С историей открытия кобальта связано немало легенд и преданий, в средние века люди были уверены, что здесь не обошлось без вмешательства нечистой силы. Ведь недаром название кобальтпроисходит от немецкого Kobolt–зловредный карлик, маленький гном, который строил всяческие козни, мешая рудокопам Саксонии заниматься добычей руды и выплавкой металла.
Некоторые руды, добытые в Саксонии, имели серебристый цвет и поначалу считались серебром. Но металл, получаемый из этих руд, давал ядовитые пары, которыми неоднократно были отравлены рудокопы (calorizator). В 1735 году химик из Швеции Георг Брандт выделил из «руды нечистой силы» металл серебристо-розоватого оттенка, который был назван кобольд.Впоследствии название преобразовалось в известное и привычное нам.
Общая характеристика кобальта
Кобальт является элементом IX группы IV периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 27 и атомной массой 58,9332. Признанное обозначение кобальта – Co(от латинского Cobaltum).
КОБАЛЬТ — что это такое? значение и описание

Нахождение в природе
Кобальт не сильно распространённый металл, скорее его можно отнести к редким, в земной коре присутствует в минимальных количествах. Насчитывается не более 30-ти минералов, в составе которых находится кобальт. Самое большое месторождение кобальта находится в Демократической Республике Конго, имеются залежи в США, Франции, Канаде и России.
Физические и химические свойства
Кобальт является твёрдым металлом серебристо-белого цвета, со слегка розоватым (реже – синим) отливом. При взаимодействии с воздухом окисление происходит при высоких температурах (300˚С и выше).
Суточная потребность в кобальте
Суточная потребность в кобальте очень невелика, обычно составляет 0,1 – 0,8 мг для здорового взрослого человека. Обычно дневную норму кобальта человек получает из пищи.
Продукты питания богатые кобальтом
Основные источники кобальта:
- фасоль и зелёный горошек
- баранья и говяжья печень
- печень трески
- морепродукты и жирные сорта рыб
- свёкла, зелёные листовые овощи
- манка, некоторые виды хлеба
- земляника
- молоко, сыры.
Признаки нехватки кобальта
Признаками нехватки в организме человека кобальта являются участившиеся заболевания системы кровообращения и эндокринной. Причиной недостатка кобальта обычной служат хронические заболевания органов пищеварения (гастрит, язва двенадцатиперстной кишки).
Применение кобальта в жизни
Кобальт нашёл широкое применение в виде сплавов – в металлургической промышленности для повышения жаропрочности стали, в производстве магнитов, как состав красителей – в изготовлении стекла и керамики.
ЗА ЧТО ЛЮБЯТ ШЕВРОЛЕ КОБАЛЬТ 2022 ??? RAVON R4 ! Chevrolet Cobalt вся ПРАВДА !
Полезные свойства кобальта и его влияние на организм
Кобальт – один из жизненно важных микроэлементов, присутствие его в организме человека обязательно. Кобальт входит в состав витамина В12, принимает участие в синтезе ДНК и аминокислот, в расщеплении белков, жиров и углеводов. Активно влияет на обменные процессы организма, особую роль играет в кроветворении – стимулирует рост и развитие эритроцитов. Кобальт поддерживает нормальную деятельность поджелудочной железы и регуляцию активности адреналина.

Источник: calorizator.ru
Кобальт
Ко́бальт(лат. Cobaltum), Co, химический элемент VIII группы короткой формы (9-й группы длинной формы) периодической системы ; атомный номер 27, атомная масса 58,933195. В природе один стабильный изотоп 59 Co. Искусственно получены радиоизотопы с массовыми числами 48–75.
Историческая справка
Оксид СоО применяли в Древнем Египте , Вавилоне , Китае для окрашивания смальты , стёкол , эмалей в синий цвет. В Западной Европе начиная с 16 в. для этого использовали цафру (или сафлор), получаемую обжигом руды «кобольд» (от нем. Kobold – домовой, гном; название было связано с трудностью переработки руды). В 1735 г. Г. Брандт, нагревая смесь цафры с углём и флюсом , выделил металл, который назвал «корольком кобольда». В конце 18 в. это название было изменено на «кобальт».
Распространённость в природе
Содержание кобальта в земной коре составляет 4·10 –3 % по массе, в морской воде – 0,005 мг/дм 3 . Наиболее важные минералы кобальта: кобальтин CoAsS, шмальтин (смальтин) CoAs2, хлоантит (Co, Ni)As2, эритрин Co3(AsO4)2·8H2O. Кобальту сопутствует Ni, Fe, Cu, Mn в полиметаллических рудах . Кобальт входит в состав метеоритов , в микроколичествах содержится в тканях растений и животных.

Образец кобальта. Образец кобальта.
Свойства
Конфигурация внешней электронной оболочки атома кобальта 3d 7 4s 2 , в соединениях обычно проявляет степени окисления +2, +3, редко +1, +4, +5; энергии ионизации Co 0 →Co + →Co 2+ →Co 3+ соответственно равны 7,866, 17,057, 33,500 эВ; электроотрицательность по Полингу 1,88; атомный радиус 135 пм; ионные радиусы Co 2+ 79 пм ( координационное число 6), Co 3+ 69 пм (координационное число 6).
Кобальт – твёрдый серебристый с розоватым отливом металл . При нормальном давлении существует в виде двух кристаллических модификаций : до температуры 427 °С устойчива α-модификация с гексагональной решёткой; выше 427 °С – β-модификация с кубической гранецентрированной решёткой ; tпл1495 °С, tкип2927 °С, плотность 8900 кг/м 3 . Кобальт – ферромагнетик , точка Кюри 1121 °C.
Кобальт не растворяется в щелочах , медленно взаимодействует с разбавленными минеральными кислотами с образованием соединений Co (II). Концентрированная азотная кислота HNO3на холоду пассивирует кобальт за счёт формирования на поверхности металла нерастворимой в кислотах оксидной плёнки, при нагревании – окисляет с образованием соединений Со (II).
Кобальт образует два ряда солей – соли Со (II), например сульфат CoSO4, нитрат Co (NO3)2, и соли Со (III), например сульфат Co2(SO4)3, нитрат Co (NO3)3. Соли Co (II) устойчивы на воздухе; водные растворы солей Со (II) из-за присутствия аквакомплекса [Co (H2O)6] 2+ окрашены в розовый цвет. Соли Со (III) термически нестойки, многие гидролизуются водой, являются сильными окислителями. Из водных растворов соли кобальта выделяются в виде кристаллогидратов, например CoSO4·7Н2О, Co2(SO4)3·18Н2О.
Существует несколько тысяч комплексных соединений кобальта, в том числе комплексы, в которых кобальт формально проявляет степень окисления 0, – карбонилы , например октакарбонилдикобальт Со2(CO)8. Комплексы Co (III) более устойчивы, чем комплексы Co (II). Многие комплексные соединения кобальта имеют большое практическое значение (главным образом в аналитической практике и в гидрометаллургии). Кобальт образует различные кобальторганические соединения .
Биологическая роль
Кобальт – жизненно важный микроэлемент – входит в состав витамина B₁₂ и его коферментных форм. Суточная потребность человека в кобальте 7–15 мкг. При недостатке кобальта в организме развивается злокачественная анемия . Кобальт участвует в процессах обмена веществ : активирует кроветворение , влияет на синтез нуклеиновых кислот , обмен белков, углеводов и жиров, участвует в окислительно-восстановительных реакциях в живом организме. Кобальт входит в состав ферментных систем клубеньковых бактерий , осуществляющих фиксацию атмосферного азота ; стимулирует рост, развитие и продуктивность растений. Пыль металлического кобальта токсична .
Получение
Кобальтсодержащее сырьё подвергают пиро — и гидрометаллургической (с использованием H2SO4или растворов NH3) переработке. От сопутствующих элементов кобальт отделяют путём фракционного окисления и гидролитического осаждения (удаление Fe, Mn, As), цементации (удаление Cu и Ag), а также экстракции . Для разделения кобальта и никеля кобальт осаждают действием NaClO или Cl2. Металлический кобальт получают восстановительной плавкой Co3O4, образующегося при прокаливании Со (ОН)3; электролизом растворов солей (CoSO4, CoCl2), восстановлением водородом из аммиачных растворов. Объём мирового производства около 132 тыс. т/год (2019).
Применение
До 65 % получаемого кобальта используют как компонент различных сплавов – магнитомягких , магнитотвёрдых , высокопрочных, жаростойких , твёрдых, с заданным термическим коэффициентом расширения и др. Соединения кобальта – катализаторы , пигменты , компоненты стёкол и керамики , микроудобрения . Радиоактивный 60 Co ( период полураспада T1/25,27 года) – источник γ-излучения – применяют в дефектоскопах , в радиотерапии злокачественных опухолей .
Аликберова Людмила Юрьевна . Первая публикация: Большая российская энциклопедия, 2009.
в 23:22 (GMT+3) Обратная связь
Информация

Области знаний: Общие вопросы химии Символ: Co Атомный номер: 27 Группа элементов: Переходные металлы Относительная атомная масса: 58,933195 а. е. м. Радиус атома: 135 пм Электроотрицательность: 1,88 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность при н. у.: 8,9 г/см³ Температура плавления: 1495 °C Температура кипения: 2927 °C
Источник: bigenc.ru
Кобальт — металл, востребованный в промышленности и необходимый организму

Кобальт, Co — металл, простой элемент таблицы Менделеева. Как и никель, назван в честь злобных духов немецких горняков кобольдов (гномов), из-за проделок которых, по мнению суеверных рудокопов, руды при обработке выделяли удушающий дым.
Впервые кобальт был получен в 1735-м году, но с самим веществом человечество имело дело с давних пор. В Древнем Египте, Китае, Вавилоне, Ассирии умели выплавлять стекло и эмаль ярко-синего «кобальтового» цвета, используя секретные ингредиенты из руд, как теперь известно, содержавших этот металл.
Кобальт встречается почти в тридцати различных минералах как сопутствующий элемент никеля, железа, меди, хрома, марганца. Месторождений, богатых Co, мало, и они почти все уже выработаны, поэтому добывают металл, чаще всего, из никелевых руд, в которых он присутствует как примесь.
Свойства
Тяжелый твердый металл серебристого цвета с оттенками розового, желтого, голубого цветов. Тверже железа, тягучий, но хрупкий. Существует в двух вариантах кристаллической решетки. Ферромагнетик. В виде мелкодисперсионного порошка самовоспламеняется на воздухе.

В химических соединениях проявляет различную валентность, наиболее распространены соединения Co (II) и Co (III). В нормальных условиях устойчив к кислороду, воде, щелочам, слабым кислотам. Концентрированная азотная кислота образует на поверхности металла стойкую оксидную пленку и дальше реакция не идет.
При нагревании кобальт вступает в реакции с водой, кислородом, галогенами, серой, мышьяком, фосфором, углеродом, азотом, кремнием, водородом, селеном.
Взаимодействие с неконцентрированными кислотами приводит к образованию водорастворимых солей: хлорида, нитрата, сульфата кобальта. Кобальт (III) образует устойчивые комплексные соединения, содержащие молекулы аммиака и некоторых других органических аминов.
Воздействие на организм
Относится к веществам, необходимым для нормального функционирования человеческого организма. Участвует в кроветворении, в работе печени, поджелудочной железы, нервной и иммунной системы, обменных процессов; входит в состав молекулы витамина В12; необходим для существования микрофлоры кишечника. Растениям он нужен для фиксации азота, добываемого из воздуха.
Человеку, животным и растениям кобальт требуется в микродозах. Обычно суточную норму человек получает с пищей. Недостаток и избыток кобальта вызывают заболевания.
Пары и пыль соединений кобальта, попавшие в органы дыхания человека, способны вызвать отравление. Его симптомами являются кровотечение, отек легких, повышенное давление, сбои в работе сердца и щитовидной железы. В этом случае требуется врачебная помощь. Для предотвращения отравлений на производствах следует следовать технике безопасности, применять средства защиты органов дыхания и кожи.
Применение
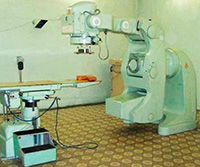
— В металлургии для получения термостойких, тугоплавких, особо твердых, износостойких, устойчивых к коррозии и воздействию кислот сталей и сплавов. Такие стали и сплавы используются для производства режущих скоростных инструментов, анодов, покрытий в машиностроении, конструкционных элементов атомных реакторов.
— Сплавы с магнитными свойствами идут на изготовление различных электротехнических и электронных приборов, головок для магнитной записи, постоянных магнитов.
— В химической промышленности хлорид кобальта используется как катализатор в органическом синтезе бензола, в производстве соды, азотной кислоты, сульфата аммония. В качестве катализатора применяют и порошковый реактив.
— В аналитической химии как индикатор некоторых соединений.
— Оксид и другие соединения Co востребованы в изготовлении стекол и керамики, эмалей, пигментов, красителей, лакокрасочной продукции.
— В сельском хозяйстве, ветеринарии и фармацевтике — элемент микроудобрений, кормовых добавок для скота, животных, пчел, некоторых лекарств для людей.
— Изотоп 60Со очень важен как источник гамма-излучения. Он применяется в дефектоскопах; в установках для лечения злокачественных опухолей; для стерилизации лекарств, продуктов питания, инструментов; для уничтожения вредителей в зерно- и овощехранилищах; как топливо в радиоизотопных батареях (например, для космических аппаратов). Короткоживущие изотопы 56Co, 57Со, 58Со применяются в медицинских исследованиях как изотопные метки.
Источник: pcgroup.ru
