КОБАЛЬТ, Со (от нем. Kobold — домовой, гном * а. соbalt; н. Kobalt; ф. соbalt; и. соbalto), — химический элемент VIII группы периодической системы Менделеева, атомный номер 27, атомная масса 58,9332. Природный кобальт состоит из 2 стабильных изотопов 59 Со (99,83%) и 57 Со (0,17%). Важнейший из искусственных радиоактивных изотопов 60 Со. Получен в 1735 шведским химиком Г. Брандтом.
- Свойства кобальта
- Кобальт химический
- Нахождение в природе
- Применение кобальта
Характеристики кобальта
Кобальт — бледно-жёлтый с розоватым или синеватым отливом металл. Кристаллическая решётка ниже 430°С гексагональная плотноупакованная, выше — гранецентрированная кубическая.
Плотность 8900 кг/м 3 ; t плавления 1494°С; t кипения 2960°С; модуль упругости (19,6-20,6)•10 10 Па; температурный коэффициент линейного расширения 12,08•10 -6 К -1 при 0°С; Cp (температура 20°С) 24,8 Дж/(моль•К); D Нпл 0,277 МДж/кг; коэффициент теплопроводности l 69,08 Вт/(м•К) при 20°С; удельное сопротивление r=5,68•10 -8 Ом•м; работа выхода 4,41 эВ; ферромагнитен, точка Кюри 1121°С. Степень окисления +2 и +3. Компактный кобальт устойчив на воздухе, выше 300°С покрывается плёнкой СоO; тонкодисперсный кобальт пирофорен; реагирует с разбавленными кислотами (кроме HF); при комнатной температуре взаимодействует с галогенами (кроме F2), при нагревании до 300-500°С — с S, Р, As. Образует непрерывные ряды твёрдых растворов с Fe, Ir, Mn, Ni, Pd, Pt, Rh, органические твёрдые растворы с Au, Cr, Os, Re, интерметаллические соединения со многими металлами. Пыль кобальта токсична: ПДК 0,5 мг/м 3 .
Кобальт Отличие Комплектаций! Базовая vs Топовая!
Химические свойства
Содержание кобальта в земной коре 0,0018%. Известно около 50 минералов кобальта, из них около 1/2 — сернистые, мышьяковистые и им подобные соединения карролит CuСо2S4, линнеит Со3S4, кобальтин СоAsS, саффлорит (Со, Fe) As2, скуттерудит СоAs3, шмальтин (Со, Ni) As3 и др.; рудные минералы-носители — пирит, пирротин, пентландит, халькопирит, арсенопирит. Геохимически наиболее сходен с Fe и Ni, типичный элемент ультраосновных, отчасти основные горные породы и халькогенидных рудных ассоциаций, связанных с глубинными источниками, в которых ассоциируются Fe, Ni, Cu, Ag, U, а также некоторых осадочно-метаморфических образований (Fe, Mn, Ni и др.).
Кобальт в природе
Кобальт в микроколичествах обнаружен в морской воде, минеральных источниках, почве, растительных и живых организмах. Об основных генетических типах месторождений и методах обогащения см. в ст. Кобальтовые руды.
Попутное извлечение кобальта возможно при переработке кобальтсодержащих руд железорудных магнетитовых месторождений, обогащённых сульфидной составляющей; железо-марганцевых океанических конкреций. Металлический кобальт получают восстановительной плавкой с углём, электролизом растворов сульфата или хлорида кобальта, восстановлением водородом под давлением из аммиачных растворов гидроксиды и аммиачные растворы — продукты гидрометаллургической или комбинированной (пиро- и гидрометаллургической) переработки руд. Отделяется кобальт от сопутствующих металлов путём фракционного окисления и гидролитического осаждения, а также экстракцией.
Шевроле Кобальт отзыв после двух лет эксплуатации!!!
Применение и использование
Кобальт применяется главным образом в производстве жаропрочных, магнитных, сверхтвёрдых, коррозийно-стойких и других сплавов и покрытий. На основе кобальта изготовляют катализаторы для органического синтеза. Радиоактивный изотоп 60 Со (ТЅ, 5,24 года) — источник g-излучений в технике и медицине («кобальтовая пушка»). Соединения кобальта используются при получении стойких эмалей и красок, керамики и стекла, в производстве химикалий.
Источник: www.mining-enc.ru
Подгруппа кобальта
Высшая степень окисления кобальта и его аналогов ниже, чем у железа, рутения и осмия. Для кобальта наиболее типичны степени окисления +2, +3, Для элементов подгруппы кобальта характерны координационные числа 6 и 4
По химической активности кобальт несколько уступает железу. В обычных условиях он довольно устойчив, например кислородом начинает окисляться лишь при 300° С.
При нагревании взаимодействует почти со всеми неметаллами, образуя, как и железо, от солеподобных соединений (СоНа12) до соединений металлического типа (Со3С, Со2В, Co2N), а также твердые растворы (с Н, В,). По отношению к кислотам кобальт также несколько устойчивее железа. С щелочами практически не взаимодействует.
Соединения Со(0). Для кобальта и его аналогов в степени окисления 0 известны карбонилы. Простейший карбонил кобальта Со2(СО)8
Соединения Со(II). Степень окисления +2 характерна для кобальта. При этой степени окисления у него устойчивы координационные числа 6 и 4
Оксид кобальта (II) СоО (серо-зеленые кристаллы) образуется при взаимодействии простых веществ или термическим разложением Со(ОН)2, СоСОз.
Галогениды СоНа12 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. Дигалогениды (кроме CoF2) растворимы в воде.
Гидроксид Со(ОН)2 существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли Со (II) на холоду; при нагревании Со(ОН)2 переходит в розовую модификацию. В воде Со(ОН)2 не растворяется. По химической природе он, как и СоО, — амфотерное соединение, преимущественно проявляющее основные свойства.
Из катионных комплексов для Со (II) наиболее характерны аквакомплексы [Со(ОН2)6] 2+ , придающие растворам ярко-розовую окраску. Эти катионы образуются при взаимодействии с кислотами кобальта, СоО, Со(ОН)2. Аммиакаты Со (II) устойчивее, чем Fe (II), но все же водой разрушаются:
При нагревании Со(ОН)2 с концентрированными щелочами образуется [Со(ОН)4] 2- :
Реакция образования синего тиоцианатокобальта (II) используется для определения кобальта (II) при анализе. 2KNCS + Co(NCS)2 = K2[Co(NCS)4]
Соединения Со (Ш). В степени окисления +3 для кобальта очень характерны многочисленные катионные, анионные и нейтральные комплексы, в которых они шестикоординационны.
Бинарные соединения и соли для Со (III) нехарактерны Среди кобальтатов (III) весьма многочисленны и часто очень устойчивы соединения типа Ме +1 [Э(СN)6] и M3 +1 [Э(N02)6].
Подгруппа никеля
Для никеля и палладия наиболее характерна степень окисления +2, для никеля и его аналогов наиболее устойчивы координационные числа 4 (тетраэдр или квадрат) и 6 (октаэдр).
Никель обычно содержится в сульфидных медно-никелевых рудах
По химической активности никель несколько уступает железу и кобальту. С кислородом он начинает взаимодействовать при 500° С. При нагревании (в особенности в измельченном состоянии) легко окисляется галогенами, серой, селеном, фосфором, мышьяком, сурьмой и др. С большинством из них он, как и другие d-элементы, образует нестехиометрические соединения переменного состава, многие из которых металлоподобны.
По отношению к кислотам и щелочам никель ведет себя подобно железу и кобальту.
СОЕДИНЕНИЯ ЭЛЕМЕНТОВ ПОДГРУППЫ НИКЕЛЯ
Металлические и металлоподобные соединения. Никель с металлами VIII группы (кроме Ru и Os), марганцем и медью дает непрерывные твердые растворы. У никеля весьма разнообразны также интерметаллические соединения. Для Ni (0) получены комплексные цианиды K4[Ni(CN)4] Эти соединения — сильные восстановители; например, вытесняют водород из воды:
Соединения Ni (II) интенсивно окрашены. Оксид и гидроксид Ni (II) зеленого цвета. Получают NiO термическим разложением гидроксида, карбоната или нитрата Ni (II). Гидроксид Ni(OH)2 образуется при действии щелочей на растворы соединений Ni (II) в виде объемистого зеленого геля, который при стоянии постепенно кристаллизуется. NiO и Ni(OH)2 в воде не растворяются, но взаимодействуют с кислотами.
Из катионных комплексов никеля (II) устойчивы октаэдрические гексааква- и гексаамминокомплексы За счет образования аммиакатов Ni(0H)2 легко растворяется в присутствии аммиака и солей аммония:
На образовании устойчивых аммиакатов основаны гидрометаллургические методы извлечения никеля и руд.
Источник: studfile.net
Подгруппа кобальта

Кобальт Со, родий Rh и иридий Ir — полные электронные аналоги.
По сравнению с элементами подгруппы железа и кобальта и его аналогов происходит дальнейшее спаривание (n—1) d -электронов и стабилизация (n—1) d -подслоя. Поэтому высшая степень окисления кобальта и его аналогов оказывается ниже, чем у рутения и осмия, для кобальта наиболее типичны степени окисления +2 и +3, а для иридия степени окисления +3 и +4 примерно- равноценны, Получены также соединения родия (VI) и иридия (VI). для элементов подгруппы устойчивы координационные числа 6 и 4.
На Земле кобальт и родий встречаются в виде одного, а иридий — двух стабильных изотопов. Получено большое число их искусственных радиоактивных изотопов. Из последних важнейший 60 Со (период полураспада 5,24 года), получаемый по реакции 59 Со(n, g) 60 Сo
Изотоп 60 Со получал широкое применение в медицине в борьбе с раком («кобальтовая пушка»).
Чисто кобальтовые руды встречаются редко. Относительно более распространен минерал кобальтин (кобальтовый блеск СоАsS). Кобальт содержится в некоторых медных, никелевых, серебряных, железных, марганцевых и полиметаллических рудах, в животных и растительных организмах.
Иридий чаще всего встречается в виде сплава с осмием (осмистый иридий), а также, как и родий, в самородной платине и в медно-никелевых полиметаллических рудах.

Простые вещества. В виде простых веществ кобальт, родий и иридий — блестящие белые металлы: Со с сероватым, Rh и Ir с серебристым оттенком. По сравнению с железом кобальт более тверд и хрупок. Особо высокой твердостью отличаются родий и иридий. Основные константы Со, Rh и Ir. приведены ниже:
Кобальт имеет две аллотропные модификации. До 417 °С устойчив a-Со (гексагональная решетка); выше 417 °С — b-Со (гранецентрированная кубическая решетка). Родий и иридий кристаллизуются в гранецентрированной кубической решетке.
По химической активности кобальт несколько уступает железу. В обычных условиях он довольно устойчив, например кислородом начинает окисляться лишь при 300 °С. При нагревании взаимодействует почти со всеми неметаллами, образуя, как и железо, от соединений солеподобных (СоНаl2) до соединений металлического типа (Со3С, Со2В, Со2N), а также твердые растворы (с Н, В, О). По отношению к кислотам кобальт также несколько устойчивее железа. С щелочами практически не взаимодействует.
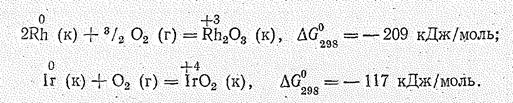
Родий и особенно иридий отличаются высокой химической устойчивостью. С неметаллами они взаимодействуют в мелкораздробленном состоянии при температуре красного каления. Так, на воздухе Rh начинает окисляться лишь при 600 °С, а Ir – выше 1000 °С:
В отличие от других благородных металлов компактные Rh и Ir практически не растворяются ни в одной из кислот и их смесей. Условия для перевода Rh и Ir в растворимые в воде производные хлорокомплексов создаются хлорированием при температуре красного каления смеси мелкораздробленного металла и NаСl:
С соответствующими металлами кобальт, родий и иридий образуют твердые растворы и интерметаллические соединения, что определяет физико-химические и механические свойства их сплавов. Особо широко используются кобальтовые сплавы. Многие из них жаропрочны и жаростойки.
Например, сплав виталлиум (65% Со, 28% Сr, 3% Ni и 4% Мо), применяемый для изготовления деталей реактивных двигателей и газовых турбин, сохраняет высокую прочность и практически не подвергается газовой коррозии вплоть до 800—900 °С. Имеются также кислотоупорные сплавы, не уступающие платине. Кобальтовые сплавы типа алнико (например, 50% Fе, 24% Со, 14% Ni, 9% Аl и 3% Сu) применяются для изготовления постоянных магнитов. Для изготовления режущего инструмента важное значение имеют так называемые сверхтвердые сплавы, представляющие собой сцементированные кобальтом карбиды вольфрама (сплавы ВК) и титана (сплавы ТК). Большое значение имеет кобальт как легирующая добавка к сталям.
Кобальт обычно получают переработкой полиметаллических руд. Рядом последовательных пирометаллургических операций выделяют Со3О4, который затем восстанавливают углем, водородом, иногда методом алюмотермии. Особо чистый кобальт получают электролитическим рафинированием, а также термическим разложением некоторых его соединений. Основная масса производимого кобальта используется для получения сплавов; его применяют для электролитического покрытия металлических деталей.
Области применения родин и иридия определяют их большая коррозионная стойкость и высокая твердость. Из них изготавливают ответственные детали контрольно-измерительных приборов. Родий, обладающий высокой отражательной способностью, используется в зеркалах и рефлекторах. Платино-родиевые сплавы применяются в качестве катализаторов окисления аммиака в производстве азотной кислоты.
Источник: studopedia.su