Роданометрический метод (метод Фольгарда) титриметрического анализа основан на применении в качестве осадителя титрованного раствора, содержащего SCN — -ионы:
Ag + + SCN — → AgSCN
В качестве стандартных растворов используют: для определения ионов роданид аммония; для определения галогенидов и других ионов – нитрат серебра и роданид аммония.
Роданометрическим методом пользуются для определения галоген-ионов и серебра в серебряных сплавах. В роданометрии в качестве индикатора для определения точки эквивалентности. применяют насыщенный раствор железо-аммонийных квасцов.
Метод Фольгарда обладает рядом достоинств по сравнению с методом Мора. Роданометрический метод применим для определения хлоридов, бромидов, иодидов, роданидов и ионов серебра.
Метод применим для титрования кислых растворов так как осадок AgSCN нерастворим в кислотах. Эта особенность метода делает очень удобным при анализе серебряных сплавов, которые растворяют в кислотах, и количественном определении галогенидов в сильнокислых средах, так как галогениды в указанных средах нельзя титровать по методу Мора или в присутствии адсорбционных индикаторов. Другие ионы (Ва 2+ , РЬ 2+ и др.), мешающие определению по методу Мора, в большинстве случаев не мешают определению по методу Фольгарда.
Обнаружение хлоридов,бромидов и йодидов при помощи нитрата серебра
Определение С1 — -ионов по методу Фольгарда основано на применении метода обратного титрования. Хлорид-ионы сначала осаждают определенным объемом стандартного раствора AgNO3, взятого с избытком. Затем оттитровывают не вступивший в реакцию с хлоридом избыток AgNO3 стандартным раствором NH4SCN в присутствии железо-аммонийных квасцов в качестве индикатора. По разности результатов двух титрований определяют объем раствора AgNO3, израсходованного на осаждение С1 — Таким образом, последовательно протекают три реакции:
Ag + + SCN — → AgSCN
3 SCN — + Fe 3+ → Fe(SCN)3
Однако в тот момент, когда избыток Ag + будет оттитрован роданидом, избыток SCN – вступает, кроме того, в реакцию с AgCl:
AgCI+ SCN — ↔ AgSCN + Сl —
Так как роданид серебра (ПPAgSCN = 10 -12 ) менее растворим, чем хлорид серебра (ПPAgCl=. 1,7*10 -10 ), то указанное равновесие сдвигается слева направо.
В момент равновесия отношение [C1 — ]/[SCN — ] равно отношению ПPAgCl/ПPAgSCN. Следовательно:
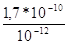
[Cl — ]/[SCN — ] = ПPAgC/ ПPAgSCN = = 170
т.е. равновесие устанавливается тогда, когда [SCN»] станет в 170 раз меньше [С1 — ]. В момент равновесия:
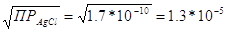
[Сl — ] = моль/л
Следовательно, в точке эквивалентности при избытке SCN — и установившемся равновесии [SCN — ] = 1,3*10 -5: 170 = 8*10 -8 моль/л.
Таким образом, равновесие установится тогда, когда практически весь избыток SCN – вступит в реакцию двойного обмена с AgCl. Поэтому конечную точку титрования трудно заметить, так как появившееся розово-красное окрашивание, вызываемое образованием Fe(SCN)3, быстро исчезает вследствие обменной реакции:
Обнаружение хлоридов нитратом серебра
Fe(SCN)3 + 3AgCl → Fe 3+ + ЗСl — + 3AgSCN
Для предупреждения этой реакции применяют различные способы. Наиболее эффективно отделение осадка AgCl фильтрованием. При этом С1 — ионы осаждают избытком раствора AgNO3 в мерной колбе, доводят объем раствора до метки, смесь взбалтывают 5–10 мин и отфильтровывают по частям через сухой фильтр. Первые порции фильтрата отбрасывают. Аликвотные части фильтрата (25 мл из 250 мл) титруют роданидом.
Для проведения анализа по методу Фольгарда, берут 100 см 3 раствора. Титрованные растворы нитрата серебра и роданида аммония помещают в две различные бюретки. Отбирают из мерной колбы в коническую колбу аликвотное количество раствора, добавляют 2 капли азотной кислоты, 1 мл раствора индикатора и прибавляют отмеренный избыток раствора нитрата серебра (50 мл). Затем приступают к титрованию полученной смеси титрованным раствором роданида аммония до появления красного окрашивания раствора. Определение повторяют до тех пор, пока результаты трех титрований будут расходиться не более чем на 0,05 мл.
В случае необходимости выпавший осадок отфильтровывают или добавляют в анализируемый раствор бензол и ведут определение, как указано выше.
При известном навыке определение не занимает много времени и приводит к достаточно точным результатам.
Источник: kazedu.com
Анализ лекарственной формы
Цель работы: поиск оптимальных методов анализа лекарственных веществ при их совместном присутствии.
Задачи:
изучение лекарственных веществ;
проведение качественного анализа веществ при их совместном присутствии;
проведение количественного анализа веществ при их совместном присутствии;
проведение количественного анализа лекарственной формы.
Введение 3
Глава 1. Изучение свойств лекарственных веществ 5
1.1. Анализ калия бромида. 7
1.2. Анализ кальция хлорида. 9
1.3. Калия йодид 10
Глава 2. Анализ лекарственных веществ при совместном присутствии лекарственных веществ 13
Нормы допустимых отклонений 17
Контроль при отпуске лекарственной формы 17
Заключение 19
Список литературы 21
Прикрепленные файлы: 1 файл
Предложить план анализа лекарственной формы
Кальция хлорид 5,0
Калия бромид 3,0
Воды дистиллированной 100,0
Студентка V курса
Введение
Физико-химические методы анализа многокомпонентных лекарственных форм позволяют анализировать двух и трехкомпонентные смеси без предварительного разрушения с достаточной точностью. Используют те же методы с определенными модификациями, что и для анализа индивидуальных лекарственных веществ. Количественный анализ лекарственных веществ в многокомпонентных смесях может быть выполнен без разделения компонентов смеси или после предварительного разделения.
Качественный анализ лекарственных форм, содержащих различные лекарственные вещества затруднен из-за того что один ингредиент может мешать обнаружению другого или реактив одновременно реагирует с несколькими компонентами.
Количественный анализ без разделения компонентов смеси можно выполнить при использовании титриметрических методов, основанных на различии свойств веществ (кислотно-основных, произведения растворимости, констант комплексообразования) содержащихся в смеси. Применяют методы, основанные на свойствах, присущих только данному веществу. Расчет проводят по разности между количеством миллилитров титрантов затраченных на первое и второе титрование. Анализ лекарственных смесей без разделения составляющих их ингредиентов является более предпочтительным, так как при этом сокращается потери анализируемых веществ, уменьшается число операций, время анализа и расход реагентов.
Цель работы: поиск оптимальных методов анализа лекарственных веществ при их совместном присутствии.
- изучение лекарственных веществ;
- проведение качественного анализа веществ при их совместном присутствии;
- проведение количественного анализа веществ при их совместном присутствии;
- проведение количественного анализа лекарственной формы.
Глава 1. Изучение свойств лекарственных веществ
Дана лекарственная форма следующего состава:
Кальция хлорид 5,0
Калия бромида 3,0
Воды дистиллированной 100,0
1. Rp.: Calcia chloride 5,0
Kalii iodide 2,0
Kalii bromidi 3,0
Aqua distillatae 100,0
Согласно приказу МЗ РФ № 214 «О контроле качества лекарственных средств, изготовляемых в аптеках» (ГФ X) данная лекарственная форма должна обязательно подвергаться письменному, органолептическому контролю, контролю при отпуске.
Письменный контроль заключается в заполнении ППК (паспорта письменного контроля). Заполненный паспорт остается и хранится 2 месяца. Лицевая сторона паспорта заполняется по памяти на латинском языке сразу после изготовления лекарственной формы.
Органолептический контроль заключается в проверке внешнего вида лекарственной формы, ее цвета, прозрачности, отсутствию механических включений.
Данная лекарственная форма должна быть бесцветной и прозрачной, не должно быть механических примесей.
Физический контроль заключается в проверке общего объема лекарственной формы. Результаты проверки фиксируют в соответствующем журнале (приложение 2 к приказу МЗ РФ № 214).
Химический контроль заключается в оценке качества изготовления лекарственного средства по показателям «Подлинность» и «Количественное определение» лекарственных веществ, входящих в его состав. Результаты проверки фиксируют в соответствующем журнале.
Контроль при отпуске заключается в проверке соответствия упаковки лекарственного средства физико-химическим свойствам входящих в его состав лекарственных веществ; указанных в рецепте доз возрасту больного; номера квитанции, рецепта и этикетки на склянке; фамилии больного на рецепте, квитанции и этикетке; оформления лекарственного средства действующим требованиям.
1.1. Анализ калия бромида.
По физическим свойствам препарат представляет собой белое или бесцветное кристаллическое вещество без запаха, соленого вкуса, легко растворимое в воде. Раствор препарата должен быть прозрачным и бесцветным.
Для определения содержания ионов калия к 2 мл раствора соли калия прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл 95% спирта и встряхивают. Постепенно выпадает белый кристаллический осадок. Осадок растворяется в разведенных минеральных кислотах и растворах едких щелочей.
К 2 мл раствора соли калия прибавляют 0,5 мл разведенной уксусной кислоты и 0,5 мл раствора кобальтинитрита натрия. Образуется желтый кристаллический осадок.
Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло — в пурпурно-красный.
Галогенид-ион можно обнаружить осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуются труднорастворимая соль бромида серебра светло-желтого цвета. AgBr мало растворим в растворе аммиака.
Бромид обнаруживают также с помощью реакций окисления галогенидов до свободных галогенов, используя различные окислители. Образующийся галоген извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения бромид-иона в качестве окислителя используют хлорамин в присутствии соляной кислоты:
Слой хлороформа окрашивается в желто-бурый цвет.
Бромиды можно также обнаружить по реакции с раствором сульфата меди и концентрированной серной кислоты. Появляется черный осадок, который обесцвечивается от нескольких капель воды.
Избыток титранта сразу же взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливается конец титрования.
1 мл 0,1 н. раствора нитрата серебра соответствует 0,0119 г калия бромида, которого в высушенном препарате должно быть не менее 99% и не более 100,6%.
Для количественного определения препаратов галогенидов можно использовать метод ионообменной хроматографии.
Препарат хранят в сухом месте в плотно укупоренных банках, предохраняя от действия света (в склянках оранжевого цвета). Калия бромид отличается меньшей гигроскопичностью, поэтому может содержать лишь до 1% влаги.
1.2. Анализ кальция хлорида.
Кальция хлорид очень легко растворим в воде с образованием растворов нейтральной реакции. Раствор в воде при этом сильно охлаждается. Кальция хлорид хорошо растворяется в этаноле.
Бесцветные кристаллы горького или горько-соленого вкуса, очень гигроскопичные, расплываются на воздухе, переходя при 34 0 С в дигидрат.
Наличие иона кальция устанавливают по окрашиванию бесцветного пламени горелки в кирпично-красный цвет.
По образованию белого осадка при добавлении оксалата аммония к раствору препарата. Осадок растворим в разведенных минеральных кислотах, поэтому реакцию необходимо вести в нейтральной среде или в присутствии уксусной кислоты:
Препарат испытывают также на наличие хлорид-ионов.
Галогенид-ион можно обнаружить осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуются труднорастворимая соль хлорида серебра белого цвета, растворимая в аммиаке.
Количественное определение кальция хлорида выполняют комплексонометрическим методом. Индикатором служит кислотный хром темно-синий, который в эквивалентной точке приобретает сине-фиолетовое окрашивание.
Известны методики определения ионов кальция в хлоридах с применением ионоселективных электродов.
Кальция хлорид можно количественно определить и по аниону аргентометрическим методом:
При хранении необходимо учитывать высокую гигроскопичность кальция хлорида. Поэтому препарат хранят в небольших хорошо укупоренных стеклянных банках с пробками, залитыми парафином, в сухом месте.
1.3. Калия йодид
Бесцветные или белые кристаллы или мелкокристаллический порошок без запаха, солено-горького вкуса. Гигроскопичен. Легко растворим в воде, растворим в этаноле и глицерине.
Для определения содержания ионов калия к 2 мл раствора соли калия прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл 95% спирта и встряхивают. Постепенно выпадает белый кристаллический осадок.
Осадок растворяется в разведенных минеральных кислотах и растворах едких щелочей.
К 2 мл раствора соли калия прибавляют 0,5 мл разведенной уксусной кислоты и 0,5 мл раствора кобальтинитрита натрия. Образуется желтый кристаллический осадок.
Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло — в пурпурно-красный.
Галогенид-ион можно обнаружить осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуются труднорастворимая соль йодида серебра желтого цвета. AgI нерастворим в растворе аммиака.
Йодид обнаруживают также с помощью реакций окисления галогенидов до свободных галогенов, используя различные окислители. Образующийся галоген извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения йодид-иона в качестве окислителя используют хлорамин в присутствии соляной кислоты:
Слой хлороформа окрашивается в фиолетовый цвет.
Йодид-ион окисляют раствором нитрита натрия в кислой среде.
Йодиды под действием концентрированной серной кислоты выделяют фиолетовые пары йода.
Из растворов йодидов при добавлении ацетата свинца выпадает осадок иодида свинца желтого цвета:
Количественное определение йодидов проводят методом Фаянса в уксуснокислой среде, используя в качестве титранта 0,1М раствор нитрата серебра и адсорбционный индикатор — эозинат натрия. После осаждения йодид ионов образующиеся коллоидные частицы иодида серебра от добавления избытка ионов серебра становятся положительно заряженными:
[AgI·I — ] +Ag + → [AgI·Ag + ]
Одновременно с приобретением положительного заряда коллоид притягивает отрицательно заряженный анион индикатора эозината натрия. В эквивалентной точке окраска меняется на розовую из желтой.
По МФ калия иодид определяют прямым аргентометрическим методом в присутствии крахмала и 1 капли йоды в этаноле. Титруют до светло-желтого окрашивания.
Известен способ определения, основанный на окислении йодидов нитритом натрия, он позволяет выполнять определение в присутствии хлоридов, бромидов и различных восстановителей.
Для количественного определения препаратов галогенидов можно использовать метод ионообменной хроматографии.
Препарат хранят в сухом месте в плотно укупоренных банках, предохраняя от действия света (в склянках оранжевого цвета). Калия йодид отличается меньшей гигроскопичностью, поэтому может содержать лишь до 1% влаги.
Глава 2. Анализ лекарственных веществ при совместном присутствии лекарственных веществ
На основании изучения физических свойств ингредиентов можно предположить, что данная лекарственная форма должна представлять собой прозрачный и бесцветный раствор без запаха, солоновато-горького вкуса.
Для качественного анализа представленной лекарственной формы можно использовать все описанные выше реакции. Но наиболее экономичными не требующими разделения ингредиентов, являются следующие реакции:
Проводим реакции подлинности на каждый ингредиент по отдельности:
Источник: www.referat911.ru
ОСОБЕННОСТИ ХИМИЧЕСКОГО КОНТРОЛЯ
Качественный и количественный анализы проводят без предварительного разделения ингредиентов.
Наиболее экспрессным методом определения глюкозы в жидких лекарственных формах является метод рефрактометрии.
ОРГАНОЛЕПТИЧЕСКИЙ КОНТРОЛЬ
Бесцветная прозрачная жидкость, без запаха.
ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ
Магния сульфат
1. К 0,5 мл лекарственной формы прибавляют по 0,3 мл раствора аммония хлорида, натрия фосфата и 0,2 мл раствора аммиака. Образуется белый кристаллический осадок, растворимый в кислоте уксусной разведѐнной (магний).
2. К 0,5 мл лекарственной формы прибавляют 0,3 мл раствора бария хлорида. Образуется белый осадок, нерастворимый в разведѐнных минеральных кислотах (сульфаты).
Осадок не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Магния сульфат. Комплексонометрический метод.К 0,5 мл микстуры прибавляют 20 мл воды, 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси кислотного хром черного специального (или кислотного хром темно-синего) и титруют 0,05 моль/л раствором трилона Б до синего окрашивания.
1 мл 0,05 моль/л раствора трилона Б соответствует 0,01232 г магния сульфата.
Соединения магния количественно определяют прямым комплексонометрическим методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:

Титрант — 0,05 М раствор трилона Б (ЭДТА№2) связывает находящиеся в растворе ионы магния в комплексное соединение:

Поскольку при этом происходит выделение серной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭД-ТА Na2, титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая окраска раствора переходит в синюю окраску свободного индикатора:

Vтеор.=0,06/0,01232=4,87мл/2 (Берём 0,5мл для анализа→2,4мл)
Натрия бромида 6,0
Магния сульфата 6,0
Воды очищенной до 100 мл

Глюкоза.К 0,5 мл лекарственной формы прибавляют 1-2 мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок.
реакция с реактивом Фелинга. Реактив Фелинга получают смешиванием двух растворов: 1) раствор меди (II) сульфата; 2) раствор сегнетовой(сеньетовой) соли и натрия гидроксида. При сливании растворов образуется медный комплекс виннокислого калий-натрия.
Альдегиды при нагревании с реактивом Фелинга, окисляясь, восстанавливают соединения меди (II) до оксида меди (I) в виде кирпично-красного осадка.
Глюкоза.Определение проводят рефрактометрически.

n — показатель преломления анализируемого раствора при 20 0 С;
n0 — показатель преломления воды при 20 0 С;
F — NaBr фактор прироста показателя преломления 1 % раствора натрия бромида, равный 0,00134;
С — NaBr концентрация натрия бромида в растворе, найденная аргентометрическим или меркуриметрическим методом, в %;
F — МgSO4 7Н2О фактор прироста показателя преломления 2,5 % раствора магния сульфата, равный 0,000953;
С — МgSO4 • 7Н2О концентрация магния сульфата в растворе, найденная трилонометрическим методом, в %;
1,11 — коэффициент пересчета на глюкозу, содержащую 1 молекулу кристаллизационной воды;
FБЕЗВ.ГЛЮК. фактор прироста показателя преломления раствора безводной глюкозы, равный 0,00142.
Натрия бромида 1,0
Кофеин-бензоата натрия 0,5
Воды очищенной до 200 мл
Катион натрия (Na + )
1. Окрашивание пламени. При внесении веществ, содержащих ион натрия, в бесцветное пламя горелки или спиртовки, происходит окрашивание пламени в желтый цвет.
2. Микрокристаллическая реакция. При обработке капли раствора вещества, содержащего ион натрия, каплей раствора пикриновой кислоты, образуется осадок в виде игольчатых кристаллов характерной формы, наблюдаемых под микроскопом. Рационально параллельно для сравнения провести реакцию с веществом, заведомо содержащим ион натрия.
Аналогично проводится реакция на катион калия.
1. Реакция, с нитратом серебра
Бромид-ионы образуют с катионами серебра осадок бромида серебра AgBr желтоватого цвета.
Осадок бромида серебра практически нерастворим в воде, в азотной кислоте, в растворе карбоната аммония. Частично растворяется в концентрированном растворе аммиака (но намного меньше, чем хлорид серебра).
2. Реакция с сильными окислителями
В случае брома хлороформный слой окрашивается в желто – бурый цвет
При обнаружения бромид-ионов в качестве окислителя используется хлорамин в присутствии кислоты хлороводородной:
Натрия бромид. Аргентометрический метод (Мора). 2 мл микстуры титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого окрашивания (индикатор – калия хромат).
1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,01029 г натрия бромида.
Этот метод реализуется в нейтральной среде, что является его недостатком и применяется для определения хлоридов и бромидов.
В качестве индикатора используется калия хромат, образующий с избыточной каплей титранта осадок серебра хромата кирпично-красного цвета.
f=1; Mf = M.м. определяемого вещества f;
Расчетная формула прямого титрования:
Метод не реализуется в кислой среде, так как растворяется осадок серебра хромата; в щелочной среде разлагается титрант; в случае определения иодидов образуются коллоидные частицы серебра иодида, обладающие сильными адсорбционными свойствами.
Аотн. = (Хпо проп. – Хпр.) / Хпо проп. (ср. с табл. Пр №214).
30. Проведите анализ анальгинав микстуре:
Метамизола натрия 0,75
Натрия бромида 3,0
Раствора глюкозы 40% — 200 мл
Анальгин.К 1 мл исследуемого раствора прибавляют 1 мл кислоты хлороводородной разведенной и кипятят несколько минут. Влажная фильтровальная бумага, пропитанная раствором йода, обесцвечивается выделяющимися парами сернистого газа.
Метамизол-натрий, в отличие от других производных пиразолона-5 дает положительную реакцию на ион натрия, а при нагревании на водяной бане с минеральными кислотами выделяет диоксид серы и формальдегид, которые обнаруживают по запаху:

После охлаждения прибавляют раствор хлорида железа (III); через 2 мин появляется темно-красное окрашивание.
Если реакцию на метамизол-натрий с минеральными кислотами выполнять в присутствии концентрированной серной и салициловой кислот, то образуется (за счет выделяющегося формальдегида) ауриновый краситель, имеющий интенсивное красное окрашивание. При окислении метамизола-натрия раствором иодата калия в присутствии хлороводородной кислоты раствор приобретает малиновое окрашивание. От избытка реактива окраска усиливается, а затем выделяется бурый осадок иода. Происходит это за счет взаимодействия иодата калия с образующимся при гидролизе метамизола-натрия диоксидом серы:
Раствор феназона в этих условиях остается бесцветным.
Серу в метамизоле-натрия обнаруживают также путем прокаливания в смеси карбонатов натрия и калия в течение 10 мин. Плав охлаждают, растворяют в азотной кислоте и фильтруют. Образовавшиеся сульфат-ионы обнаруживают с помощью раствора хлорида бария.
Йодиметрический метод. 5 мл микстуры титруют 0,1 моль/л раствором йода до слабо-желтого окрашивания (без индикатора).
1 мл 0,1 моль/л раствора йода соответствует 0,01757 г анальгина.
Иодометрическое определение метамизола-натрия выполняют методом прямого титрования иодом в слабокислой водно-спиртовой среде (чтобы подавить диссоциацию образ. Комплекса) (HCl чтобы разложить NaO3S) [до окисления серы (IV) в серу (VI)]:
Конечную точку титрования можно установить по избытку титрованного раствора иода (желтое окрашивание). Взять навеску!

Так как индикатор не используют, то титруют до слабо-жёлтого окрашевания раствора из-за избытка I2.
31. Проведите экспресс-анализ лекарственной формы:
Тиамина бромида 0,002
Кислоты никотиновой 0,001
Раствора натрия хлорида 0,9% — 10,0
Тиамина бромида 0,002
Кислоты никотиновой 0,001
Раствора натрия хлорида 0,9% — 10,0
Источник: allrefrs.ru