Теоретический материал предназначен для обучающихся по специальности 33.02.01 Фармация очной и очно-заочной формы обучения для подготовки к теоретическим, практическим занятиям и выполнения самостоятельной внеаудиторной работы по МДК 02.02 Контроль качества лекарственных форм
Скачать:
| лекарственные вещества первой группы периодической системы элементов Д.И.Менделеева | 46 КБ |
| Теоретическое занятие. Лекарственные препараты 7 группы периодической системы элементов Д.И.Менделеева | 107 КБ |
Предварительный просмотр:
ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Общая характеристика группы.
- Соединения меди и серебра.
- Нитрат серебра.
- Протаргол.
1.Все элементы, составляющие 1 группу периодической системы, имеют на внешнем электронном слое только 1 электрон, который они с легкостью отдают, превращаясь в однозарядные положительные ионы. Этим объясняется их очень высокая реакционная способность по отношению к электроотрицательным элементам, например галогенам.
Кузьмич Е.С. Классификация методов осаждения.
Однако предвнешний слой у элементов 1 группы неодинаков. Этим обусловлёно различие в их свойствах и необходимость деления 1 группы элементов на две подгруппы главную и побочную. Главная подгруппа включает литий, натрий, калий, рубидий, цезий и франций. Все они содержат на предвнешнем слое 8 электронов. Побочную группу составляют медь, серебро и золото.
Предвнешний электронный слой этих элементов состоит из 18 электронов. Некоторые электроны этого слоя могут переходить на внешний слой и принимать участие в химических реакциях. Это обусловливает переменную степень окисленности элементов этой подгруппы.
Элементы главной подгруппы носят название щелочных металлов, так как их оксиды при взаимодействии с водой образуют сильные гидроксиды. Щелочные металлы обладают резко выраженными металлическими свойствами, что связано с легкой отдачей внешнего электрона. для Щелочных металлов очень характерна легкость, с которой возбуждается световое излучение их атомов. Так, при внесении соединения щелочного металла в пламя горелки пламя окрашивается в характерный для данного металла цвет.
Соли щелочных металлов находят применение в медицине. Наиболее широко применяются в медицине соли натрия.
2.СОЕДИНЕНИЯ МЕДИ И СЕРЕБРА
Побочную подгруппу элементов 1 группы составляют медь, серебро и золото. Эти элементы сходны с элементами главной подгруппы тем, что они в некоторых своих соединениях имеют степень окисления + 1. Однако медь в большинстве своих соединений имеет степень окисления +2.
Другая особенность элементов побочной подгруппы в отличие от щелочных металлов главной подгруппы — их высокая склонность к комплексообразованию, особенно меди, а также способность восстанавливаться из соединений до свободного металла; при этом легче восстанавливается серебро, чем медь.
Из неорганических соединений меди в медицине находит применение меди сульфат. При приеме внутрь он оказывает рвотное действие; в качестве наружного средства применяется при катарах слизистых оболочек и язвах благодаря вяжущему, раздражающему и прижигающему действию.
Делаем нитрат серебра. Чистый.
Серебро относится к «благородным» металлам. В природе оно встречается главным образом в виде соединений с серой Аg 2 S. В чистом виде сульфид серебра почти не встречается, а чаще бывает в смеси с сульфидами других тяжелых металлов, особенно свинца, меди, висмута. И, поскольку препараты серебра получают из природных минералов, следует проводить испытание на возможное присутствие этих примесей.
Применение препаратов серебра в медицине основано на его бактерицидных свойствах. Это свойство серебра использовали еще в Древнем Египте, когда при лечении ран на их поверхность накладывали серебряные пластинки. Вода, хранившаяся некоторое время в серебряных сосудах, может долгое время оставаться свежей. Своеобразное стерилизующее действие оказывает даже та весьма малая концентрация ионов Аg, которая создается в воде при соприкосновении с серебром.
Исследованиями доказано, что ионы серебра губительно действуют на грамположительные и грамотрицательные бактерии, а также вирусы. В нашей стране академиком А. А. Кульским был разработан электролитический метод приготовления серебряной воды (обогащение воды серебром при помощи электролиза).
Препараты серебра применяются в медицине внутрь и наружно как вяжущие, антисептические и прижигающие средства при лечении кожных, урологических и глазных болезней.
Из соединений серебра наибольшее применение получил серебра нитрат (АgNO 3 ), как хорошее вяжущее и прижигающее средство. В медицине применяются также коллоидные препараты серебра, где серебро связано с белком и только частично ионизировано. В коллоидных препаратах серебра сохраняются лишь дезинфицирующие свойства серебра и пропадает его прижигающее действие.
Все растворимые соединения меди и серебра ядовиты.
3.Серебра нитрат, Argenti nitras, АgNO 3.
Получение. Нитрат серебра получают путем растворения медно-серебряного сплава в азотной кислоте при нагревании. Чтобы очистить полученный нитрат серебра от примесей, его осаждают хлороводородной кислотой в виде хлорида серебра. Последний восста навливают цинком, и серебро, освобожденное от примесей, снова растворяют в азотной кислоте:
АgСu+4НNO3→ АgNO3+Сu(NO3) 2 +NО+2Н 2 О
АgNO 3 +НС1→АgС1+НNO 3
АgС1+Zn+Н 2 SО 4 → Аg+ ZnSО 4 +2НС1
Аg+4НNO 3 →2Аg+NО+2НС1
Полученный нитрат серебра обрабатывают небольшим количеством воды, при стоянии из раствора выристаллизовываются кристаллы. Выделенные кристаллы отфильтровывают, промывают водой и высушивают в темноте.
Физические свойства: бесцветные прозрачные кристаллы в виде пластинок или цилиндрических палочек лучистокристаллического строения в изломе. На свету кристаллы темнеют.
Растворимость: легко растворим в воде, трудно в этаноле.
- по катиону:
- при добавлении к препарату хлороводородной кислоты или ее солей выпадает белый осадок хлорида серебра, нерастворимый в азотной кислоте и хорошо растворимый в растворе аммиака (ГФ):
АgNO 3 +НС1 → АgС1+НNO 3
- к аммиачному раствору оксида серебра добавляют раствор формальдегида и жидкость нагревают. Через некоторое время на стенках сосуда образуется налет металлического серебра в виде зеркала (ГФ):
2АgNO 3 +2NН 4 ОН→ Аg 2 О+ NН 4 NО 3 + Н 2 О
Н 2 С=О+Аg 2 О→2Аg+НСООН
- Кроме этих реакций, для обнаружения катиона серебра можно использовать реакцию с хроматом калия, при этом выпадает осадок хромата серебра коричневато-красного цвета:
2АgNO 3 +К 2 СrО 4 → Аg 2 СrО 4 +2КNО 3
Осадок растворим в азотной кислоте, гидроксиде аммония и трудно растворим в уксусной кислоте.
- по аниону. Нитрат-ион определяется с дифениламином (синее окрашивание) и по образованию бурого кольца при взаимодействии нитрата серебра с сульфатом железа (II) в концентрированной серной кислоте:
Испытание на чистоту . Доброкачественность пре парата характеризуется допустимым пределом кислот ности и отсутствием солей тяжелых металлов (свинца, меди, висмута).
Количественное определение содержания вещества в препарате проводится методом осаждения по Фольгарду. Рабочий раствор — роданид аммония.
ГФ требует содержания чистого серебра нитрата в препарате не менее 99,75 %.
Применение серебра нитрата в медицине основано на его антисептическом и прижигающем действии. Последнее обусловлено способностью серебра нитрата свертывать белки, превращая их в нерастворимые соединения, что используется для прижигания ран н язв. В небольших концентрациях серебра нитрат оказывает вяжущее и протавовоспалительное действие.
Применяют наружно при эрозиях, язвах, при остром конъюнктивите, трахоме в виде 2, 5, 10 % водных растворов, а также мазей (1—2 %). Внутрь назначают в виде 0,05—0,06 % раствора при язвенной болезни желудка, хроническом гастрите.
Высшая разовая доза для взрослых внутрь 0,03 г, высшая суточная — 0,1 г.
Хранение . Все соли серебра ядовиты и относятся списку А. Хранить следует под замком в хорошо укупоренных банках из оранжевого стекла с притертыми пробками в защищенном от света месте.
4. Протаргол, Protargolum.
Физические свойства: коричнево-желтый порошок или коричневый легкий порошок без запаха, слабо горького вкуса. Гигроскопичен.
Растворимость: легко в воде, практически не растворим в спирте, эфире, хлороформе.
Подлинность: водный раствор препарата дает светло-желтую опалесценцию, при взаимодействии с сульфатом меди в щелочной среде образуется фиолетовое окрашивание.
Доброкачественность: не допустимы примеси аммиака, посторонних соединений серебра.
Количественное определение: роданометрия.
Применение: в качестве вяжущего, антисептического и противовоспалительного средства наружно при воспалительных заболеваниях слизистых оболочек верхних дыхательных путей, мочевыводящих путей, конъюнктивитах.
Хранение: в хорошо укупоренных банках желтого стекла, в защищенном от света месте.
1. Чем объясняется высокая реакционная способность элеменов 1 группы периодической системы элементов по отношению к электроотрицательным элементам?
2. На каких свойствах основано применение препаратов серебра в медицине?
З. Почему серебра нитрат следует хранить в склянках из оранжевого стекла и в защищенном от света месте?
Источник: nsportal.ru
Количественное определение лекарственных форм, содержащих галогениды щелочных металлов
Основан на свойстве галогенидов количественно осаждаться серебра нитратом с образованием малорастворимых галогенидов серебра.
а) метод Мора. Метод прямого титрования хлоридов или бромидов нитратом серебра в нейтральной или слабощелочной среде. Индикатор — хромат калия.
ГФ X предлагает использовать этот вариант для количественного определения следующих лекарственных веществ: натрия хлорид (NaCl); калия хлорид (КС1); натрия бромид (NaBr); калия бромид (KBr).
2) KCl + AgNO3 → AgCl↓ + KNO3
3)NaBr + AgNO3→ AgBr↓ + NaNO3 fэкв = 1
При одной избыточной капле титранта образуется оранжево-желтый осадок. В кислой среде понижается чувствительность индикатора, за счет растворимости осадка хромата серебра, а в сильно щелочной разрушается титрант с образованием оксида серебра. Метод нельзя применять для определения йодидов, так как йодид серебра в нейтральной среде адсорбирует на поверхности йодид-ионы.
б) метод Фаянса. Метод прямого титрования нитратом серебра в слабокислой среде в присутствии адсорбционных индикаторов. Адсорбционные индикаторы являются солями слабых кислот и обладают способностью адсорбироваться на частицах осадка. При титровании нитратом серебра образуется осадок галогенида серебра, который адсорбирует галогениды, находящиеся в избытке.
В точке эквивалентности, когда все галогениды будут связаны, частицы теряют заряд. Наблюдается коагуляция при введении незначительного избытка нитрата серебра, частицы заряжаются положительно и притягивают анион индикатора, осадок приобретает соответствующее окрашивание. Метод Фаянса является фармакопейным для йодидов натрия и калия.
KI + AgNO3→AgI↓ + KNO3
Титрование проводят в уксусной среде, индикатор — эозинат натрия, титруют до розового окрашивания осадка. Этот индикатор можно использовать для количественного определения йодидов. Определение бромидов и хлоридов проводят в присутствии индикатора бромфенолового синего в уксуснокислой среде. В точке эквивалентности наблюдается переход окраски от зеленовато-желтой до фиолетовой. Эозинат натрия не используется для количественного определения хлоридов, так как анион эозина в самом начале титрования вытесняет хлориды из осадка и розовая окраска наступает от первой капли титрованного раствора.
в) метод Фольгарда. Вариант обратного титрования с использованием двух титрованных растворов — серебра нитрата и аммония тиоцианата.
Определение проводят в азотнокислой среде во избежание гидролиза индикатора, индикатор — железо-аммониевые квасцы. Метод используется для определения бромидов, йодидов, реже хлоридов, входящих в состав лекарственных форм. К раствору галогенида добавляют титрованный раствор серебра нитрата, избыток которого оттитровывают раствором аммония тиоцианата в присутствии железо-аммониевых квасцов до розового окрашивания.
Индикатор – FeNH4(SO4)2 • 12Н2О-железо-аммониевые квасцы.
Источник: mydocx.ru
АНАЛИЗ РАСТВОРА НАТРИЯ БРОМИДА, ПРИГОТОВЛЕННОГО ПО ИНДИВИДУАЛЬНОМУ РЕЦЕПТУ
Бесцветная прозрачная жидкость без запаха соленого вкуса нейтральной реакции среды.
Определение подлинности
К 0,5 мл раствора добавляют 3 капли уксусной кислоты и 5 капель раствора цинк-уранил-ацетета. Образуется желтый кристаллический осадок.
а) К 1-2 каплям раствора бромида натрия на часовом (предметном) стекле прибавляют 1 -2 капли раствора нитрата серебра. Образуется желтоватый осадок, трудно растворимый в растворе аммиака.
NaBr + AgNO3 —> AgBr↓ + NaNO3 бл.-желт.
б) К 0,5 мл раствора натрия бромида добавляют по 0,5 мл хлороформа, кислоты хлористоводородной и несколько капель раствора белильной (хлорной) извести или раствора хлорамина, взбалтывают. Хлороформный слой окрашивается в желто-оранжевый цвет.
Количественное определение
1. Аргентометрия no Мору
1 мл раствора натрия бромида помешают в склянку для титрования, добавляют 5-7 капель раствора хромата калия и титруют 0,1 моль/л раствором нитрата серебра до оранжево-желтого цвета.
NaBr + AgN03 —> AgBr↓ + NaNO3
1. Аргентометрия по Фаянсу с применением поверхностно действующего индикатора бромфенолового синего.
1 мл препарата помещают в склянку для титрования, добавляют 2 -3 капли раствора бромфенолового синего, по каплям разведенную уксусную кислоту до получения зеленовато-желтого окрашивания (-3 капли) и титруют 0,1 моль/л раствором нитрата серебра до сине-фиолетового окрашивания осадка.
1. Меркуриметрический метод
1 мл препарата помещают в склянку для титрования, добавляют 3 капли раствора дифенилкарбазона, 3 капли разведенной азотной кислоты и титруют 0,1 моль/л раствором нитрата окисной ртути до фиолетового окрашивания.
Моль/л
1 мл 0,1 моль/л раствора нитрата серебра или 0,1 моль/л раствора нитрата окисной ртути соответствует 0,01029 г натрия бромида.
Расчеты при титриметрическом титровании
Расчет ориентировочного объёма титранта определяется делением массы анализируемого вещества, находящемся в анализируемой навеске на титр, т.е.
V= m | T V = 0,02 | 0,01029 = 1,94 мл
допуст. отк. для 2,0 составляют ± 5 % (приказ М3 РФ № 305)
АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ РАСТВОРА НАТРИЯ БРОМИДА, ИЗГОТОВЛЕННОГО ПО ИНДИВИДУАЛЬНОМУ РЕЦЕПТУ
1. Работа с рецептом
• бланк формы 107У
• штамп ЛПУ, личная печать и подпись врача, срок действия рецепта 60 дней
• назначение врача: по 1 ст. л. 3 раза в день после еды
1. Письменный контроль
Aquae purificatae 100 ml
Natrii bromidi 2,0
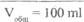
1. Органолептический контроль
• бесцветная прозрачная жидкость без запаха и механических включений.
1. Физический контроль (выборочно)
Проверка герметичности укупорки.
1. Химический контроль (выборочно)
Качественный химический контроль:
• доказательство наличия Вг —
• аргентометрия. mr = 2,0
• Оформление результатов анализа
— заполнить «Журнал регистрации результатов органолептического, физического и химического контроля .
Контроль при отпуске
— В соответствии с физико-химическими свойствами отпускается в герметически укупоренном флаконе;
• основная этикетка «Внутреннее», дополнительная «Беречь от детей»;
• на этикетке указаны номер и место нахождения аптеки, номер рецепта, фамилия и возраст больного, назначение врача, дата изготовления, цена, срок годности;
• номер и фамилия больного на рецепте соответствуют номеру и фамилии на этикетке;
• поставить подпись на обратной стороне рецепта (лицо, отпустившее лекарственное средство).
ЗАНЯТИЕ 3
Дата добавления: 2018-08-06 ; просмотров: 14358 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net