Настоящая общая фармакопейная статья предназначена для определения хлоридов методом обратного осадительного титрования в биологических лекарственных препаратах (БЛП) и их растворителях, не содержащих другие галогениды (иодиды, фториды, бромиды), окислители или соли ртути. Методы осадительного титрования основаны на реакциях осаждения определяемого компонента титрантом — раствором, образующим осадок с определяемыми компонентами.
Для проведения реакции осаждения при титриметрическом анализе необходимо соблюдение следующих условий:
1) осадок должен быть практически нерастворим;
2) выпадение осадка должно происходить достаточно быстро;
3) результаты титрования не должны искажаться явлениями адсорбции (соосаждения);
4) при титровании должна фиксироваться точка эквивалентности.
Ионы хлора (Cl — ) определяют тиоцианометрическим (роданометрическим, аргентометрическим) методом по Фольгарду (обратное титрование). В качестве титранта используют стандартный раствор аммония тиоцианата (аммония роданида) NH4SCN, в качестве индикатора для определения точки эквивалентности — насыщенный раствор квасцов железоаммонийных (NH4Fe(SO4)2·12H2O).
Сущность метода обратного титрования по Фольгарду заключается в следующем: при добавлении к раствору, содержащему ионы хлора, избытка титрованного раствора серебра нитрата (AgNO3) образуется осадок серебра хлорида (AgCl). Избыток серебра нитрата оттитровывают раствором аммония тиоцианата с образованием практически нерастворимого осадка серебра роданида (AgSCN) в присутствии индикатора — квасцов железоаммонийных. В точке эквивалентности ионы железа (III) взаимодействуют с тиоцианат-ионами (SCN — ), образуя растворимое комплексное соединение темно-красного цвета.
Процесс обратного титрования (по методу Фольгарда) протекает по следующей схеме реакций:
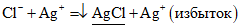
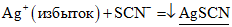
Fe 3+ + 3 SCN — = [Fe(SCN)3]
Определение хлоридов в лекарственных средствах
В коническую колбу вместимостью 50 — 100 мл вносят точный объем образца (А), содержащий 0,3 — 1,5 мг хлор-ионов, что при пересчете соответствует 0,5 — 2,5 мг натрия хлорида, прибавляют 8 — 10 мл воды очищенной, 5 мл (точный объем) 0,01 М раствора серебра нитрата, 1,0 мл азотной кислоты концентрированной и перемешивают. Содержимое колбы нагревают, доводят до кипения, и осторожно по каплям прибавляют насыщенный раствор калия перманганата, не допуская вспенивания и выплескивания, до получения фиолетово-коричневого окрашивания, не исчезающего в течение 5 мин выдерживания колбы при температуре кипения. К горячему испытуемому раствору на конце шпателя прибавляют глюкозу (40 — 140 мг) до исчезновения окраски.
Пробы охлаждают до комнатной температуры, прибавляют 0,5 мл насыщенного раствора квасцов железоаммонийных и при непрерывном перемешивании избыток 0,01 М раствора серебра нитрата медленно титруют 0,01 М раствором аммония тиоцианата до появления отчетливой светлой коричневато-оранжевой окраски.
Получение реактива на золото. В домашних условиях легко!
Параллельно проводят контрольный опыт с пробой, не содержащей испытуемый образец (А).
Количество ионов Cl — , вступивших в реакцию с AgNO3, определяют по разнице объемов 0,01 М раствора NH4SCN, пошедшего на титрование контрольного и анализируемого растворов.
Содержание хлоридов (X) в процентах вычисляют по формуле:
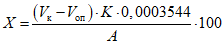
,
где: Vк — объем 0,01 М раствора аммония тиоцианата, пошедший на титрование контрольного раствора, мл;
Vоп — объем 0,01 М раствора аммония тиоцианата, пошедший на титрование испытуемого раствора, мл;
A — объем испытуемого раствора, взятого на анализ, мл;
K — поправочный коэффициент к молярности аммония тиоцианата;
0,0003544 — титр по хлор-иону — количество хлоридов в г, соответствующее 1 мл 0,01 М раствора аммония тиоцианата;
( для пересчета на натрия хлорид используют значение титра по натрия хлориду — 0,0005844, г/мл);
100 — коэффициент пересчета в проценты.
Приготовление испытуемого раствора — указывают в фармакопейной статье или нормативной документации.
Приготовление 0,1 М титрованного раствора серебра нитрата. В мерной колбе вместимостью 1000 мл растворяют в воде очищенной 17 г серебра нитрата, доводят объем раствора тем же растворителем до метки и перемешивают.
Около 0,15 г (точная навеска) натрия хлорида, прокаленного при температуре 250 — 300 °C до постоянной массы, растворяют в 50 мл воды очищенной, добавляют 1,0 мл 5% раствора калия хромата (K2CrO4) и титруют приготовленным раствором серебра нитрата до появления слабой красновато-оранжевой окраски, не исчезающей при перемешивании.
Молярность (M) приготовленного раствора серебра нитрата проверяют по формуле:
M = a/0,05844·V,
где: a — навеска натрия хлорида, г;
0,05844 — количество натрия хлорида, соответствующее 1 мл 1 М раствора натрия хлорида, г/мл;
V — объем раствора серебра нитрата, пошедший на титрование навески натрия хлорида, мл.
При несоответствии заданной молярности раствор укрепляют или разводят до 0,1 М, повторно проверяя титр раствора.
Раствор хранят в склянке из темного стекла с притертой пробкой в защищенном от света месте при комнатной температуре.
Приготовление 0,01 М раствора серебра нитрата. В мерную колбу вместимостью 50 мл вносят 5 мл 0,1 М титрованного раствора серебра нитрата, доводят объем раствора водой очищенной до метки и перемешивают. Раствор готовят перед использованием.
Приготовление 0,1 М титрованного раствора аммония тиоцианата. В мерной колбе вместимостью 1000 мл в воде очищенной растворяют 7,6 — 8,0 г аммония тиоцианата, доводят объем раствора тем же растворителем до метки и перемешивают.
Титр аммония тиоцианата устанавливают по 0,1 М раствору серебра нитрата. К 20 мл 0,1 М раствора серебра нитрата прибавляют 25 мл воды очищенной, 0,5 мл азотной кислоты концентрированной, 1 мл насыщенного раствора квасцов железоаммонийных и титруют приготовленным раствором аммония тиоцианата до появления светлой жидкости коричневато-оранжевого цвета. Молярность раствора аммония тиоцианата вычисляют по формуле:
где: M0 — молярность 0,1 М раствора серебра нитрата, г;
V0 — объем 0,1 М раствора серебра нитрата, мл;
V — объем 0,1 М раствора аммония тиоцианата, мл.
После определения титра раствор укрепляют или разводят до 0,1 М раствора, повторно проверяя титр.
Возможно приготовление 0,1 М раствора аммония тиоцианата из стандарт-титра в ампуле (фиксанала) согласно инструкции по применению.
Приготовление 0,01 М раствора аммония тиоцианата. В мерную колбу вместимостью 50 мл вносят 5 мл 0,1 М раствора аммония тиоцианата, доводят объем раствора водой очищенной до метки и тщательно перемешивают. Раствор готовят перед использованием.
Приготовление насыщенного раствора квасцов железоаммонийных. В 100 мл воды очищенной растворяют 40 г квасцов железоаммонийных, фильтруют, добавляют 16% раствор азотной кислоты до перехода коричневой окраски в желтовато-зеленую. Раствор хранят во флаконе из темного стекла в защищенном от света месте при комнатной температуре.
Определение поправочного коэффициента к молярности аммония тиоцианата. Поправочный коэффициент определяют как отношение теоретически заданного объема титранта (5 мл) к его объему в контрольном эксперименте (5/Vк). Показатель поправочного коэффициента должен находиться в пределах (1 +/- 0,02).
Источник: e-ecolog.ru
Количественное определение аргентометрия
Аргентометрический метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
MeHal + AgNO3 → AgHal↓+ MeNO3 F (ЛВ) =1 Метод является фармакопейным и используется в экспресс-анализе Для количественного определения натрия и калия галогенидов в ЛП используются варианты метода: Вариант Мора (прямое титрование); индикатор — калия хромат. Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0. Натрия хлорид, калия хлорид, натрия бромид, калия бромид. NaCI + AgNO3 → AgCI↓ + NaNO3 NaBr + AgNO3 → AgBr↓+ NaNO3 Реакция индикации: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3 коричневато- красный, оранжево-красный (оранжево-желтый ГФ Х) ОсадокAg2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимостиAgCI↓ иAgBr↓.Роль рН среды:А) В кислой среде рН, т.к. в кислой среде хромат-ион CrO4 2- переходит в дихроматCr2O7 2 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7 — (равновесие реакции диссоциации CrO4 2- смещено вправо) 2CrO4 + 2H + ↔ 2HCrO4 — ↔ Cr2O7 2- + Н2O Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду AgNO3 +OH — → AgOH↓ + NO3 — 2 AgOH→ Ag2O + H2O Натрия йодид и калия йодидметодом Моране определяют, т.к. 1) йодиды адсорбируются на осадкеAgI, окраска появиться до точки эквивалентности (заниженные результаты), 2) окраска осадков серебра йодида и серебра хромата близка по цвету. Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды. Вариант Фаянса (прямое титрование).Титрант: раствор серебра нитрата. Индикаторы — адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI. Натрия йодид, калия йодид; Титрант: раствор серебра нитрата. индикатор — натрия эозинат. Среда — уксуснокислая (разбавленная CH3COOH). а) NaInd ←→ Ind — + Na + Эозинат натрия б) NaI + AgNO3→ AgI↓ + NaNO3 в) Ind — + AgI↓ + AgNO3 → [(AgI)Ag + ]Ind — ↓ + NO 3- Изб.капля Розовый осадок В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I — . Будет формироваться коллоидная частица AgI·nI-·nК+ Ионы индикатора в этот момент не адсорбируются, а остаются в растворе. В т.э. после полного осаждения йод-ионовI — в избытке Аg + осадок будет адсорбировать Аg + и знак заряда частиц осадка будет меняться на положительный AgI·nAg+ Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение AgI·nAg+·nInd- (от розового в растворе до розового на осадке). Т.о. титрование заканчивается при образовании розового осадка. На точность фиксации т.э. влияет:
(ЛВ) =1 Метод является фармакопейным и используется в экспресс-анализе Для количественного определения натрия и калия галогенидов в ЛП используются варианты метода: Вариант Мора (прямое титрование); индикатор — калия хромат. Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0. Натрия хлорид, калия хлорид, натрия бромид, калия бромид. NaCI + AgNO3 → AgCI↓ + NaNO3 NaBr + AgNO3 → AgBr↓+ NaNO3 Реакция индикации: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3 коричневато- красный, оранжево-красный (оранжево-желтый ГФ Х) ОсадокAg2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимостиAgCI↓ иAgBr↓.Роль рН среды:А) В кислой среде рН, т.к. в кислой среде хромат-ион CrO4 2- переходит в дихроматCr2O7 2 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7 — (равновесие реакции диссоциации CrO4 2- смещено вправо) 2CrO4 + 2H + ↔ 2HCrO4 — ↔ Cr2O7 2- + Н2O Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду AgNO3 +OH — → AgOH↓ + NO3 — 2 AgOH→ Ag2O + H2O Натрия йодид и калия йодидметодом Моране определяют, т.к. 1) йодиды адсорбируются на осадкеAgI, окраска появиться до точки эквивалентности (заниженные результаты), 2) окраска осадков серебра йодида и серебра хромата близка по цвету. Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды. Вариант Фаянса (прямое титрование).Титрант: раствор серебра нитрата. Индикаторы — адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI. Натрия йодид, калия йодид; Титрант: раствор серебра нитрата. индикатор — натрия эозинат. Среда — уксуснокислая (разбавленная CH3COOH). а) NaInd ←→ Ind — + Na + Эозинат натрия б) NaI + AgNO3→ AgI↓ + NaNO3 в) Ind — + AgI↓ + AgNO3 → [(AgI)Ag + ]Ind — ↓ + NO 3- Изб.капля Розовый осадок В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I — . Будет формироваться коллоидная частица AgI·nI-·nК+ Ионы индикатора в этот момент не адсорбируются, а остаются в растворе. В т.э. после полного осаждения йод-ионовI — в избытке Аg + осадок будет адсорбировать Аg + и знак заряда частиц осадка будет меняться на положительный AgI·nAg+ Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение AgI·nAg+·nInd- (от розового в растворе до розового на осадке). Т.о. титрование заканчивается при образовании розового осадка. На точность фиксации т.э. влияет:
- величина рН. Адсорбционные индикаторы являются слабыми протолитами, поэтому титрование при определенном значении рН в уксуснокислой среде
- концентрация раствора. С ↑ площади поверхности осадка — ↑ количество адсорбированных молекул индикатора и более резкое изменение окраски в т.э. При увеличении концентрации иодид-ионов в растворе повышается точность.
- посторонние ионы. Адсорбционные индикаторы чувствительны к значению ионизации посторонних ионов в растворе. Это учитывается при определении йодидов в многокомпонентных смесях.
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин — прокаин). 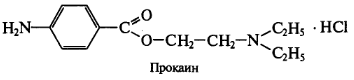 Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности. R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор — железоаммонийные квасцы. NaCI +AgNO3(избыток) → AgCI↓ + NaNO3 AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3 Реакция индикации NH4SCN +NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O красное окр. Вариант Кольтгофа (прямое титрование). Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaCI, KCI, CaCl2, NaBr, KBr).Титрант: раствор серебра нитрата. Индикатор: йодкрахмальный — 1 капля раствора калия йодата (0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания. Уравнение индикации KIO3 + 5KI + 3H2SO4→3I2+ 3K2SO4 + ЗН2O I2 + KI + крахмал синее окрашивание По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом: KI + AgNO3 → Agl↓+ KNO3 В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора. Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПРAgI = 1,5 • 10 -16 ; ПР AgBr = 4,4 • 10 -13 ; ПР AgCI = 1,8· 10 -10 ). Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат — дорогостоящий реактив, поэтому метод не экономичен. 2.Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (П). Применяют для всех галогенидов натрия и калия. Титранты — легко ионизированные соли ртути (II): ртути (II) нитрат -Hg(NO3)2, ртути (II) перхлорат — Hg(CIO4)2. Среда: азотнокислая. Индикатор: дифенилкарбазон. 2MeHal + Hg(NO3)2 → HgHal2 + 2MeN03 F
Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности. R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор — железоаммонийные квасцы. NaCI +AgNO3(избыток) → AgCI↓ + NaNO3 AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3 Реакция индикации NH4SCN +NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O красное окр. Вариант Кольтгофа (прямое титрование). Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaCI, KCI, CaCl2, NaBr, KBr).Титрант: раствор серебра нитрата. Индикатор: йодкрахмальный — 1 капля раствора калия йодата (0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания. Уравнение индикации KIO3 + 5KI + 3H2SO4→3I2+ 3K2SO4 + ЗН2O I2 + KI + крахмал синее окрашивание По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом: KI + AgNO3 → Agl↓+ KNO3 В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора. Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПРAgI = 1,5 • 10 -16 ; ПР AgBr = 4,4 • 10 -13 ; ПР AgCI = 1,8· 10 -10 ). Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат — дорогостоящий реактив, поэтому метод не экономичен. 2.Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (П). Применяют для всех галогенидов натрия и калия. Титранты — легко ионизированные соли ртути (II): ртути (II) нитрат -Hg(NO3)2, ртути (II) перхлорат — Hg(CIO4)2. Среда: азотнокислая. Индикатор: дифенилкарбазон. 2MeHal + Hg(NO3)2 → HgHal2 + 2MeN03 F
 Светло-сиреневое окрашивание. Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов. Титрант: ртути (И) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2] 2KI + Hg(ClO4)2→ HgI2 + 2КСlO4 Спирт: вода (1:1) F
Светло-сиреневое окрашивание. Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов. Титрант: ртути (И) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2] 2KI + Hg(ClO4)2→ HgI2 + 2КСlO4 Спирт: вода (1:1) F (ЛВ) =1 3.Броматометрический метод. Используется в анализе йодидов калия и натрия. Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида: 6KI + KBrO3 + 6HCI → 3I2 + 6КС1 + KBr + ЗН2O 3I2 + KBrO3 + 6HCI → 6ICI + KBr + ЗН2O Суммарное уравнение: 6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6Н2O Уравнение после сокращения коэффициентов: 3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3Н2O F
(ЛВ) =1 3.Броматометрический метод. Используется в анализе йодидов калия и натрия. Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида: 6KI + KBrO3 + 6HCI → 3I2 + 6КС1 + KBr + ЗН2O 3I2 + KBrO3 + 6HCI → 6ICI + KBr + ЗН2O Суммарное уравнение: 6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6Н2O Уравнение после сокращения коэффициентов: 3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3Н2O F (MeI) =1/2 I
(MeI) =1/2 I -2ē → I +
-2ē → I +
Ограничение
Для продолжения скачивания необходимо пройти капчу:
Источник: studfile.net
Способ определения серебра
Изобретение относится к области аналитической химии элементов, а именно к методам определения серебра, и может быть использовано при определении серебра в природных водах и технологических растворах. Способ определения серебра включает приготовление раствора серебра (1), переведение его в комплексное соединение и измерение интенсивности люминесценции. Серебро выделяют из растворов силикагелем, химически модифицированным меркаптогруппами, и измеряют интенсивность люминесценции комплекса серебра (1) с меркаптогруппами на поверхности силикагеля при 77К при облучении ультрафиолетовым светом. Техническим результатом является упрощение методики, снижение относительного предела обнаружения и расширение диапазона определяемых концентраций.
Изобретение относится к области аналитической химии элементов, а именно к методам определения серебра, и может быть использовано при определении серебра в природных водах и технологических растворах.
Для определения серебра в объектах различного вещественного состава используется простой в аппаратурном оформлении, достаточно чувствительный и селективный люминесцентный метод.
Известен способ флуориметрического определения серебра, основанный на образовании флуоресцирующего ассоциата между иодидным комплексным анионом серебра и катионом красителя бриллиантового зеленого [Kobasakalis Vassilioss. Fluorimetric determination of silver with brilliant green in aqueous systems and its application in photographic fixing solutions // Anal. Lett. 1994. V.27. №14. P.2789-2796].
Способ предусматривает выполнение следующих операций: к раствору, содержащему ионы серебра, добавляют H2SO4 или NaOH до рН 3, прибавляют 1 мл KJ (5 г/л) и 0,75 мл J2 (1 г/л), разбавляют водой до 50 мл, выдерживают 10 мин и измеряют интенсивность флуоресценции при длинах волн возбуждения и испускания 256 нм и 521 нм соответственно.
К недостаткам способа можно отнести многостадийность, использование разнообразных реактивов.
Наиболее близким к предлагаемому способу по технической сущности и достигаемым результатам является способ определения серебра [Oue M., Kimura К., Shono Т. Extraction-spectrofluorimetric determination of silver ion using benzothiacrown ether and eosin. //Analyst. 1988. V.113. №4. P.551-553].
Способ основан на использовании ион-парной системы, включающей бензатиакраунэфир (I) (2,3-бензо-7,10,13-тритиа-1,4-диоксациклопентадека-2-ен) в качестве лиганда и эозин (II) (2,4,5,7-тетрабромфлуоресцеин) в качестве флуоресцирующего иона. К раствору пробы, содержащей 1-20 мкг серебра, прибавляют 0,1 мл 9,24·10 -4 М раствора I, 1,8 мл боратно-фосфатного раствора с рН 8,6 и 3 мл воды, экстрагируют 5 мл 5·10 -6 М раствором II в дихлорэтане. Экстракт отделяют и определяют интенсивность флуоресценции при длинах волн возбуждения и излучения 536 нм и 558,8 нм соответственно. Градуировочный график линеен в диапазоне концентраций серебра 2-15 нг/мл.
Техническим результатом является упрощение методики, снижение относительного предела обнаружения, расширение диапазона определяемых концентраций.
Указанный технический результат достигается тем, что в способе определения серебра, включающем приготовление раствора серебра (I), переведение его в комплексное соединение и измерение интенсивности люминесценции, новым является то, что серебро выделяют из растворов силикагелем, химически модифицированным меркаптогруппами, и измеряют интенсивность люминесценции комплекса серебра (I) с меркаптогруппами на поверхности силикагеля при 77К при облучении ультрафиолетовым светом.
В исследуемый раствор с рН 2-7, содержащий серебро, вносят сорбент — силикагель, химически модифицированный меркаптогруппами, интенсивно перемешивают в течение 5 мин, растворы декантируют, сорбент помещают в стальную кювету, охлаждают до температуры жидкого азота и измеряют интенсивность люминесценции при 560 нм.
Сущность способа заключается в том, что находящееся в растворе серебро в широком диапазоне рН 2-7 количественно извлекается силикагелем, химически модифицированным меркаптогруппами. В процессе сорбции серебра на поверхности сорбента образуются комплексные соединения серебра с меркаптогруппами, ковалентно закрепленными на поверхности силикагеля. Данные поверхностные комплексы, охлажденные до температуры жидкого азота (77К), обладают интенсивной люминесценцией при их облучении ультрафиолетовым светом.
Сорбция в статическом режиме протекает быстро (время установления сорбционного равновесия составляет 2-3 мин) и количественно (коэффициент распределения достигает 1·10 4 см 3 /г), что позволяет сконцентрировать и полностью извлечь серебро даже из очень разбавленных растворов в динамическом режиме. Предел обнаружения серебра при навеске сорбента 0,1 г составляет 0,5 мкг. Относительный предел обнаружения серебра при использовании 10 мл раствора составляет 0,05 мкг/мл.
Пример 1 (прототип). В градуированную пробирку вводят раствор, содержащий 2 мкг серебра, прибавляют 0,1 мл 9,24·10 -4 М раствора II, 1,8 мл боратно-фосфатного раствора с рН 8,6 и 3 мл воды, экстрагируют 5 мл 5·10 -6 М раствором I в дихлорэтане. Органическую фазу отделяют, переносят в кювету и измеряют интенсивность люминесценции при 558,8 нм. Количество серебра находят по градуировочному графику. Найдено 1,40±0,08 мкг.
Пример 2 (предлагаемый способ). К раствору, содержащему серебро в количестве 1,0 мкг в 10 мл, прибавляют 0,1 г сорбента — силикагеля, химически модифицированного меркаптогруппами, перемешивают в течение 5 мин, раствор декантируют, сорбент переносят в кювету, охлаждают до температуры жидкого азота и измеряют интенсивность люминесценции при 560 нм. Количество серебра находят по градуировочному графику. Найдено 1,0±0,2 мкг.
Пример 3 (предлагаемый способ). 1 л раствора, содержащий 1 мкг серебра, пропускают через хроматографическую колонку, содержащую 0,1 г сорбента, со скоростью 1 мл/мин, промывают водой. Сорбент вынимают из колонки, переносят в кювету, охлаждают до температуры жидкого азота и измеряют интенсивность люминесценции при 560 нм. Содержание серебра находят по градуировочному графику. Найдено 0,95±0,05 мкг.
Таким образом, предлагаемый способ позволяет определять серебро в количестве 0,1-100 мкг при использовании 0,1 г сорбента. Способ характеризуется простотой выполнения и не требует использования дорогостоящего оборудования. Получаемые сорбаты устойчивы длительное время без изменения их спектрально-люминесцентных характеристик.
Способ определения серебра, включающий приготовление раствора серебра (1), переведение его в комплексное соединение и измерение интенсивности люминесценции, отличающийся тем, что серебро выделяют из растворов силикагелем, химически модифицированным меркаптогруппами, и измеряют интенсивность люминесценции комплекса серебра (I) с меркаптогруппами на поверхности силикагеля при 77К при облучении ультрафиолетовым светом.
Похожие патенты:
Изобретение относится к аналитической химии (индикаторным составам) и может быть использовано для определения молибдена (VI) в водных растворах, в частности в природных и сточных водах.
Изобретение относится к фармацевтической химии, в частности к способу идентификации изониазида, производного пиридина, используемому для контроля качества продукции, выпускаемой фармацевтическими производствами и изготавливаемой аптеками.

Изобретение относится к области поиска новых аналитических реагентов, а именно к области синтеза соединений, используемых для обнаружения катионов металлов s-, p- и d-элементов.

Изобретение относится к областям аналитической и экологической химии и может быть использовано для определения микроконцентраций сурьмы в природных водах для экологического мониторинга.


Изобретение относится к пищевой и фармацевтической промышленности и может быть использовано: в оценке качества лекарственных средств и биологически активных добавок к пище, обладающих антиоксидантными свойствами; в выборе оптимальных технологических режимов при выделении природных жирорастворимых антиоксидантов; в поиске эффективной системы антиоксидантов-синергистов.

Изобретение относится к области фармацевтической и аналитической химии и может быть использовано для определения папаверина, димедрола и других алкалоидов в лекарственных формах.

Изобретение относится к методам аналитического определения щелочей, щелочных солей и других веществ, имеющих щелочную реакцию и реагирующих с кислотами, а именно к методу тирования, используемого как в учебном процессе, так и на производстве.

Изобретение относится к аналитической химии, а именно к составам водочувствительных паст, и может быть использовано для определения границы раздела между нефтепродуктами или маслами и водой в резервуарах, цистернах, танкерах, отстойных очистительных сооружениях заводов и фабрик, где необходимо регулярно контролировать уровень нефтепродуктов, масел и воды.

Изобретение относится к области определения остаточного содержания дезинфицирующего средства в воде, в частности к водному раствору азокрасителя для указанной цели.

Изобретение относится к области лазерной техники и оптоэлектроники и может быть использовано в физической измерительной аппаратуре, лазерной локации и в системах лазерной космической связи для высокоточного и оперативного измерения характеристик лазерных сред, входящих в состав лазерных генераторов и лазерных усилителей оптических сигналов.

Изобретение относится к бесконтактным оптическим способам измерения основных частотных характеристик малогабаритных и легких механических конструкций. .

Изобретение относится к оптическим способам и средствам анализа газообразных систем. .

Изобретение относится к методам оперативного измерения малых концентраций азота (20. 500 ррм) и кислорода (5. 50 ррм) в смесях газов азота, кислорода и гелия. .

Изобретение относится к области технической физики. .

Изобретение относится к области анализа материалов, а именно к способам определения примесей в соединениях урана, способных образовывать летучие фториды. .


Изобретение относится к аналитической химии и может быть использовано для определения золота (III) во вторичном сырье (электронном ломе), в природном сырье и в технологических растворах.

Изобретение относится к области эмиссионного спектрального анализа. .
Изобретение относится к переработке и утилизации твердых радиоактивных отходов предприятий атомной промышленности. .
Источник: findpatent.ru