Для комплексных соединений характерна первичная и вторичная диссоциация.
Первичная диссоциация комплексных соединений на комплексный ион и противоположно заряженные ионы внешней сферы протекает полностью, как у сильных электролитов.
Поэтому, соединения, содержащие комплексные ионы, могут вступать в реакции обмена с электролитами с образованием малорастворимых веществ.
Однако, в отличие от “простых” ионов, комплексные ионы сами способны к диссоциации, которая называется вторичной диссоциацией. Она характеризует диссоциацию самого комплексного иона и протекает ступенчато, как у слабых электролитов, подчиняясь закону действия масс. Количественно каждая ступень характеризуется константой диссоциации.
| Кд (I) |
[AgNH3] + [NH3]
| Кд(II) = |
[Ag + ] [NH3]
В целом устойчивость комплексного иона в растворе характеризуется величиной константы нестойкости Кн , которая равна произведению констант диссоциации отдельных ступеней.
Комплексные соединения. 1 часть. 11 класс.
Общая константа нестойкости Кн является константой равновесия полной диссоциации комплекса:
| [Ag+] [NH3]2 |
| [Ag(NH3)2]+ |
Кн =
Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплексные соединения, в частности соли, очень сходны с двойными солями. Подобно комплексным, двойные соли также образуются путем соединения простых солей
Отличаются комплексные соли от двойных прежде всего величиной константы нестойкости: у типичных двойных солей константа нестойкости очень велика, у типичных комплексных солей она, наоборот, очень мала. Резкой границы между двойными и комплексными солями не существует.
Двойные соли диссоциируют на те ионы, которые находились в растворах простых солей, послуживших для их образования, например,
KCl∙ MgCl2 K + +Mg 2+ +3Cl —
Двойные соли можно рассматривать как комплексные соли с малоустойчивой, легко диссоциирующей на ионы внутренней координационной сферой.
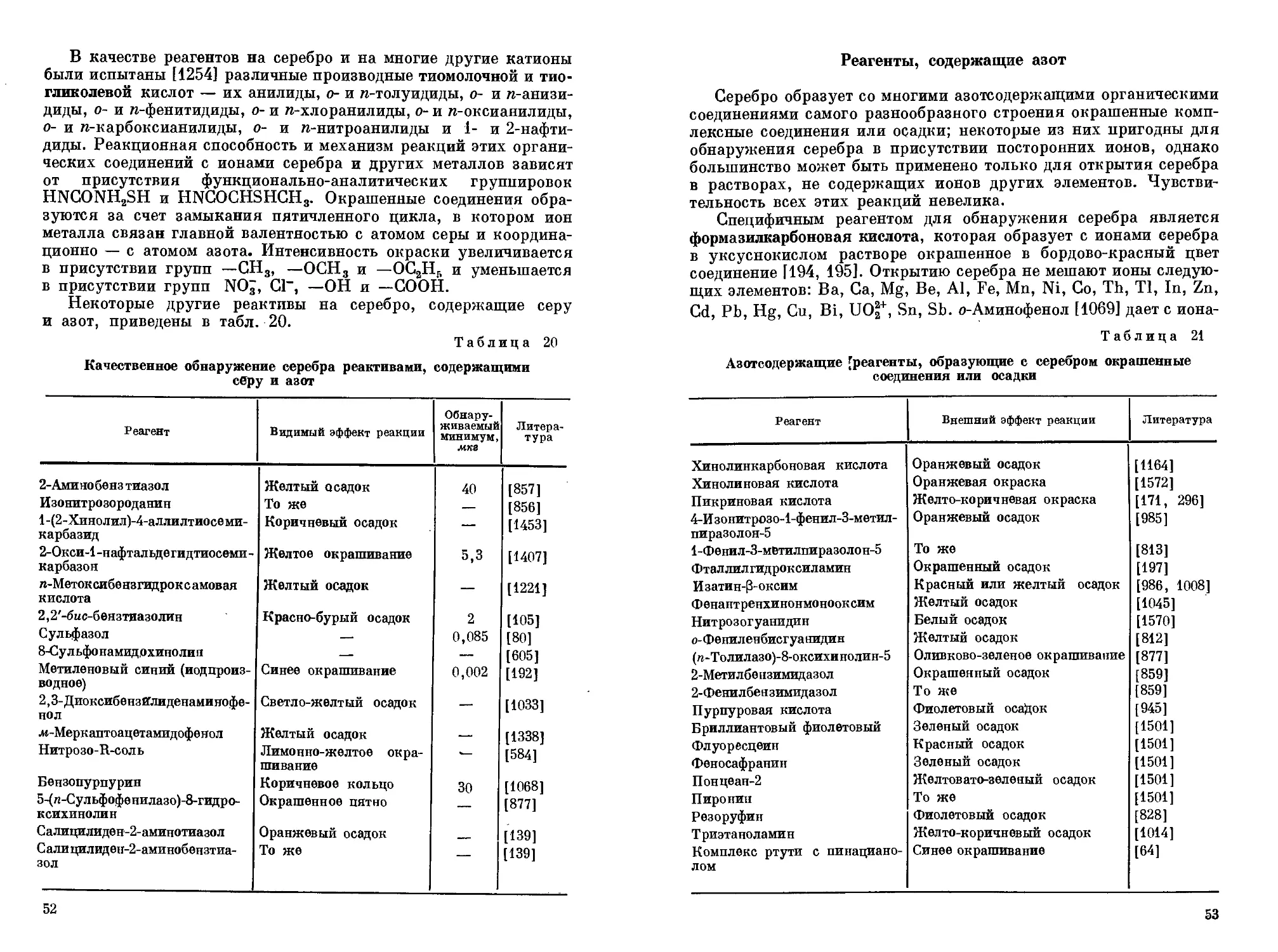
Получение и разрушение комплексных соединений.
Образование и разрушение комплекса объясняется смещением равновесия его диссоциации и объясняется принципом Ле Шателье. Равновесие диссоциации иона [Ag(NH3)2] + = Ag + + 2NH3 смещается в сторону образования комплекса (влево) при увеличении концентрации ионов Ag+ и NH3. При этом образуются соединения, в которых центральный атом или лиганд связаны более прочно, чем в исходном комплексе. Многие комплексные соединения хорошо растворимы в воде, поэтому комплексообразование используется для перевода в раствор труднорастворимых соединений.
Хлорид серебра растворяется в избытке цианида калия:
AgCl + 2KCN = K[Ag(CN)2] + KCl
AgCl + 2CN — = [Ag(CN)2] — + Cl —
Это связано с тем, что ион серебра в ионе [Ag(CN)2] — связан более прочно, чем в AgCl.
AgCl = Cl — + Ag + + 2CN = [Ag(CN)2] — + Cl —
Комплексные соли | ЕГЭ по химии | Екатерина Строганова
При добавлении азотной кислоты к [Ni(NH3)6]Cl2 происходит разрушение комплекса, о чём свидетельствует изменения окраски раствора. Это связано с образованием катиона аммония, в котором аммиак связан с катионом водорода более прочно, чем с катионом никеля.
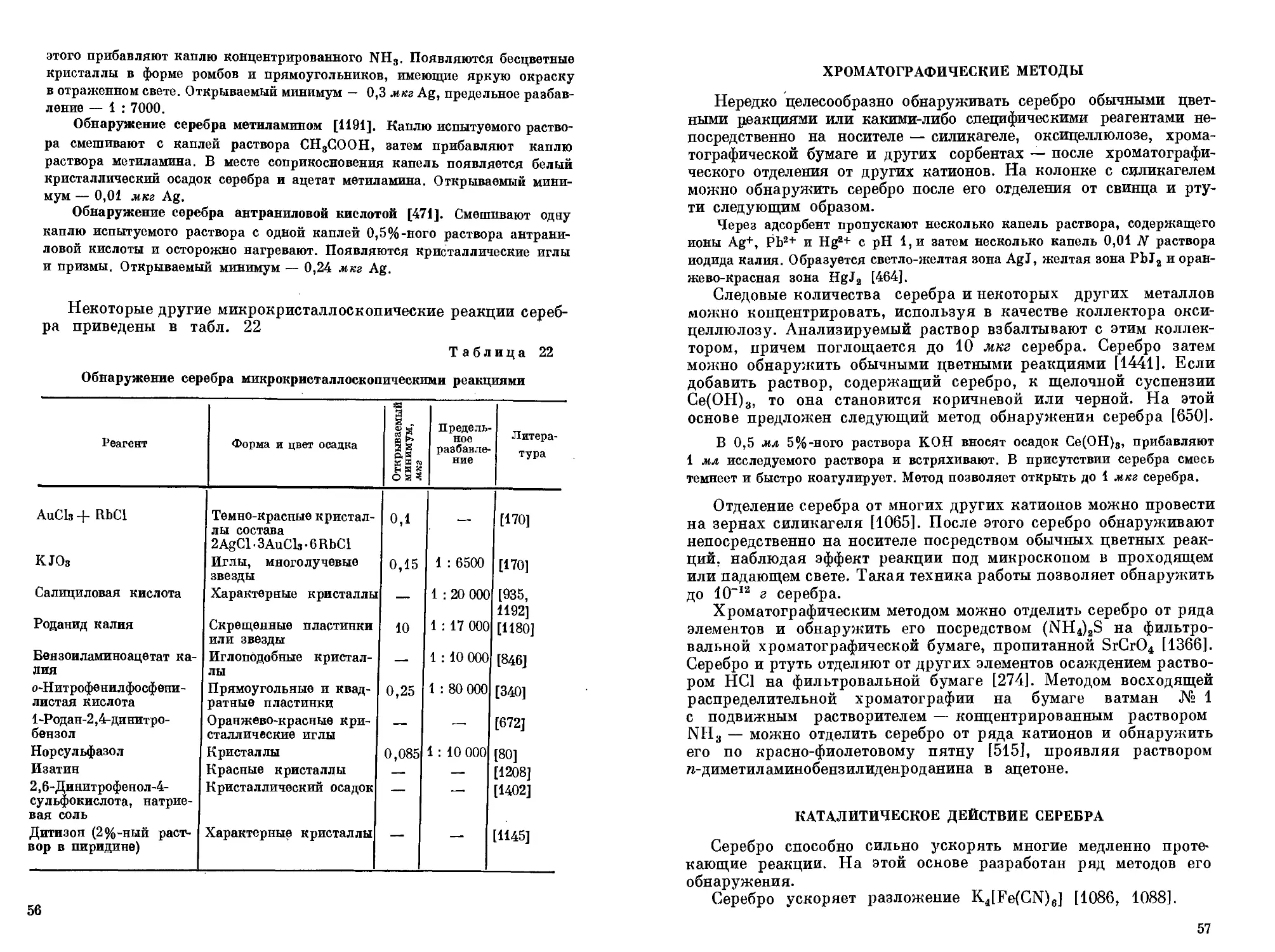
Окислительно-восстановительные реакции с участием комплексных соединений.
Комплексные соединения могут участвовать в окислительно-восстановительных реакциях. При этом изменяется степень окисления центрального атома.
Возможны реакции двух типов:
а) Изменение степени окисления без разрушения комплекса
б) Изменение степени окисления с разрушением комплекса в результате восстановления центрального иона до металла
Обработка результатов
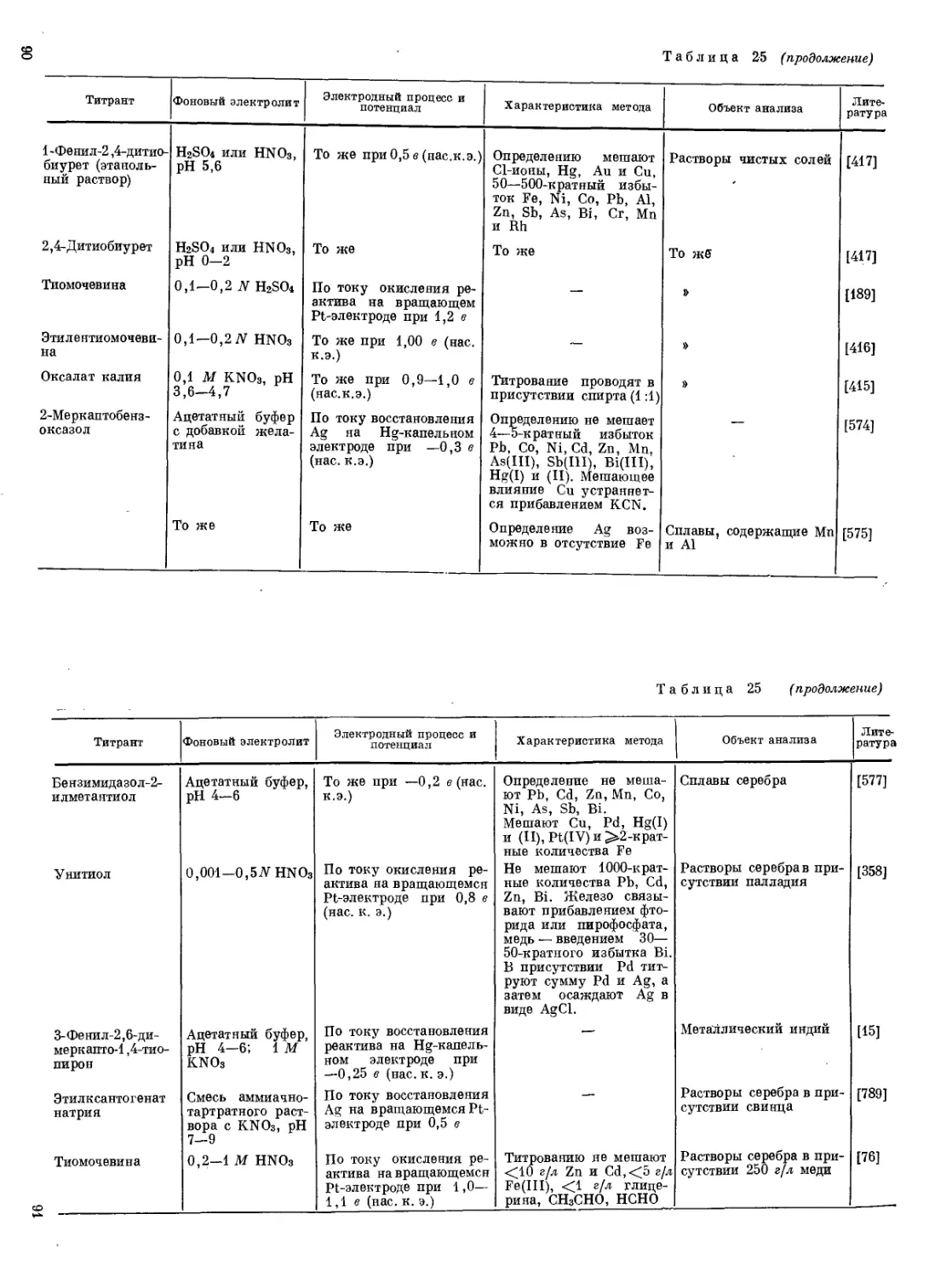
Различие между двойной и комплексной солью
Fe 3+ +3Cl — +6K + +6CNS — = 3K + + [Fe(CNS)6] 3- + 3K + +3Cl —
2Fe 3+ + 12CNS — = 2[Fe(CNS)6] 3-
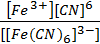
Кн= — гексацианоферрат(III) калия

Кн= — гексатиоцианатоферрат(III) калия
Вывод: Реакция между гексацианоферратом калия (III) и роданидом калия не идет, так как комплекс гексацианоферрата достаточно прочный, а роданид реагирует со свободными ионами Fe(3+), образуя соединение кроваво-красного цвета. Поэтому можно сделать вывод, что гексацианоферрат калия – это комплексная соль, а (NH4)2SO4•Fe2(SO4)3 — двойная.
Образование и разрушение комплексных ионов
Источник: lektsia.com
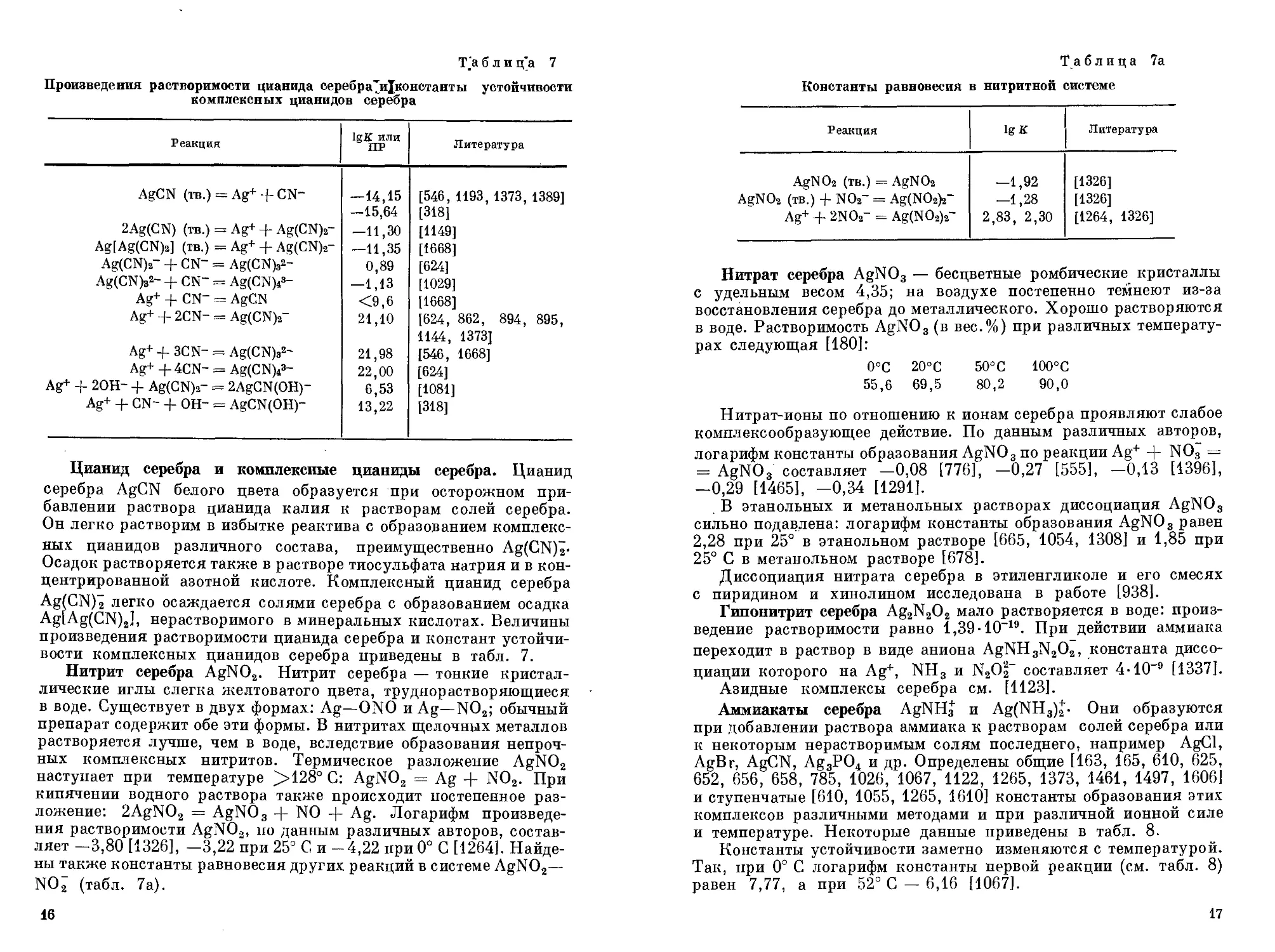
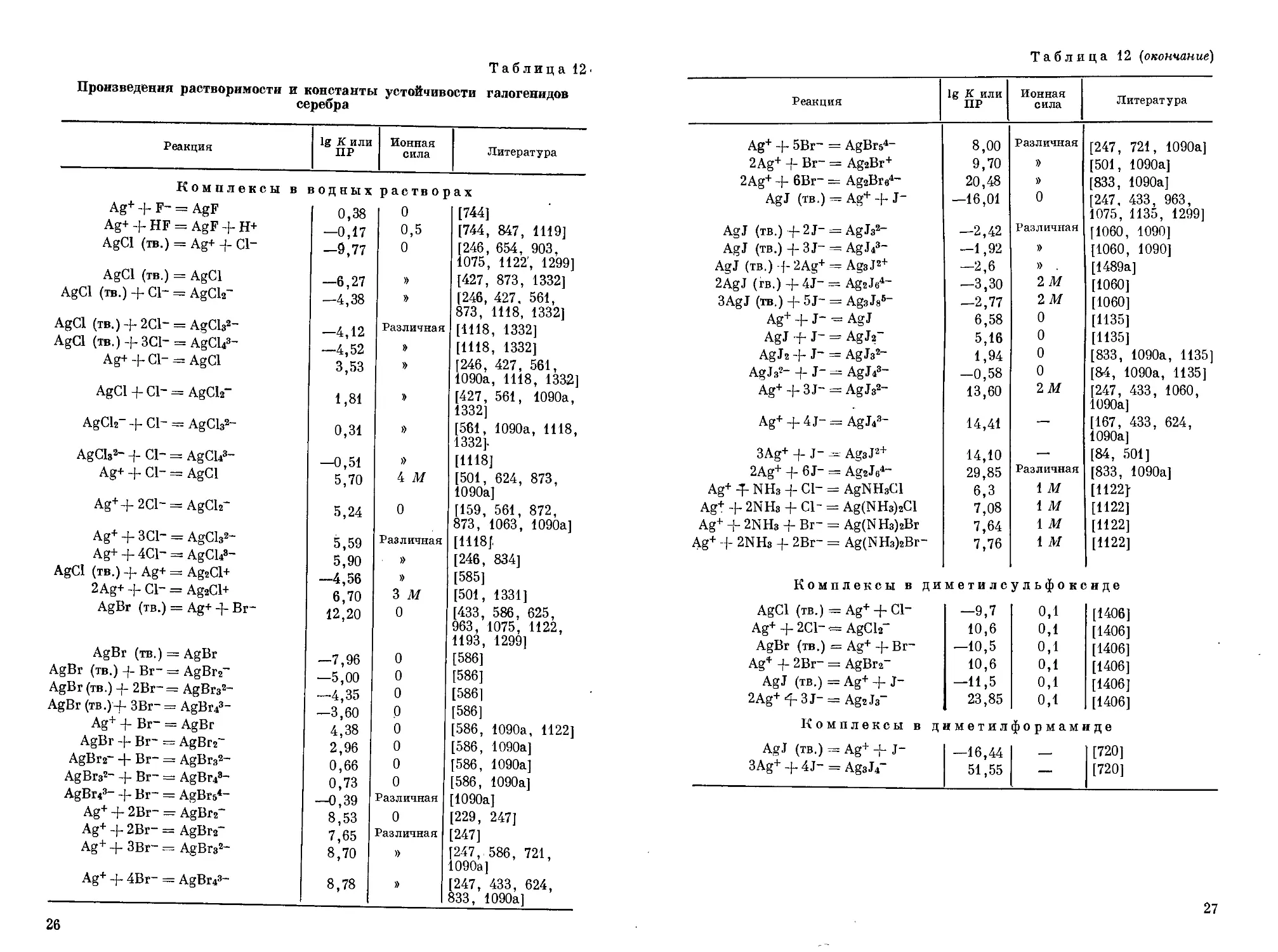
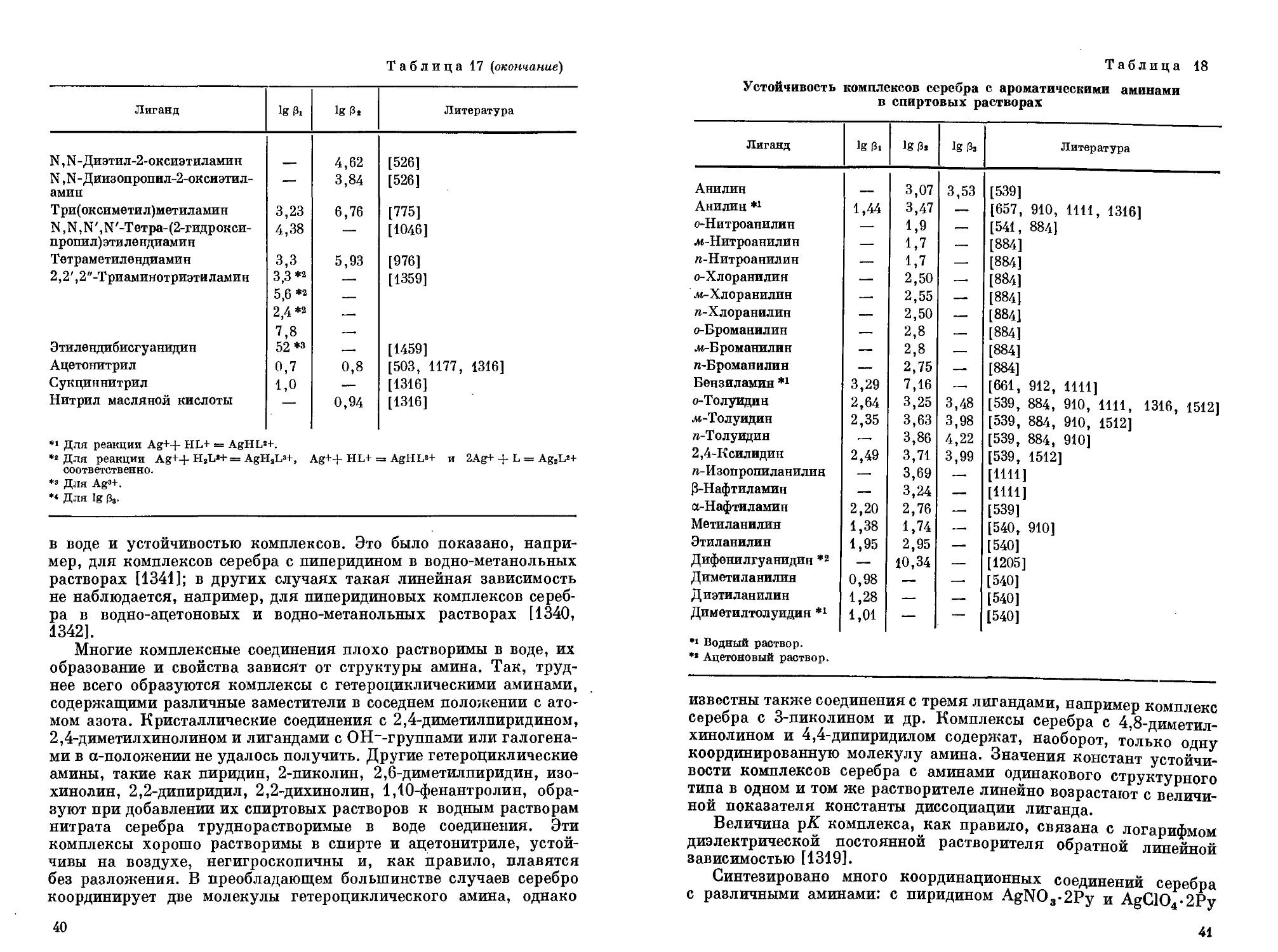
Комплексные соли серебра свойства






















































































































Download Close
Year: 1975




Источник: djvu.online
Биологическая роль d-элементов в организме и применение их соединений в медицине , страница 2
ОПЫТ. Поместить в пробирку 3-5 капель капель раствора соли Cu 2+ и прибавить несколько капель раствора NH4OH (разбавленного) до появления голубого осадка. Растворить осадок в избытке NH4OH. Что наблюдается?
РЕАКЦИИ ИОНОВ СЕРЕБРА (Ag + )
Соляная кислота и растворы ее солей (т.е. хлорид-ионы Cl — ) образуют с растворами солей Ag + практически нерастворимый в воде белый осадок хлорида серебра AgCl, который хорошо растворяется в избытке раствора NH4OH. При этом образуется растворимая в воде комплексная соль серебра-хлорид диамминсеребра [Ag(NH3)2]Cl. При действии азотной кислоты комплексный ион разрушается и хлорид серебра выпадает в осадок. Эти свойства солей серебра используются для его обнаружения:
ОПЫТ. В пробирку поместить 2-3 капли раствора соли Ag + и прибавить 2-3 капли раствора HCl. Прозрачную жидкость слить с осадка и растворить его в растворе аммиака. К полученному прозрачному раствору прибавить раствор HNO3. Что наблюдается?
Ионы d-элементов II группы
Элементы Zn, Cd, Hg проявляют в своих соединениях степень окисления +2.
РЕАКЦИИ ИОНОВ ЦИНКА (Zn 2+ )
1. Растворы гидроксидов щелочных металлов (NaOH, KOH) осаждают из водных растворов солей Zn 2+ осадок гидроксида цинка Zn(OH)2 белого цвета, проявляющий амфотерные свойства. В избытке щелочи осадок растворяется с образованием бесцветного раствора комплексной соли тетрагидроксоцинката натрия Na2[Zn(OH)4]:
ZnCl2 + 2 NaOH = Zn(OH)2 ↓ + 2 NaCl
ОПЫТ. В пробирку поместить 3-5 капель раствора соли Zn 2+ и добавить 1-2 капли раствора NaOH до образования осадка. Испытать растворимость осадка в HCl и в избытке NaOH. Что наблюдается?
2. Гексацианоферрат (II) калия образует с растворами солей Zn 2+ белый осадок гексацианоферрата (II) калия-цинка K2Zn3[Fe(CN)6]2:
ОПЫТ. В пробирку поместить 3-5 капель раствора соли Zn 2+ и добавить 2-3 капли раствора соли K4[Fe(CN)6]. Что наблюдается?
РЕАКЦИИ ИОНОВ РТУТИ (Hg 2+ )
1. Растворы гидроксидов щелочных металлов (NaOH, KOH) осаждают из водных растворов солей Hg 2+ желтый осадок оксида ртути (II) HgO, так как гидроксид ртути (II) Hg(OH)2 неустойчив:
ОПЫТ. В пробирку поместить 3-5 капель раствора соли Hg 2+ (соли Hg 2+ ядовиты!) и добавить 2-3 капли раствора NaOH. Что наблюдается?
2. Раствор иодида калия KI образует с растворами солей Hg 2+ ярко-красный осадок иодида ртути (II) HgI2, растворимый в избытке реактива с образованием бесцветного комплексного иона тетраиодомеркурат (II) [HgI4] 2- .
ОПЫТ. К 4-5 каплям раствора соли Hg 2+ прибавляем сначала 1-2 капли раствора соли KI, а затем избыток его. Что наблюдается? Написать уравнение:
Ионы d-элементов YI группы
РЕАКЦИИ ИОНОВ ХРОМА (Cr 3+ )
1. Гидроксиды щелочных металлов (NaOH,KOH) осаждают из растворов солей Cr 3+ (сине-зеленый цвет) гидроксид хрома Cr(OH)3 серо-зеленого цвета, обладающий амфотерными свойствами:
CrCl3 + 3 NaOH = Cr(OH)3 ↓ + 3 NaCl
Избыток NaOH растворяет осадок с образованием изумрудно-зеленого раствора комплексной соли гексагидроксохромата (III) натрия:
ОПЫТ. В пробирку поместить 3-5 капель раствора соли Cr 3+ и 1-2 капли 2 н. раствора гидроксида натрия. Полученный осадок разделить на 2 части, испытать растворимость Cr(OH)3 в кислоте HCl и в избытке гидроксида натрия NaOH. Что наблюдается?
2. Пероксид водорода Н2О2 в щелочной среде окисляет ионы Cr 3+ в хромат-ионы CrO4 2- желтого цвета:
ОПЫТ. В пробирку поместить 2-3 капли раствора соли Cr 3+ , прибавить столько же 2 н. раствора NaOH до образования осадка Cr(OH)3, а затем избыток NaOH. К изумрудно-зеленому раствору образовавшегося Na3[Cr(OH)6] прибавить 3-5 капель 3%-ного раствора Н2О2 до образования раствора желтого цвета. Расставить коэффици-
енты, используя ионно-электронный метод.
Ионы d-элементов YII группы
РЕАКЦИИ ИОНОВ МАРГАНЦА (Mn 2+ )
1. Растворы гидроксидов щелочных металлов (NaOH, KOH) образуют с растворами солей Mn 2+ (растворы солей Mn 2+ имеют бледно-розовый цвет) белый осадок гидроксида марганца (II) Mn(OH)2, растворимый в кислотах, но нерастворимый в щелочах:
MnCl2 + 2 NaOH = Mn(OH)2 ↓ + 2 NaCl
Источник: vunivere.ru