Кре́мний(лат. Silicium), Si, химический элемент IV группы короткой формы (14-й группы длинной формы) периодической системы ; атомный номер 14, атомная масса 28,0855 а. е. м. Природный кремний состоит из трёх стабильных изотопов : 28 Si (92,2297 %), 29 Si (4,6832 %), 30 Si (3,0872 %). Искусственно получены радиоизотопы с массовыми числами 22–42.
Историческая справка
Широко распространённые на земле соединения кремния использовались человеком с каменного века ; например, с глубокой древности до железного века кремень применяли для выделки каменных орудий труда. Переработка соединений кремния – изготовление стекла – началась в 4-м тыс. до н. э. в Древнем Египте. Элементарный кремний получен в 1824–1825 гг. Й. Берцелиусом при восстановлении фторида SiF4металлическим калием. Новому элементу было дано названий «силиций» (от лат. silex – кремень; русское название «кремний», введённое в 1834 г. Г. И. Гессом , также происходит от слова «кремень»).
Распространённость в природе
Свойства
Конфигурация внешней электронной оболочки атома кремния 3s 2 3p 2 . В соединениях проявляет степень окисления +4, редко +1, +2, +3, –4; электроотрицательность по Полингу 1,90, потенциалы ионизации Si 0 →Si + →Si 2+ →Si 3+ →Si 4+ соответственно равны 8,15; 16,34; 33,46 и 45,13 эВ; атомный радиус 110 пм, радиус иона Si 4+ 40 пм (координационное число 4), 54 пм (координационное число 6).
где и как найти кремень
Кремний – тёмно-серое твёрдое хрупкое кристаллическое вещество с металлическим блеском. Кристаллическая решётка кубическая гранецентрированная; tпл1414 °C, tкип2900 °C, плотность 2330 кг/м 3 (при 25 °C).
Теплоёмкость 20,1 Дж/(моль·К), теплопроводность 95,5 Вт/(м·К), диэлектрическая проницаемость 12; твёрдость по Моосу 7. При обычных условиях кремний – хрупкий материал; заметная пластическая деформация наблюдается при температурах выше 800 °C. Кремний прозрачен для ИК-излучения с длиной волны больше 1 мкм (коэффициент преломления 3,45 при длине волны 2–10 мкм). Диамагнитен (магнитная восприимчивость –3,9·10 –6 ). Кремний – полупроводник, ширина запрещённой зоны 1,21 эВ (0 К); удельное электрическое сопротивление 2,3·10 3 Ом·м (при 25 °C), подвижность электронов 0,135–0,145, дырок – 0,048–0,050 м 2 /(В·с). Электрические свойства кремния очень сильно зависят от наличия примесей. Для получения монокристаллов кремния с проводимостью р-типа используют легирующие добавки B, Al, Ga, In ( акцепторные примеси ), с проводимостью n-типа – P, As, Sb, Bi ( донорные примеси ).

Образец чистого кремния. Образец чистого кремния. Кремний на воздухе покрывается оксидной плёнкой, поэтому при низких температурах химически инертен; при нагревании выше 400 °C взаимодействует с кислородом (образуются оксид SiO и диоксид SiO2), галогенами ( кремния галогениды ), азотом ( кремния нитрид Si3N4), углеродом ( кремния карбид SiC) и др. Соединения кремня с водородом – силаны – получают косвенным путём. Кремний взаимодействует с металлами с образованием силицидов .
Кремний. Химия – просто
Мелкодисперсный кремний – восстановитель: при нагревании взаимодействует с парáми воды с выделением водорода, восстанавливает оксиды металлов до свободных металлов. Кислоты-неокислители пассивируют кремний вследствие образования на его поверхности нерастворимой в кислотах оксидной плёнки. Кремний растворяется в смеси концентрированной HNO3с HF, при этом образуется кремнефтороводородная кислота:
3 S i + 4 H N O 3 + 18 H F = 3 H 2 [ S i F 6 ] + 4 N O + 8 H 2 О 3Si + 4HN O_ + 18HF = 3H_[SiF_] + 4NO + 8H_О 3 S i + 4 H N O 3 + 18 H F = 3 H 2 [ S i F 6 ] + 4 NO + 8 H 2 О .
Кремний (особенно мелкодисперсный) взаимодействует со щелочами с выделением водорода, например:
S i + 2 N a O H + H 2 O = N a 2 S i O 3 + 2 H 2 Si + 2NaOH + H_O = Na_SiO_ + 2H_ S i + 2 N a O H + H 2 O = N a 2 S i O 3 + 2 H 2 .
Биологическая роль
Кремний относится к микроэлементам . Суточная потребность человека в кремнии 20–50 мг (элемент необходим для правильного роста костей и соединительных тканей). В организм человека кремний попадает с пищей, а также с вдыхаемым воздухом в виде пылеобразного SiO2. При длительном вдыхании пыли, содержащей свободный SiO2, возникает силикоз .
Получение
Кремний технической чистоты (95–98 %) получают восстановлением SiO2углеродом или металлами. Высокочистый поликристаллический кремний получают восстановлением SiCl4или SiHCl3водородом при температуре 1000–1100 °С, термическим разложением SiI4или SiH4; монокристаллический кремний высокой чистоты – зонной плавкой или по методу Чохральского . Объём мирового производства кремния 2850 тыс. т/год (2020).
Применение
Кремний – основной материал микроэлектроники и полупроводниковых приборов; используется при изготовлении стёкол, прозрачных для ИК-излучения. Кремний является компонентом сплавов железа и цветных металлов (в малых концентрациях кремний повышает коррозионную стойкость и механическую прочность сплавов, улучшает их литейные свойства; в больших концентрациях может вызвать хрупкость); наибольшее значение имеют железные, медные и алюминиевые кремнийсодержащие сплавы. Кремний применяют в качестве исходного вещества для получения кремнийорганических соединений и силицидов.
Зломанов Владимир Павлович . Первая публикация: Большая российская энциклопедия, 2010.
в 17:37 (GMT+3) Обратная связь
Информация

Области знаний: Общие вопросы химии Символ: Si Атомный номер: 14 Группа элементов: Неметаллы Относительная атомная масса: 28,0855 а. е. м. Радиус атома: 110 пм Электроотрицательность: 1,90 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность: 2,33 г/см³ при 25 °C Температура плавления: 1414 °C Температура кипения: 2900 °C
Источник: bigenc.ru
Кремний — характеристики, особенности и сферы использования
Этим химическим элементом насыщена земная кора и биологические организмы. Кремний признан материалом третьего тысячелетия: IT-столица мира в Калифорнии называется Кремниевой долиной.
Что представляет собой
Кремний – это элемент таблицы Д.Менделеева №14.
Не относится к металлам, это неметалл.
Выглядит как коричневатый порошок либо темно-серые, с легким блеском кристаллы.
Международное наименование вещества – Si(Silicium).
Как был открыт
История открытия элемента связана с именем великого шведского химика Йенса Берцелиуса:
- То, что кремний существует, он предсказал в 1810 году.
- Через 13 лет выделил аморфную форму чистого вещества, восстановив фторид калием, описал химические свойства продукта.
Кристаллическую форму неметалла первыми добыли в 1811 году французы Луи Гей-Люссак и Жак Тенар.
Новооткрытый элемент получил название « силиций » (silex – латинское наименование кремня).

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Русский термин «кремний» ввел в научный оборот (1834 год) отечественный химик Герман Гесс.
Присутствие в природе
По концентрации в литосфере неметалл уступает только кислороду.
Тонна земной коры содержит около 286 кг кремния, литр морской воды – 3 мг.
Но найти самородки – редчайшая удача, почти всегда это кремнезем – конгломерат веществ на основе диоксида вещества (половина всего объема).
Он – основа двух видов минералов и горных пород:
- Силикаты, алюмосиликаты.
- Песок (кварцевый, речной), кварц, кварциты, полевые шпаты, кремень.
Кремень использовали еще древние люди: с его помощью можно было высечь искру. По этому признаку данный вид кремния легко отличить от других камней.
Физико-химические характеристики
Кремний – это неметалл, но выступает как восстановитель либо окислитель:

- Образует сплавы (силициды) с большинством металлов.
- В обычном микроклимате покрывается пленкой-оксидом, становясь инертным.
- Химическая активность почти нулевая, однако растет с ростом температуры.
- Физические и химические свойства формируются строением кристаллической решетки (аллотропным форматом). Например, аморфный неметалл активно впитывает влагу, быстрее взаимодействует при обычной температуре.
Подобно углероду, неметалл при взаимодействии образует соединения сродни органическим.
| Кремний/Silicium (Si), 14 |
| [28,086] а. е. м. (г/моль) |
| [Ne] 3s2 3p2; в соед. [Ne] 3s 3p3 (гибридизация) |
| 132 пм |
| 111 пм |
| 42 (+4e), 271 (−4e) пм |
| 1,90 (шкала Полинга) |
| −4, 0, +2; +4 |
| 786,0 (8,15) кДж/моль (эВ) |
| 2,33 г/см³ |
| 1414,85 °C (1688 K) |
| 2349,85 °C (2623 K) |
| 50,6 кДж/моль |
| 383 кДж/моль |
| 20,16 Дж/(K·моль) |
| 12,1 см³/моль |
| кубическая, алмазная |
| 5,4307 Å |
| 645 ± 5 K |
| (300 K) 149 Вт/(м·К) |
| 7440-21-3 |
В ряде химических процессов кремний ведет себя как металл.
Технология получения
Цель переработки сырья – максимально чистое вещество.
В лабораториях процедура следующая:
- Добывают силицид магния.
- Воздействуют на вещество уксусной либо соляной кислотой.
- Образовавшийся моносилан очищают (сорбентами, ректификаторами), нагревают до 1050°C.
В результате получают водород и кремний.
Для промышленников сырьем служит белый песок мелких фракций (диоксид вещества с формулой SiO2).
Способ получения неметалла предусматривает следующие этапы:
- Прокаливание смеси сырья с магнием до образования аморфной модификации. Продукт выглядит как буроватый порошок.
- Технически чистый материал (99,9%) получают в печи при 1780°C. Из расплава диоксида вещество восстанавливают коксом.
- При необходимости изымают углерод, другие примеси.
Очищают кремний прямым хлорированием. Из полученных соединений изымают примеси, восстанавливают водородом при 910-1150°C.
Новые технологии очистки предусматривают замену хлора фтором: это экологичнее и рентабельнее.Есть способы получения вещества на основе дистилляции оксида неметалла, вытравкой примесей.
Источник: jgems.ru
Кремний
![]()
В чистом виде был выделен в 1811 году французскими учеными 1825 году шведский химик металлического калия на лат. silex— 1834 году российским химиком Германом Ивановичем Гессом.
- 1 Нахождение в природе
- 2 Получение
- 3 Физические свойства
- 3.1 Электрофизические свойства
- 5.1 Ядерная энергетика
- 5.2 Медицина
- 5.3 Оптика
- 5.4 Биологическая роль
Нахождение в природе [ ]
В промышленности кремний получают, восстанавливая расплав SiO2водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или [1] — кремний производится на заводах в г. Свердловская область) и г. Иркутская область).
Физические свойства [ ]
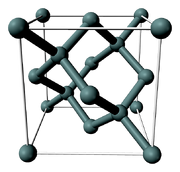
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению начиная с длинны волны 1.1 микрометр. Обладая самым высоким коэффициетом преломления (n = 3,4), прозрачностью, пропусканию инфракрасеых лучей он нашёл широкое применение в изготовлении оптических систем (объективов, биноклей ночного видения, в медицине — контактных линз и т.д.)
Электрофизические свойства [ ]
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2] . Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·10 16 м -3 . На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Химические свойства [ ]

В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1и R2= CH3, C2H5, C6H5, CH2CH2CF3и др.
Применение [ ]


- Оптические элементы из кремния— линзы, призмы, пластинки, изготовленная из однородного кремния, прозрачны для инфракрасно излучения, преломляют Х-лучи и стойкие к Х-излучению. [4]
- Линзы контактные
Линзы из органических полимеров дают возможность создавать недорогие асферические линзы с помощью литья. В области офтальмологии созданы мягкие контактные линзы. Их производство основано на применении оптическиих полимерных материалов материалов (ОПМ), имеющих бифазную природу, сочетающих фрагменты кремний-органическогоили кремний-фторорганическогополимера силикона и гидрофильного полимера гидрогеля.

- Линзы из кремния
Линзы из кремнияили рентгеновская оптика преломления — линзы, изготовленные из однородного кремния, прозрачные для инфракрасного излучения, рентгеновсого излучения, преломляющие Х-лучи.
В настоящее время нашли применение линзы из кремния. Это связано с современным уровнем технологий обработки твёрдых кристаллов и самое важное, кремний сочетает сверхвысокую дисперсию с самым большим абсолютным значением коэффициента преломления n=3,4 в диапазоне ИК-излучения; линзы из кремния прозрачны к Х-лучам и способны их преломлять, фокусировать (мягкие и жёсткие Х-лучи), что в последнее время находят широкое применение в микроскопии, телескопии, вытесняя рентгеновскую дорогостоящую оптику с применением зеркал и оптических систем «скользящего» преломления Х-лучей. Они полностью непрозрачны в видимом диапазоне спектра. Кроме этого кремний обладает способностью создавать материалы, имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля. Что делает его самым перспективным в изготовлении мягких контактных линз. [5]
Биологическая роль [ ]
Для некоторых организмов кремний является важным биогеным элементом . Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10 -2 % кремния, костная ткань — 17·10 -4 %, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — Цены [ ]
Изотопы [ ]
Основная статья: См. также [ ]
- Категория:Соединения кремния
- Линза
- Фотоматериалы
- Матрица (фото))
- Ситаллы
- Германий
- Углерод
Ссылки [ ]
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
- ↑http://www.lenta.ru/news/2008/01/22/graphene/
- ↑ В.В.Аристов, Л.Г.Шабельников Успехи физических наук, январь 2008г.,Том178, №1
- ↑http://www.nsc.ru/HBC/hbc.phtml?15+320+1
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
Источник: science.fandom.com