Кремний (Si) — это неметалл, стоящий на 2 месте после кислорода по запасам и нахождению на Земле(25,8% в Земной коре). В чистом виде он практически не встречается, в основном присутствует на планете в виде соединений.
Характеристика кремния
Физические свойства

Кремний – это хрупкий светло-серый материал с металлическим оттенком или порошкообразный материал коричневого цвета. Строение кристалла кремния однотипно с алмазом, но из-за различий в длине связи между атомами твердость алмаза значительно выше.
Кремний – неметалл, доступный для электромагнитного излучения. Благодаря некоторым качествам, он находится в середине между неметаллами и металлами:
• при увеличении температуры до 800 °C становится гибким и пластичным;
• при нагревании до 1417 °С плавится;
• начинает кипеть при температуре свыше 2600 °С;
33.Кремний в природе
• меняет плотность при высоком давлении;
• обладает свойством намагничиваться против направления внешнего магнитного поля (диамагнит).
Кремний – полупроводник, и примеси, входящие в его сплавы определяют электрические характеристики будущих соединений.
Химические свойства

При разогревании Si вступает в реакцию с кислородом, бромом, йодом, азотом, хлором и различными металлами. При соединении с углеродом получаются твердые сплавы с термо — и химио — стойкостью.
Кремний никак не воздействует с водородом, поэтому все возможные смеси c ним получают другим путем.
При обычных условиях он слабо реагирует со всеми веществами, кроме газообразного фтора. С ним образуется тетрафторид кремния SiF4. Такая неактивность объясняется тем, что на поверхности неметалла из-за реакции с кислородом, водой, ее парами и воздухом ложится пленка диоксида кремния и окутывает его. Поэтому химическое воздействие замедленно и незначительно.
Для удаления этого слоя используют смесь фтороводородной и азотной кислот или водные растворы щелочей. Некоторые специальные жидкости для этого предусматривают добавление хромового ангидрида и иных веществ.
Нахождение кремния в природе

Содержание Si в литосфере 25,8% по массе. Концентрация в морской воде 3 мг/л. Кремний очень распространен, примерно 12% всей твердой оболочки нашей планеты состоит из кремнезема в форме кварца и его разновидностей.
Кремний для Земли столь же важен как углерод для растений и животных. Ее кора почти наполовину состоит из кислорода, а если добавить к этому кремний, получится 80% массы. Эта связь очень важна для перемещения химических элементов.
Инопланетная жизнь на основе кремния | Reflection
75% литосферы содержат различные соли кремневых кислот и минералов (песок, кварциты, кремень, слюды, полевые шпаты и т. д.). Во время образования магмы и разных магматических пород Si накапливается в гранитах и в ультраосновных породах (плутонических и вулканических).
В теле человека 1 г кремния. Большинство содержится в костях, сухожилиях, кожном и волосяном покрове, лимфоузлах, аорте и трахее. Он участвует в процессе роста соединительной и костной тканей, а так же поддерживает эластичность сосудов.
Норма употребления в день для взрослого — 5 – 20 мг. Избыток вызывает силикоз.
Применение кремния в промышленности
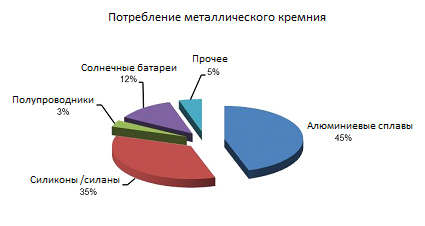
С каменного века этот неметалл известен человеку и широко используется до сих пор.
Применение:
• он хороший восстановитель, поэтому его используют в металлургии для получения металлов.
• в определенных условиях кремний способен проводить электричество, поэтому его применяют в электронике.
• оксид кремния используется в изготовлении стекол и силикатных материалов.
• специальные сплавы используется для производства полупроводниковых приборов.
Источник: xn—-8sbiecm6bhdx8i.xn--p1ai
Кремний и его соединения. Кремний в природе. Применение кремния
Одним из самых востребованных в технике и промышленности элементов является кремний. Этому он обязан своими необычными свойствами. Сегодня существует масса различных соединений данного элемента, которые играют важную роль в синтезе и создании технических продуктов, посуды, стекла, оборудования, строительных и отделочных материалов, ювелирных украшений и в прочих отраслях промышленности.

Общая характеристика кремния
Если рассматривать положение кремния в периодической системе, то можно сказать так:
- Располагается в IV группе главной подгруппы.
- Порядковый номер 14.
- Атомная масса 28,086.
- Химический символ Si.
- Название — кремний, или на латыни — silicium.
- Электронная конфигурация внешнего слоя 4е:2е:8е.
Кристаллическая решетка кремния подобна решетке алмаза. В узлах расположены атомы, тип ее — кубическая гранецентрированная. Однако вследствие большей длины связи физические свойства кремния сильно отличаются от свойств аллотропной модификации углерода.
Физические и химические свойства
Существует две аллотропные модификации данного элемента: аморфная и кристаллическая. Они очень схожи. Однако, как и в случае с другими веществами, главное различие между ними — кристаллическая решетка кремния.
При этом обе модификации — это порошки разного цвета.
1. Кристаллический кремний представляет собой темно-серый блестящий порошок, похожий на металл. Структура его соответствует алмазу, однако свойства отличны. Он обладает:
- хрупкостью;
- невысокой твердостью;
- полупроводниковыми свойствами;
- температурой плавления 1415 0 С;
- плотностью 2,33 г/см 3 ;
- температурой кипения 2700 0 С.
Его химическая активность невысока по сравнению с другой аллотропной формой.
2. Аморфный кремний — буро-коричневый порошок, обладает структурой сильноразупорядоченного алмаза. Химическая активность достаточно высока.
В целом следует заметить, что вступать в реакции кремний не любит. Чтобы заставить его реагировать, нужна температура не меньше 400-500 0 С. При этих условиях образуются различные химические соединения кремния. Такие как:
- оксиды;
- галогениды;
- силициды;
- нитриды;
- бориды;
- карбиды.
Возможно взаимодействие кремния с азотной кислотой или щелочью, что имеет название процесса травления. Широко распространены кремнийорганические соединения, которые сегодня получают все большее распространение.
Нахождение в природе
Кремний в природе содержится в достаточно весомом количестве. Стоит на втором месте после кислорода по распространенности. Его массовая доля составляет около 30%. Морская вода также содержит данный элемент в примерной концентрации 3 мг/л. Поэтому нельзя сказать, что кремний в природе — это редкий элемент.
Напротив, существует масса различных пород и минералов, в составе которых он встречается и из которых его можно добывать. Самые распространенные природные соединения кремния следующие:
- Кремнезем. Химическая формула SiO2. Существует достаточно большое разнообразие форм минералов и горных пород на его основе: песок, кремень, полевые шпаты, кварц, горный хрусталь, аметист, халцедон, сердолик, опал, яшма и другие.
- Силикаты и алюмосиликаты. Каолин, шпаты, слюда, соли кремниевой кислоты, асбест, тальк.
Таким образом, распространение в природе кремния широко, а его соединения пользуются популярностью и спросом у людей для применения в технических целях.

Кремний и его соединения
Так как в чистом виде рассматриваемый элемент существовать не может, поэтому важное значение имеют разные его соединения. С химической точки зрения он может проявлять три степени окисления: +2, +4, -4. Исходя из этого, а также из своей инертности, но особенной по строению кристаллической решетки, он формирует следующие основные виды веществ:
- бинарные соединения с неметаллами (силан, карбид, нитрид, фосфид и так далее;
- оксиды;
- кремниевую кислоту;
- силикаты металлов.
Рассмотрим подробнее, какое значение имеет кремний и его соединения, являющиеся самыми распространенными и востребованными для людей.

Оксиды кремния
Существует две разновидности данного вещества, выражаемые формулами:
Однако наибольшее распространение имеет диоксид. Он существует в природе в виде очень красивых полудрагоценных камней:
- агат;
- халцедон;
- опал;
- сердолик;
- яшма;
- аметист;
- горный хрусталь.
Применение кремния в такой форме нашло свое применение в производстве ювелирных изделий. Невероятно красивые золотые и серебряные украшения изготавливаются с этими полудрагоценными и поделочными камнями.
Еще несколько вариаций диоксида кремния:
- кварц;
- речной и кварцевый песок;
- кремень;
- полевые шпаты.
Применение кремния в таких видах реализуется в строительных работах, технике, радиоэлектронике, химической отрасли, металлургии. Все вместе перечисленные оксиды относятся к единому веществу — кремнезему.
Карбид кремния и его применение
Кремний и его соединения — это материалы будущего и настоящего. Одним из таких материалов является карборунд или карбид данного элемента. Химическая формула SiC. Встречается в природе в виде минерала муассанита.
В чистом виде соединение углерода и кремния — это красивые прозрачные кристаллы, напоминающие алмазные структуры. Однако в технических целях используются окрашенные в зеленый и черный цвета вещества.
Основные характеристики данного вещества, позволяющие использовать его в металлургии, технике, химической промышленности, следующие:
- полупроводник широкозонный;
- очень высокая степень прочности (7 по шкале Мооса);
- устойчив к действию высоких температур;
- отличная электроустойчивость и теплопроводность.
Все это позволяет использовать карборунд в качестве абразивного материала в металлургии и химических синтезах. А также на его основе изготавливать светодиоды широкого спектра действия, детали для стекловарочных печей, сопла, факелы, ювелирные украшения (муассанит ценится выше фианита).

Силан и его значение
Водородное соединение кремния имеет название силан и не может быть получено прямым синтезом из исходных веществ. Для его получения используют силициды различных металлов, которые подвергаются обработке кислотами. В результате выделяется газообразный силан и формируется соль металла.
Интересно то, что рассматриваемое соединение никогда не образуется в одиночестве. Всегда в результате реакции получается смесь моно-, ди- и трисилана, в которых атомы кремния соединены между собой в цепочки.
По своим свойствам эти соединения — сильные восстановители. Сами при этом легко окисляются кислородом, иногда со взрывом. С галогенами реакции бурные всегда, с большим выбросом энергии.
Области применения силанов следующие:
Таким образом, значение силанов в современном мире высоко.

Кремниевая кислота и силикаты
Гидроксид рассматриваемого элемента — это разные кремниевые кислоты. Выделяют:
- мета;
- орто;
- поликремниевые и другие кислоты.
Все их объединяют общие свойства — крайняя неустойчивость в свободном состоянии. Они легко разлагаются под действием температуры. При обычных условиях существуют недолго, превращаясь сначала в золь, а потом в гель. После высыхания такие структуры называют силикагелями. Они используются в качестве адсорбентов в фильтрах.
Важными, с точки зрения промышленности, являются соли кремниевых кислот — силикаты. Они лежат в основе получения таких веществ, как:
- стекло;
- бетон;
- цемент;
- цеолит;
- каолин;
- фарфор;
- фаянс;
- хрусталь;
- керамика.
Силикаты щелочных металлов — растворимы, всех остальных — нет. Поэтому силикат натрия и калия называют жидким стеклом. Обычный канцелярский клей — это и есть натриевая соль кремниевой кислоты.
Кварцевое стекло — это форма особо чистого продукта, состав которого описывается как диоксид кремния.

Открытия в области соединений кремния
За последние несколько лет исследований было доказано, что кремний и его соединения — важнейшие участники нормального состояния живых организмов. С недостатком или избытком данного элемента связаны такие заболевания, как:
- рак;
- туберкулез;
- артриты;
- катаракта;
- проказа;
- дизентерия;
- ревматизм;
- гепатит и другие.
Источник: fb.ru
Кремний — характеристики, особенности и сферы использования
Этим химическим элементом насыщена земная кора и биологические организмы. Кремний признан материалом третьего тысячелетия: IT-столица мира в Калифорнии называется Кремниевой долиной.

Что представляет собой
Кремний – это элемент таблицы Д.Менделеева №14.
Не относится к металлам, это неметалл.
Выглядит как коричневатый порошок либо темно-серые, с легким блеском кристаллы.
Международное наименование вещества – Si (Silicium).
Как был открыт
История открытия элемента связана с именем великого шведского химика Йенса Берцелиуса:
- То, что кремний существует, он предсказал в 1810 году.
- Через 13 лет выделил аморфную форму чистого вещества, восстановив фторид калием, описал химические свойства продукта.
Кристаллическую форму неметалла первыми добыли в 1811 году французы Луи Гей-Люссак и Жак Тенар.

Новооткрытый элемент получил название « силиций » (silex – латинское наименование кремня).

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Русский термин «кремний» ввел в научный оборот (1834 год) отечественный химик Герман Гесс.
Присутствие в природе
По концентрации в литосфере неметалл уступает только кислороду.
Тонна земной коры содержит около 286 кг кремния, литр морской воды – 3 мг.
Но найти самородки – редчайшая удача, почти всегда это кремнезем – конгломерат веществ на основе диоксида вещества (половина всего объема).
Он – основа двух видов минералов и горных пород:
- Силикаты, алюмосиликаты.
- Песок (кварцевый, речной), кварц, кварциты, полевые шпаты, кремень.
Кремень использовали еще древние люди: с его помощью можно было высечь искру. По этому признаку данный вид кремния легко отличить от других камней.
Физико-химические характеристики
Кремний – это неметалл, но выступает как восстановитель либо окислитель:

- Образует сплавы (силициды) с большинством металлов.
- В обычном микроклимате покрывается пленкой-оксидом, становясь инертным.
- Химическая активность почти нулевая, однако растет с ростом температуры.
- Физические и химические свойства формируются строением кристаллической решетки (аллотропным форматом). Например, аморфный неметалл активно впитывает влагу, быстрее взаимодействует при обычной температуре.
Подобно углероду, неметалл при взаимодействии образует соединения сродни органическим.
| Кремний/Silicium (Si), 14 |
| [28,086] а. е. м. (г/моль) |
| [Ne] 3s2 3p2; в соед. [Ne] 3s 3p3 (гибридизация) |
| 132 пм |
| 111 пм |
| 42 (+4e), 271 (−4e) пм |
| 1,90 (шкала Полинга) |
| −4, 0, +2; +4 |
| 786,0 (8,15) кДж/моль (эВ) |
| 2,33 г/см³ |
| 1414,85 °C (1688 K) |
| 2349,85 °C (2623 K) |
| 50,6 кДж/моль |
| 383 кДж/моль |
| 20,16 Дж/(K·моль) |
| 12,1 см³/моль |
| кубическая, алмазная |
| 5,4307 Å |
| 645 ± 5 K |
| (300 K) 149 Вт/(м·К) |
| 7440-21-3 |
В ряде химических процессов кремний ведет себя как металл.
Технология получения
Цель переработки сырья – максимально чистое вещество.
В лабораториях процедура следующая:
- Добывают силицид магния.
- Воздействуют на вещество уксусной либо соляной кислотой.
- Образовавшийся моносилан очищают (сорбентами, ректификаторами), нагревают до 1050°C.
В результате получают водород и кремний.
Для промышленников сырьем служит белый песок мелких фракций (диоксид вещества с формулой SiO2).

Способ получения неметалла предусматривает следующие этапы:
- Прокаливание смеси сырья с магнием до образования аморфной модификации. Продукт выглядит как буроватый порошок.
- Технически чистый материал (99,9%) получают в печи при 1780°C. Из расплава диоксида вещество восстанавливают коксом.
- При необходимости изымают углерод, другие примеси.
Очищают кремний прямым хлорированием. Из полученных соединений изымают примеси, восстанавливают водородом при 910-1150°C.

Новые технологии очистки предусматривают замену хлора фтором: это экологичнее и рентабельнее. Есть способы получения вещества на основе дистилляции оксида неметалла, вытравкой примесей.
Источник: jgems.ru