Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
Кристаллические решетки | Химия ЦТ, ЕГЭ
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Формула оксида лития, свойства, риски и использование
оксид лития неорганическое химическое соединение формулы Li2Или это образуется вместе с небольшими количествами пероксида лития, когда металлический литий сжигается в воздухе и соединяется с кислородом.
До 1990-х годов на рынке металлов и лития доминировало производство в США из месторождений полезных ископаемых, но в начале 21-го века большая часть производства была получена из неамериканских источников; Австралия, Чили и Португалия были самыми важными поставщиками в мире. У Боливии есть половина месторождений лития в мире, но это не большой производитель.

Наиболее важной коммерческой формой является карбонат лития, Li2Колорадо3, производится из минералов или рассолов несколькими различными процессами.
Когда литий сжигается в воздухе, основным продуктом является белый оксид лития, Li2О. Кроме того, некоторое количество перекиси лития производится, Li2О2, также белый.
Это также можно сделать путем термического разложения гидроксида лития, LiOH или пероксида лития, Li2O2.
2LiOH (s) + тепло → Li2O (s) + H2O (г)
Физико-химические свойства
Оксид лития представляет собой белое твердое вещество, известное как лития, которому не хватает аромата и соленого вкуса. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017).

Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства Вещества
Рисунок 2: внешний вид оксида лития
Оксид лития — это кристаллы с геометрией антифлорита, подобной геометрии хлорида натрия (кубический с центром на гранях) Его кристаллическая структура представлена на рисунке 3 (Марк Уинтер [Университет Шеффилда и WebElements Ltd, 2016].

Рисунок 3: кристаллическая структура оксида лития.
Его молекулярная масса составляет 29,88 г / моль, его плотность составляет 2,013 г / мл, а температуры плавления и кипения составляют 1438 ° С и 2066 ° С соответственно. Это соединение очень хорошо растворяется в воде, спирте, эфире, пиридине и нитробензоле (Royal Society of Chemistry, 2015).
Оксид лития легко реагирует с водяным паром с образованием гидроксида и с диоксидом углерода с образованием карбоната; следовательно, он должен храниться и обрабатываться в чистой и сухой атмосфере.
Оксидные соединения не приводят к электричеству. Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат по меньшей мере один кислородный анион и один металлический катион (American Elements, S.F.).
Реактивность и опасности
Оксид лития является стабильным соединением, несовместимым с сильными кислотами, водой и углекислым газом. Насколько нам известно, химические, физические и токсикологические свойства оксида лития не были исследованы и подробно представлены.
Токсичность соединений лития зависит от их растворимости в воде. Ион лития обладает токсичностью для центральной нервной системы. Соединение обладает сильным коррозионным раздражающим действием при попадании в глаза или на кожу при вдыхании или проглатывании (ESPI METALS, 1993).
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
Во всех случаях вам следует немедленно обратиться к врачу (SIGMA-ALDRICH, 2010).
приложений
Оксид лития используется в качестве флюса в керамической глазури и создает синий с медью и розы с кобальтом. Оксид лития реагирует с водой и паром, образуя гидроксид лития и должен быть изолирован от них.
Оксид лития (Li2O) с его высоким потенциалом трития является привлекательным кандидатом на твердый культуральный материал термоядерной электростанции DT из-за его высокой плотности атомов лития (по сравнению с другими литиевыми или металлическими литиевыми керамиками) и его проводимости относительно высокая термическая (ОКСИД ЛИТИЯ (Li2O), SF).
Li2Или он будет подвергаться воздействию высоких температур под действием нейтронного излучения во время работы термоядерных покрытий. В этих условиях большое количество дефектов облучения будет происходить в Li2Или, например, вызванное гелием набухание, относительно высокое тепловое расширение, рост зерна, образование и осаждение LiOH (T) при низких температурах и перенос массы LiOH (T) при высоких температурах.
Кроме того, Ли2Или это будет предметом напряжений, возникающих из-за различий в тепловом расширении между Li2О и конструкционные материалы. Эти характеристики Ли2Или они приводят к сложным инженерным проблемам как при изготовлении, так и при проектировании одеял..
Возможное новое применение — замена кобальта и оксида лития в качестве катода в литий-ионных батареях, используемых для питания электронных устройств от мобильных телефонов до ноутбуков, а также автомобилей с батарейным питанием (Reade International Corp, 2016).
Оксид лития

Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.

Описание
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании.
При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
Li2O + 2 HCl → 2 LiCl + H2O
- литий из оксида вытесняется некоторыми металлами и неметаллами:
Li2O + Mg → 800∘C 2 Li + MgO 2 Li2O + Si → 1000∘C 4 Li + SiO2
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Источник: all-equa.ru
2.1.1. Соединения лития с кислородом
Оксид лития Li2O– бесцветное кристаллическое вещество, имеющее кубическую гранецентрированную решетку типа флюорита, CaF2(a = 4,628 Ǻ, Z = 4); плотность 2,013 г/см 3 (25 ºC), температура плавления 1427 ºC, кипения – около 2000 ºC; термически устойчивое соединение, выше 1000 ºC начинается сублимация. Оксид лития получается при непосредственном окислении металлического лития при температуре выше 200 ºC, а также разложением карбоната Li2CO3, нитрата LiNO3, гидроксида LiOH в токе сухого водорода выше 800 ºC. Существует также пероксид лития, Li2O2, который получают косвенным путем по реакции пероксида водорода со спиртовым раствором LiOH; образующийся гидрат пероксида лития разрушают нагреванием в вакууме:
LiOH + 2H2O2 + H2O = 2LiOOH + 3H2O (2)
Выше 350 ºC пероксид лития распадается на оксид и воду.
Оксид лития, Li2O, легко, но менее энергично, чем оксиды других щелочных элементов, взаимодействует с водой с образованием гидроксида, LiOH; реакция сопровождается сильным разогреванием; LiOH поглощает CO2из воздуха, образуя карбонат, Li2CO3. Оксид лития разрушает большинство даже коррозионно устойчивых материалов. Ниже 1000 ºС устойчивы против Li2O никель Ni; золото Au; и платина Pt; выше 1000 ºС – сплав платины с 40 % родия.
Оксид лития с оксидами переходных элементов IV и V-ой групп периодической системы образует многочисленные соединения, из которых наибольший интерес представляют ниобат и танталат лития, LiNbO3и LiTaO3. Эти соединения относятся к группе сегнетоэлектриков с общей формулой ABO3и обладают комплексом разнообразных свойств.
Интересны в практическом плане соединения лития и алюминия. Из водных щелочных растворов выделяется плохо растворимый алюминат лития LiAlO2. Изучение системы Li2O – Al2O3– H2O (50ºС) показало, что равновесной твердой фазой является фаза переменного состава (1-x)Li2O∙Al2O3∙nH2O, x=0,12–0,21; n=8. Алюминат лития используется для выделения лития из разбавленных растворов.
Гидроксид лития LiOH – бесцветное вещество, кристаллизуется в тетрагональной сингонии (a = 3,549 Ǻ; c = 4,334 Ǻ); плотность (25 ºС) – 2,54 г/см3. Температура плавления 473 ºС, температура кипения 924 ºС (разлагается) (табл. 2).
Свойства гидроксидов щелочных металлов
Растворимость в воде, г /100 г H2O
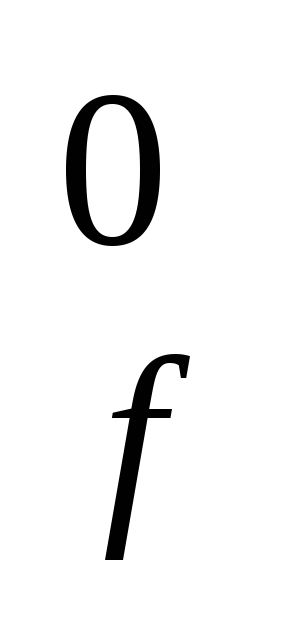
ΔH,кДж/моль
о основным свойствам гидроксид лития, LiOH, является переходным от гидроксидов щелочных к гидроксидам щелочноземельных металлов. На воздухе LiOH активно карбонизуется с образованием карбоната Li2CO3. Термически LiOH менее устойчив, чем гидроксиды остальных элементов группы, при прокаливании он разлагается на оксид и воду:
Для LiOH характерна более низкая по сравнению с гидроксидами других щелочных элементов растворимость в воде, которая увеличивается с повышением температуры (рис. 1), из водных растворов выделяется в виде моногидрата, LiOH∙H2O, который теряет кристаллизационную воду только выше 600 ºС.
Гидрат гидроксида лития LiOH∙H2O в твердом виде состоит из димеров Li2(OH)2, связанных в цепочки мостиковыми молекулами воды (рис. 2). Сходные димеры преобладают и в парах LiOH при 800 ºС. При обычной температуре гидроксид лития и его концентрированные растворы разрушают стекло и фарфор, в расплавленном состоянии разрушают все металлы, кроме Au, Ag и Ni. Гидроксид лития образуется при непосредственном взаимодействии металлического лития или его оксида с водой, а также при гидролизе сульфида, нитрида, фосфидов и других соединений лития.
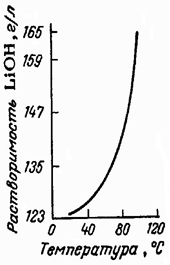
Рис. 1. Политерма растворимости гидроксида лития в воде
гидроксида лития в воде
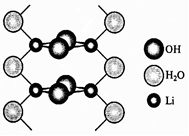
Рис. 2. Строение LiOH ∙ H2O
На практике для получения LiOH используют несколько методов.
1. Методы, основанные на реакциях обмена в растворе:
- Электролиз LiCl. Раствор LiCl подвергают электролизу в ванне с ртутным катодом; при этом на нем образуется амальгама лития, LiHg. При разложении амальгамы водой получают раствор LiOH.
- Обменное разложение гашеной известью в растворе:
Li2CO3 + Ca(OH)2 → 2LiOH + CaCO3 (7) Этот метод имеет промышленное значение. Сульфат лития, Li2SO4,– бесцветное кристаллическое вещество, существует в трех модификациях: моноклинная α-модификация (a = 8,44; b = 4,95; c = 8,24 Ǻ, β = 107º 54′) устойчива до 500 ºC; выше 500 ºC переходит в гексагональную β-модификацию, которая при 575 ºС переходит в кубическую γ-модификацию, существующую до температуры плавления. Плотность α-Li2SO4(25 ºC) – 2,22 г/см 3 . Э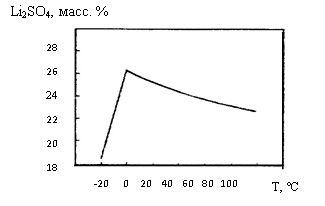 нтальпия образования ΔH = –1434 кДж/моль; Li2SO4хорошо растворяется в воде (рис. 3), выше 0 ºC имеет отрицательный коэффициент растворимости, из водных растворов выделяется в виде моногидрата, Li2SO4∙H2O, который обезвоживается при 500ºC. В Рис.3. Политерма растворимости Li2SO4 в воде термическом отношении сульфат лития более устойчив, чем другие его растворимые соли, но менее, чем сульфаты остальных щелочных элементов; подобно им, Li2SO4восстанавливается водородом при 620-700 ºC и аммиаком (720-800ºC) до Li2S. В органических растворителях Li2SO4не растворяется, образует двойные соединения с сульфатами других щелочных металлов (MLiSO4; Na3Li(SO4)2∙6H2O и др.). В отличие от сульфатов других щелочных металлов в обычных температурных условиях не образует квасцов. Алюмо-литиевые квасцы (LiAl(SO4)2∙12H2O) существуют только в узкой области концентраций компонентов в системе Li2SO4– Al2(SO4)3– H2O при –2 ºC (и ниже). Сульфат лития можно получить при взаимодействии H2SO4с литием, Li2O или LiOH, но обычно его получают при взаимодействии Li2CO3с H2SO4. Для лития известны также гидросульфаты и пиросульфат. Нитрат лития, LiNO3,– бесцветное прозрачное кристаллическое вещество гексагональной сингонии (a = 4,674; c = 15,199 Ǻ), плотность 2,36 г/см3 (20 ºC), Т пл. = 254 ºC, энтальпия образования ΔH = – 428 кДж/моль, при 600 ºC начинает разлагаться с выделением кислорода и оксидов азота. Нитрат лития гигроскопичен, хорошо растворяется в воде, растворимость резко увеличивается с повышением температуры (рис.4), образует пересыщенные растворы.
нтальпия образования ΔH = –1434 кДж/моль; Li2SO4хорошо растворяется в воде (рис. 3), выше 0 ºC имеет отрицательный коэффициент растворимости, из водных растворов выделяется в виде моногидрата, Li2SO4∙H2O, который обезвоживается при 500ºC. В Рис.3. Политерма растворимости Li2SO4 в воде термическом отношении сульфат лития более устойчив, чем другие его растворимые соли, но менее, чем сульфаты остальных щелочных элементов; подобно им, Li2SO4восстанавливается водородом при 620-700 ºC и аммиаком (720-800ºC) до Li2S. В органических растворителях Li2SO4не растворяется, образует двойные соединения с сульфатами других щелочных металлов (MLiSO4; Na3Li(SO4)2∙6H2O и др.). В отличие от сульфатов других щелочных металлов в обычных температурных условиях не образует квасцов. Алюмо-литиевые квасцы (LiAl(SO4)2∙12H2O) существуют только в узкой области концентраций компонентов в системе Li2SO4– Al2(SO4)3– H2O при –2 ºC (и ниже). Сульфат лития можно получить при взаимодействии H2SO4с литием, Li2O или LiOH, но обычно его получают при взаимодействии Li2CO3с H2SO4. Для лития известны также гидросульфаты и пиросульфат. Нитрат лития, LiNO3,– бесцветное прозрачное кристаллическое вещество гексагональной сингонии (a = 4,674; c = 15,199 Ǻ), плотность 2,36 г/см3 (20 ºC), Т пл. = 254 ºC, энтальпия образования ΔH = – 428 кДж/моль, при 600 ºC начинает разлагаться с выделением кислорода и оксидов азота. Нитрат лития гигроскопичен, хорошо растворяется в воде, растворимость резко увеличивается с повышением температуры (рис.4), образует пересыщенные растворы.  Рис.4. Политерма растворимости LiNO3 в воде В водном растворе LiNO3сильно диссоциирован, степень диссоциации в 0,1 М растворе 64 %, в 0,001 М растворе – 97,5 %. Из водных растворов ниже 30 ºC кристаллизуется LiNO3∙3H2O, при более высокой температуре – LiNO3. Получают нитрат лития взаимодействием LiOH (Li2CO3) с разбавленной HNO3с последующим упариванием раствора и нагреванием остатка в вакууме при 200 ºC. Ортофосфат лития, Li3PO4, – бесцветное кристаллическое вещество ромбической сингонии, плотность – 2,41 г/см 3 (20 ºC); термически устойчив, не плавится и не разлагается до температуры красного каления, Тпл1220 ºC. Ортофосфат лития – наименее растворимая соль лития. В 100 г воды растворяется 0,022 г при 0 ºC и 0,034 г при 18 ºC. В присутствии аммиака растворимость Li3PO4уменьшается, а в присутствии аммонийных солей (NH4Cl) – увеличивается. Из водных растворов при обычной температуре осаждается Li3PO4∙2H2O, который после сушки при 60ºC переходит в полугидрат (Li3PO4∙0,5H2O), а выше 120ºC полностью обезвоживается. Li3PO4легко разлагается сильными кислотами, труднее – уксусной. Li3PO4образует двойные соли с фосфатами других щелочных металлов и аммония, обычно лучше растворимые в воде, чем Li3PO4. Для получения ортофосфата лития используют нейтрализацию H3PO4избытком LiOH, однако при этом, помимо Li3PO4, образуется основной фосфат лития 2Li3PO4∙LiOH, поэтому применяют осаждение Li3PO4из раствора соли лития Na2HPO4в слабощелочном растворе: 3LiX + Na2HPO4 + NaOH = Li3PO4 + 3NaX + H2O (8) Добавление NaOH обязательно, иначе образуется растворимый Li2HPO4, что ведет к потерям лития. Незначительная растворимость Li3PO4в воде используется в аналитической химии для отделения лития от других щелочных металлов и его количественного определения. В технологических схемах применяется осаждение Li3PO4для доизвлечения лития из различных маточных растворов (содержащих натрий и калий), после первичного извлечения лития в виде Li2CO3. Для перевода Li3PO4в растворимые соединения используют взаимодействие Li3PO4с CaCl2в расплаве при 850 ºC: 2Li3PO4 + 3CaCl2 = 6LiCl + Ca3(PO4)2 (9) Карбонат лития, Li2CO3, – бесцветное мелкокристаллическое вещество, кристаллизуется в моноклинной сингонии (a = 8,39; b = 5,00; c = 6,21 Ǻ, β = 114,5º), плотность 2,11 г/см 3 (0 ºC); энтальпия образования ΔH = – 1078,70 кДж/моль; Т пл. 732 ºC. Карбонат лития – термически неустойчивое соединение, уже при температуре плавления заметно диссоциирует: Li2CO3→Li2O + CO2. (10) Давление CO2становится равным атмосферному при 1270 ºC; карбонат лития менее стоек, чем карбонаты натрия и калия, термическая диссоциация ускоряется в вакууме и в присутствии углерода вследствие восстановления CO2до CO и смещения равновесия реакции влево. Оксид лития в расплаве Li2CO3очень агрессивен – разрушает корунд, алунд, диоксид циркония и платину. По ряду свойств карбонат лития сходен с карбонатом кальция. Р
Рис.4. Политерма растворимости LiNO3 в воде В водном растворе LiNO3сильно диссоциирован, степень диссоциации в 0,1 М растворе 64 %, в 0,001 М растворе – 97,5 %. Из водных растворов ниже 30 ºC кристаллизуется LiNO3∙3H2O, при более высокой температуре – LiNO3. Получают нитрат лития взаимодействием LiOH (Li2CO3) с разбавленной HNO3с последующим упариванием раствора и нагреванием остатка в вакууме при 200 ºC. Ортофосфат лития, Li3PO4, – бесцветное кристаллическое вещество ромбической сингонии, плотность – 2,41 г/см 3 (20 ºC); термически устойчив, не плавится и не разлагается до температуры красного каления, Тпл1220 ºC. Ортофосфат лития – наименее растворимая соль лития. В 100 г воды растворяется 0,022 г при 0 ºC и 0,034 г при 18 ºC. В присутствии аммиака растворимость Li3PO4уменьшается, а в присутствии аммонийных солей (NH4Cl) – увеличивается. Из водных растворов при обычной температуре осаждается Li3PO4∙2H2O, который после сушки при 60ºC переходит в полугидрат (Li3PO4∙0,5H2O), а выше 120ºC полностью обезвоживается. Li3PO4легко разлагается сильными кислотами, труднее – уксусной. Li3PO4образует двойные соли с фосфатами других щелочных металлов и аммония, обычно лучше растворимые в воде, чем Li3PO4. Для получения ортофосфата лития используют нейтрализацию H3PO4избытком LiOH, однако при этом, помимо Li3PO4, образуется основной фосфат лития 2Li3PO4∙LiOH, поэтому применяют осаждение Li3PO4из раствора соли лития Na2HPO4в слабощелочном растворе: 3LiX + Na2HPO4 + NaOH = Li3PO4 + 3NaX + H2O (8) Добавление NaOH обязательно, иначе образуется растворимый Li2HPO4, что ведет к потерям лития. Незначительная растворимость Li3PO4в воде используется в аналитической химии для отделения лития от других щелочных металлов и его количественного определения. В технологических схемах применяется осаждение Li3PO4для доизвлечения лития из различных маточных растворов (содержащих натрий и калий), после первичного извлечения лития в виде Li2CO3. Для перевода Li3PO4в растворимые соединения используют взаимодействие Li3PO4с CaCl2в расплаве при 850 ºC: 2Li3PO4 + 3CaCl2 = 6LiCl + Ca3(PO4)2 (9) Карбонат лития, Li2CO3, – бесцветное мелкокристаллическое вещество, кристаллизуется в моноклинной сингонии (a = 8,39; b = 5,00; c = 6,21 Ǻ, β = 114,5º), плотность 2,11 г/см 3 (0 ºC); энтальпия образования ΔH = – 1078,70 кДж/моль; Т пл. 732 ºC. Карбонат лития – термически неустойчивое соединение, уже при температуре плавления заметно диссоциирует: Li2CO3→Li2O + CO2. (10) Давление CO2становится равным атмосферному при 1270 ºC; карбонат лития менее стоек, чем карбонаты натрия и калия, термическая диссоциация ускоряется в вакууме и в присутствии углерода вследствие восстановления CO2до CO и смещения равновесия реакции влево. Оксид лития в расплаве Li2CO3очень агрессивен – разрушает корунд, алунд, диоксид циркония и платину. По ряду свойств карбонат лития сходен с карбонатом кальция. Р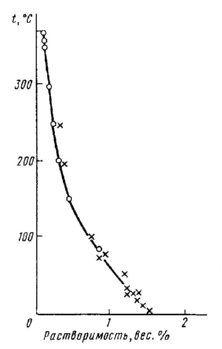 астворимость Li2CO3мала, она значительно ниже растворимости к Рис.5. Политерма растворимости Li2CO3 в воде арбонатов остальных щелочных металлов (рис.5). При 20 ºC она составляет 1,33 г /100 г H2O. С повышением температуры, как видно из рис. 5, растворимость понижается, т.е. карбонат лития имеет отрицательный температурный коэффициент растворимости. Кристаллогидратов карбонат лития не образует, в водных растворах заметен гидролиз, который усиливается при кипячении. Карбонаты щелочных металлов не образуют с Li2CO3соединений, они понижают растворимость Li2CO3, что объясняется действием одноименного иона. При пропускании CO2через водную суспензию Li2CO3карбонат лития растворяется вследствие образования более растворимого гидрокарбоната: Li2CO3+ CO2+ H2O→2LiHCO3(11) Гидрокарбонат лития разлагается при нагревании, выделяя Li2CO3. Чистый карбонат лития можно получить, пропуская CO2в раствор LiOH. В промышленности его получают при действии поташом (K2CO3) или содой (Na2CO3) на растворы солей лития вблизи температуры кипения (90ºC). Карбонат лития – важнейшее промышленное соединение лития, т.к. многие технологические схемы переработки литийсодержащего сырья заканчиваются осаждением Li2CO3. Кроме того, карбонат лития – источник получения другого технически важного соединения лития – LiOH и многочисленных солей лития.
астворимость Li2CO3мала, она значительно ниже растворимости к Рис.5. Политерма растворимости Li2CO3 в воде арбонатов остальных щелочных металлов (рис.5). При 20 ºC она составляет 1,33 г /100 г H2O. С повышением температуры, как видно из рис. 5, растворимость понижается, т.е. карбонат лития имеет отрицательный температурный коэффициент растворимости. Кристаллогидратов карбонат лития не образует, в водных растворах заметен гидролиз, который усиливается при кипячении. Карбонаты щелочных металлов не образуют с Li2CO3соединений, они понижают растворимость Li2CO3, что объясняется действием одноименного иона. При пропускании CO2через водную суспензию Li2CO3карбонат лития растворяется вследствие образования более растворимого гидрокарбоната: Li2CO3+ CO2+ H2O→2LiHCO3(11) Гидрокарбонат лития разлагается при нагревании, выделяя Li2CO3. Чистый карбонат лития можно получить, пропуская CO2в раствор LiOH. В промышленности его получают при действии поташом (K2CO3) или содой (Na2CO3) на растворы солей лития вблизи температуры кипения (90ºC). Карбонат лития – важнейшее промышленное соединение лития, т.к. многие технологические схемы переработки литийсодержащего сырья заканчиваются осаждением Li2CO3. Кроме того, карбонат лития – источник получения другого технически важного соединения лития – LiOH и многочисленных солей лития.
Источник: studfile.net
Оксид лития

Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.

Описание
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании.
При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
- с кислотами:
- литий из оксида вытесняется некоторыми металлами и неметаллами:
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
См. также
- Литий
- Пероксид лития
Соединения лития
- Литий (Li)
- 12-Оксистеарат лития (LiC18H35O3)
- Азид лития (LiN3) Литий тринитрид
- Алюминат лития (LiAlO2) Литий метаалюминат
- Амид лития (LiNH2) Амид лития
- Арсенат лития (Li3AsO4) Литий мышьяковокислый
- Арсенид лития (LiAs) Литий мышьяковистый
- Ацетат лития (CH3COOLi) Литий уксуснокислый
- Бензоат лития (C6H5-COOLi) Литий бензойнокислый
- Бромат лития (LiBrO3) Литий бромноватокислый
- Бромид лития (LiBr) Литий бромистый
- Ванадат лития (LiVO3) Литий ванадиевокислый
- Вольфрамат лития (Li2WO4) Литий вольфрамовокислый
- Гидрокарбонат лития (LiHCO3) Литий двууглекислый
- Гидрооксалат лития (LiHC2O4) Литий щавелевокислый кислый
- Гидроксид лития (LiOH) Литий гидроокись (литий едкий)
- Гидросульфат лития (LiHSO4) Литий бисульфат
- Гидрофосфит лития (LiHPHO3) Гидрофосфонат лития
- Гипофосфат лития (Li4P2O6) Литий фосфорноватокислый
- Гипофосфит лития (LiPH2O2) Литий фосфорноватистокислый
- Гипохлорит лития (LiClO) Литий хлорноватистокислый
- Дигидрофосфат лития (LiH2PO4) Литий дигидроортофосфат
- Диарсенидоалюминат лития (Li3AlAs2) Мышьяковистые алюминий-литий
- Динитридоалюминат лития (Li3AlN2) Азотистые алюминий-литий
- Дифосфидоалюминат лития (Li3AlP2) Фосфористые алюминий-литий
- Дихромат лития (Li2Cr2O7) Литий двухромовокислый Бихромат лития
- Йодат лития (LiIO3) Литий йодноватокислый
- Йодид лития (LiI) Литий йодистый
- Карбонат лития (Li2CO3) Литий углекислый
- Лактат лития (LiC3H5O3) Литий молочнокислый
- Лаурат лития (LiC12H23O2) Литий лауриновокислый
- Метаборат лития (LiBO2) Литий борнокислый
- Метагерманат лития (Li2GeO3) Литий германиевокислый
- Метасиликат лития (Li2SiO3) Кремнекислый литий
- Метафосфат лития (LiPO3) Литий фосфорнокислый
- Молибдат лития (Li2MoO4) Литий молибденовокислый
- Ниобат лития (LiNbO3) Литий ниобиевокислый
- Нитрат лития (LiNO3) Литий азотнокислый
- Нитрид лития (Li3N) Литий азотистый
- Нитрит лития (LiNO2) Литий азотистокислый
- Оксид лития (Li2O) Литий окись (Окись лития)
- Оксалат лития (Li2C2O4) Литий щавелевокислый
- Ортоборат лития (Li3BO3) Литий триоксоборат
- Ортосиликат лития (Li4SiO4) Литий кремнекислый
- Ортофосфат лития (Li3PO4) Литий ортофосфат
- Пальмитат лития (LiC16H31O2) Литий пальмитиновокислый
- Перманганат лития (LiMnO4) Литий марганцовокислый
- Пероксид лития (Li2O2) Литий перекись (перекись лития)
- Перхлорат лития (LiClO4) Литий хлорный
- Пирофосфат лития (Li4P2O7) Дифосфат лития
- Рицинолеат лития (LiC18H33O3) Литий рицинолевокислый
- Салицилат лития (LiC7H5O3) Литий салициловокислый
- Селенат лития (Li2SeO4) Литий селеновокислый
- Селенид лития (Li2Se) Литий селенистый
- Силикат алюминия-лития (LiAl(SiO3)2) Кремнекислые алюминий-литий
- Силицид трилития (Li6Si2) Трилития силицид
- Стеарат лития (LiC18H35O2) Литий стеариновокислый
- Сукцинат лития (C4H4Li2O4) Литий янтарнокислый
- Сульфат лития (Li2SO4) Литий сернокислый
- Сульфид лития (Li2S) Литий сернистый
- Сульфит лития (Li2SO3) Литий сернистокислый
- Тетраборат лития (Li2B4O7) Борнокислый литий
- Теллурид лития (Li2Te) Литий теллуристый
- Тетрафтороборат лития (LiBF4) Литий тетрафторбористый
- Тиоцианат лития (LiSCN) Литий роданистый
- Титанат лития (Li2TiO3) Литий титановокислый
- Формиат лития (LiHCO2) Литий муравьинокислый
- Фосфит лития (Li2PHO3) Литий фосфористокислый (Литий фосфонат)
- Фторид лития (LiF) Литий фтористый
- Фторосульфонат лития (LiSO3F) Литий фторсульфоновокислый
- Хлорат лития (LiClO3) Литий хлорноватокислый
- Хлорид лития (LiCl) Литий хлористый
- Хлорит лития (LiClO2) Литий хлористокислый
- Хромат лития (Li2CrO4) Литий хромовокислый
- Цианид лития (LiCN) Литий цианистый (Цианистый литий)
- Цирконат лития (Li2ZrO3) Литий циркониевокислый
- Цитрат лития (Li3C6H5O7) Литий лимоннокислый
Источник: chem.ru