Кальций (Ca) – легкий агрессивный металл серебристого цвета с беловатым оттенком. Он играет важную роль во многих сферах жизни. В свободном виде в природе его нет, так как он химически высокоактивен.
Оглавление:
- История открытия
- Кальций в таблице Менделеева
- Строение атома
- Физические свойства
- Химический свойства
- Кальций в природе
- Применение
История открытия
В первом десятилетии 19-го века Хэмфри Дэви получил вещество без примесей. Он взял для электролиза катод на основе ртути и увлажненную гашеную известь. На первом этапе результат – сплав кальция и ртути. На втором, после удаления ртутной части – чистый элемент.
История названия «кальций» берет начало в том же веке от латинского “calx”, что переводится как известь.
Однако в древнем мире слово уже употреблялось для описания некоторых процессов, например для обжига известняка, гашения извести. Сам процесс термической обработки позднее получил название «кальцинация».
Кому действительно нужен кальций⁉️
Кальций в таблице Менделеева
В системе Менделеева занимает 20 порядковое место, что относится ко второй группе и четвертому периоду.
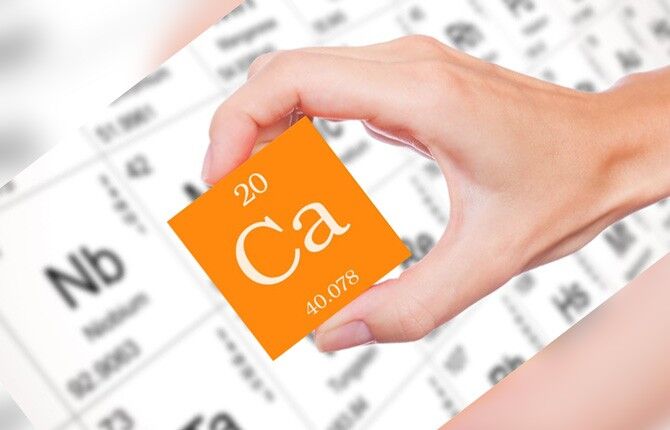
Атомная масса вещества – 40,078 г/моль. Это металл, входящий в категорию щелочноземельных, s-семейство.
Строение атома
Атом имеет положительно заряженное ядро и область вокруг него с орбиталями. Ядро любого атома содержит протоны и нейтроны, соответственно, положительно и нейтрально заряженные частицы.
Ядро атома кальция содержит по 20 протонов и нейтронов. В области вокруг него находится 4 орбитали, по которым движется 20 электронов – отрицательно заряженных частиц. При этом электроны располагаются в порядке 2, 8, 8, 2.

Последняя орбиталь в электронном строении описывается как 4S², имеет 2 спаренных электрона, из-за чего валентность элемента равна 2. При образовании соединений отдает 2 электрона с внешнего слоя, выполняет функцию окислителя. Степень окисления равна +2.
Физические свойства
Это твердый металл серебряного цвета с беловатым оттенком в нормальных условиях. При постепенном нагревании переходит в жидкое агрегатное состояние, потом в газообразное.
| Параметр | Значение |
| Плавление | При 842°С |
| Кипение | При 1484°С |
| Плотность | 1,55 г/см³ |
Хорошо подвергается различным манипуляциям – режется, прессуется, прокатывается.

Кальций. Зачем, кому, сколько, и какой лучше выбрать? (глюконат, карбонат, хелат, цитрат)
Аллотропия – способность химического элемента существовать в виде двух и более простых веществ, которые различаются по свойствам, химическому строению. Существует две аллотропные модификации:
- альфа-Ca, устойчивый до 443°С;
- бета-Ca, устойчив при температурах выше 443°С.
Различаются они моделью кубической решетки. У α-Ca она гранецентрированная, а у β-Ca объемноцентрированная.
Химический свойства
Является типичным представителем семейства щелочноземельных металлов. Кальций вступает в реакции с разными веществами, так как является химически активным.
Несмотря на свою высокую способность к взаимодействию, кальций не самый активный металл семейства. Степень окисления +2.
Кальций вступает в следующие химические реакции:
- С кислородом взаимодействует в нормальных условиях, образуя оксид и выделяя тепло. Может даже загореться чистым красным огнем и белым дымом. Образуется оксид кальция — 2Ca + O₂ -> 2CaO.
- С галогенами реагирует в нормальных условиях — Ca + Br₂ -> CaBr₂ – бромид.
- С углеродом дает реакцию при нагреве. Аналогичными будут взаимодействия с водородом, кремнием и другими неметаллами — Ca + 2C -> CaC₂ – карбид.
- С кислотами, иногда с мощным выделением тепла. Выделяют 2 варианта уравнения реакции кальция с серной кислотой: Ca + H₂SO₄(разбавленная) -> CaSO₄ + 2H₂ и Ca + H₂SO₄(концентрированная) -> CaSO₄ + SO₂ + 2H₂O. В обоих случаях результатом реакции будет соль сульфат, побочные продукты.
- С водой реакция проходит с выделением тепла, но без воспламенений — Ca + 2H₂O -> Ca(OH)2 + H₂.
На воздухе металл покрывается сероватым налетом.

В реакции вступает много соединений элемента:
- Соединения кальция и неметаллов в присутствии воды разлагаются до гидроксида, водорода — CaH₂ + H₂O -> Ca(OH)₂ + 2H₂.
- Существует особенный перенос веществ, а именно превращение из карбоната в кислую его версию и обратно в разных условиях.
- При реакции воды, обогащенной углекислым газом, с карбонатом кальция выделяется кислый карбонат, одновременно происходит растворение — СаСО3 + СО2 + Н2О = Са(НСО3)2.
- В обратном случае кислый карбонат кальция нагревается под солнцем распадаясь на 3 компонента — Са(НСО3)2 = СаСО3 + СО2↑ + Н2О.
Рекомендовано не хранить кальций в открытом виде, а убирать в герметичную стеклянную посуду с добавлением парафина или керосина.
Кальций в природе
В целом вещество является пятым по распространенности на планете. К осадочным породам с кальцием в составе относят меловые отложения и известняк. В основном они состоят из кальцита, который в кристаллической форме представляет собой мрамор.
Элемент способен мигрировать в земной коре и из-за своей активности вступать в различные реакции, образуя минералы. Насчитывается более 380 минералов с участием этого компонента. Часто встречаются:
- кальцит;
- ангидрит;
- апатит;
- доломит.
Элемент содержится и в живых организмах. Большая часть, а именно гидроксиапатит, приходится на клетки костей, зубов. У губок, кораллов скелет целиком состоит из карбоната кальция.
Применение
В редких случаях кальций используется как самостоятельный компонент, чаще он находится в других веществах. В чистом виде применяется в восстановительных реакциях металлов из оксидов.
В металлургии востребован для удаления окислений или для получения трудно восстанавливаемых металлов, например урана или хрома.
В свинцовый аккумуляторах кальций используют как небольшую добавку. От общего объема вещества его меньше 1%. Однако этого достаточно, чтобы не дать аккумулятору перегреться или закипеть. Дополнительно элемент защищает основное вещество, свинец, от коррозии.
Используется для огнеупорных материалов и средств.
Соединения кальция применяются для получения:
- Водорода вне лаборатории из гидрида.
- Ацетилена и цианамида из карбида.
Каждый хоть раз видел мел, гипс, известняк. Первый используется для письма на досках, второй – в медицине и строительстве зданий, а третий – в качестве стройматериала, а также для пищевой, химической промышленности.
Из элемента поучают:
- негашеную известь (CaO – оксид);
- гашеную известь (Ca(OH)2 – гидроксид).
Отмечают биологическую роль элемента. Живым организмам он нужен для нормального сердцебиения. Его ионы участвуют в передаче сигнала по нервным клеткам, в работе мышц, в процессе свертывания крови.
Без кальция не существовало бы многих отраслей промышленности и даже жизни, так как он является важным макроэлементом.
А что вам известно о кальции? Сохраняйте статью, чтобы не потерять полезную информацию, делитесь ею в социальных сетях.
Также рекомендуем посмотреть подобранные видео по нашей теме.
Различные опыты с кальцием.
Химический элемент кальций.
Карбонат и гидрокарбонат кальция.
- https://www.chem100.ru/elem.php?n=20
- https://allmetalls.ru/ca.html
- https://ru.wikipedia.org/wiki/Кальций
- http://www.mining-enc.ru/k/kalcij
Источник: obrazovanie.guru
История и происхождение кальция
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат.Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета, лёгкий металл (немногим лишь тяжелее воды), ковкий, не загрязнённый примесями, обладает хорошей пластичностью и поддаётся всем видам обработки давлением.
Ка́льций — элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca (лат.Calcium). Простое вещество кальций (CAS-номер: 7440-70-2) — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета, лёгкий металл (немногим лишь тяжелее воды), ковкий, не загрязнённый примесями, обладает хорошей пластичностью и поддаётся всем видам обработки давлением.
Гемфри Дэви (английский химик) открыл этот элемент во время знаменитой «атаки» на щелочные земли в 1808году выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть.
В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием. Вольтов столб 1 в руках ученого продолжал творить чудеса. Известняк, разбитый энергией электричества, «отдал» в руки ученых удивительно агрессивный металл — кальций. Сообщение об этом открытии вызвало большой интерес в научном мире.
В 1855 году Бунзен и Матиссен получили чистый кальций электролизом расплавленного хлористого кальция. Только в 1896 году в Германии разработан промышленный способ получения кальция. В 1938 году А. И. Войницкий предложил технологию вакуумно-термического восстановления оксида кальция, а в конце Второй мировой войны в США алюминотермический способ получения кальция получил промышленное применение.
Название элементу дано от латинского слова «кальке», что в переводе на русский язык означает «известь, мягкий камень».
Чистый оксид кальция впервые описан немецким ученым-химиком И.Потт. Это произошло в 1746 году. Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А.Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Если кусочек кальция нагреть, он сгорает пламенем кирпично-красного цвета с образованием белого дыма. Плотность кальция меньше плотности алюминия, магния и бериллия. На воздухе он быстро окисляется, а при небольшом нагреве сгорает ярко-красным пламенем. Из горячей воды кальций бурно вытесняет водород, образуя гидрооксид кальция.
Он активно соединяется с галогенами, серой, азотом, в струе водорода образует гидрид, при нагревании восстанавливает металлы из оксидов. Это свойство кальция применяют металлурги, добавляя его в расплавленный металл для связывания растворенного кислорода.
В наружной оболочке атома кальция два валентных электрона, довольно непрочно связанных с ядром. Поэтому-то в чистом виде кальция в природе не найти. Но он — обычная составная часть силикатных пород, наиболее часто встречающихся в земной коре.
Кальций обладает большой химической активностью. В ряду напряжений он располагается среди наиболее электроотрицательных металлов. При комнатной температуре кальций не реагирует с сухим воздухом. В порошкообразном состоянии при нагревании до 300°С он горит в кислороде, а при температуре выше 300°С взаимодействует с азотом, образуя нитрид Ca3N2.
Во влажном воздухе кальций покрывается слоем гидроокиси. При температуре выше 400°С он образует с водородом гидрид Ca и интенсивно реагирует с галогенами. В концентрированных растворах NaOH и в растворах соды кальций почти не разрушается. Слабо действуют на кальций крепкая серная и азотная кислоты. Сильно действуют на кальций водные растворы соляной и азотной кислот.
Кальций впервые получен Дэви в 1808 г. с помощью электролиза. Но, как и другие щелочные и щелочноземельные металлы, элемент №20 нельзя получить электролизом из водных растворов. Кальций получают при электролизе его расплавленных солей.
Это сложный и энергоемкий процесс. В электролизере расплавляют хлорид кальция с добавками других солей (они нужны для того, чтобы снизить температуру плавления СаСl2).
Стальной катод только касается поверхности электролита; выделяющийся кальций прилипает и застывает на нем. По мере выделения кальция катод постепенно поднимают и в конечном счете получают кальциевую «штангу» длиной 50. 60 см. Тогда ее вынимают, отбивают от стального катода и начинают процесс сначала. «Методом касания» получают кальций сильно загрязненный хлористым кальцием, железом, алюминием, натрием. Очищают его переплавкой в атмосфере аргона.
Если стальной катод заменить катодом из металла, способного сплавляться с кальцием, то при электролизе будет получаться соответствующий сплав. В зависимости от назначения его можно использовать как сплав, либо отгонкой в вакууме получить чистый кальций. Так получают сплавы кальция с цинком, свинцом и медью.
Отличительной особенностью схемы является утилизация выделяющегося при электролизе хлора, оборот катодного медно-кальциевого сплава, а также использование тепла отходящих газов для повышения концентрации хлорида кальция в чистом растворе.
Технологическая схема электролитического получения кальция
Источник: www.myunivercity.ru
Кальций
Кальций — химический элемент с атомным номером 20 в периодической системе, обозначается символом Ca ( лат. Calcium ), мягкий щелочноземельный металл серебристо-серого цвета.
- 1 Истрия названия и открытия
- 2 Нахождение в природе и получение
- 2.1 Руды и минералы
- 2.2 Мировые ресурсы
- 2.3 Производство чистого элемента
- 5.1 Металлургия
- 5.2 Ядерная энергетика
- 5.3 Электроника
- 5.4 Медицина
- 5.5 Оптика
- 5.6 Прочие области применения
Истрия названия и открытия [ править | править код ]
Нахождение в природе и получение [ править | править код ]
Руды и минералы [ править | править код ]
Мировые ресурсы [ править | править код ]
Производство чистого элемента [ править | править код ]
Физические свойства [ править | править код ]
Химические свойства [ править | править код ]
Применение [ править | править код ]
Металлургия [ править | править код ]
Ядерная энергетика [ править | править код ]
Электроника [ править | править код ]
Медицина [ править | править код ]
Оптика [ править | править код ]
Прочие области применения [ править | править код ]
Цены [ править | править код ]
Изотопы [ править | править код ]
Основная статья: Изотопы кальция
Биологическая роль [ править | править код ]
См.также [ править | править код ]
- Соединения кальция
- Названия химических элементов на различных языках
Литература [ править | править код ]
- Доронин Н. А. Кальций, Госатомиздат, 1962. 191 с. с ил.
Ссылки [ править | править код ]
- Кальций на Webelements
- Кальций в Популярной библиотеке химических элементов
- Химические элементы
- Щёлочноземельные металлы
- Радиоактивные элементы
- Высокоопасные вещества
- Кальций
Источник: traditio.wiki
