202. Зеленовато-желтый мелкокристаллический порошок без запаха, горького вкуса. Очень мало растворим в воде, мало растворим в спирте, практически нерастворим в эфире, растворим в щелочах — это лекарственное средство:
203. Бутадион обладает кислотными свойствами:
1. за счёт подвижного атома водорода в 4-ом положении
2. за счёт способности окисляться
3. вследствие гидролиза
4. из- за наличия дифенилгидразина
5. из- за наличия бутильного радикала
204. Белый кристаллический порошок без запаха, слабокислого вкуса. Трудно растворим в воде и спирте, растворим в горячей воде, очень мало растворим в эфире — это лекарственное средство:
2. никотиновая кислота
4. кальция лактат
5. адреналина гидрохлорид
205. Крупно-игольчатый кристаллический порошок без запаха, горьковатого вкуса, в присутствии влаги быстро разлагается. Водные растворы при стоянии желтеют- это лекарственное средство:
206. Реакцию идентификации бутадиона с раствором меди сульфата следует проводить:
ОГЭ химия добротин 20 вариант
1. при нагревании
2. в нейтральной среде
3. с добавлением небольшого количества щёлочи
4. в кислой среде
5. с добавлением избытка щёлочи
207. По химическому строению фурацилин является:
1. производным изоникотиновой кислоты
2. производным хинолина
3. производным фурана
4. производным пиразола
5. производным пиперидина
208. По химическому строению пилокарпина гидрохлорид является:
1. производным имидазола
2. производным пиразола
3. производным пиридина
4. производным пара-аминофенола
5. производным пиримидина
209. Осаждается из растворов минеральными кислотами:
2. натрия гидрокарбонат
4. кислота аминокапроновая
5. натрия салицилат
210. По химическому строению анальгин является:
1. ацетаминопроизводным ароматического строения
2. производным имидазола
3. производным пиразолидина
4. производным пиразола
5. производным изохинолина
211. Для идентификации антипирина можно использовать реакцию:
1. с раствором хлорида железа (III) — синее окрашивание
2. с раствором меди сульфата — осадок кирпично-красного цвета
3. с раствором меди сульфата — фиолетовое окрашивание
4. с концентрированной серной кислотой — ярко-желтое окрашивание, переходящее в кирпично-красное
5. с раствором хлорида железа (III) — красное окрашивание
212. Для идентификации анальгина можно использовать реакцию:
1. выделения аммиака при нагревании со щелочью
2. осаждения неорганической кислотой
3. образования соли голубого цвета с раствором меди сульфата
4. образования красновато-серебристого осадка с раствором йода в кислой среде
5. образования малинового окрашивания, а затем бурого осадка с раствором калия йодата в кислой среде.
213. Для идентификации бутадиона можно использовать реакцию:
1. с раствором серебра нитрата — белый крислаллический осадок
Полный разбор варианта ОГЭ | Химия 2023 | Умскул
2. с раствором меди сульфата и раствором роданида аммония — зеленое окрашивание
3. с раствором хлорида железа (III) — красное окрашивание
4. с раствором меди сульфата — соль серого, а затем бледно-голубого цвета
5. с раствором меди сульфата и раствором роданида аммония — зеленое окрашивание
214. Количественное определение парацетамола проводят методом:
3. нитритометрии (после гидролиза)
215. Количественное определение антипирина можно провести методом:
1. йодометрии — прямое титрование
2. йодометрии — обратное титрование
3. нейтрализации после гидролиза
Источник: studopedya.ru
Презентация на тему Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
Доказательство подлинности катиона кальцияРеакция осаждения с раствором аммония оксалатаМетодика. К 0,5 мл препарата прибавляют 0,15-0,25 мл 4% раствора аммония оксалата; образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30% и 10%
- Главная
- Разное
- Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
Слайды и текст этой презентации
Слайд 1 Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по
фармацевтической химии для студентов 3 курса
Анализ раствора кальция хлорида 5%-200

Слайд 2Доказательство подлинности катиона кальция
Реакция осаждения с раствором аммония оксалата
Методика. К
0,5 мл препарата прибавляют 0,15-0,25 мл 4% раствора аммония оксалата;
образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30% и 10% растворе аммиака, растворимый в разведенных
минеральных кислотах.
Раствор
кальция хлорида 5%-200 мл
Подлинность

Слайд 3Реакция осаждения с раствором аммония оксалата
белый осадок кальция
оксалата
Раствор
кальция хлорида 5%-200
мл
Подлинность

Слайд 4осадок не растворим в растворе аммиака
осадок не растворим в уксусной
кислоте
+NH4OH
+CH3COOH
Осадок кальция оксалата

Слайд 5осадок растворим в хлористоводо-родной
кислоте
+HCl
осадок растворим в хлористоводо-родной
кислоте
Осадок кальция оксалата

Слайд 6Доказательство подлинности хлорид-иона
Реакция осаждения с раствором серебра нитрата
0,5 мл препарата прибавляют по 2-3 капли азотной кислоты разведенной
16% и 2% раствора серебра нитрата. Образуется белый творожистый осадок, нерастворимый в азотной кислоты разведенной 16% и растворимый в растворе аммиака.
Раствор
кальция хлорида 5%-200 мл
Подлинность

Слайд 7Реакция осаждения с раствором серебра нитрата
белый творожистый
осадок
серебра
хлорида
Раствор
кальция хлорида 5%-200 мл
Подлинность

Слайд 8
осадок серебра хлорида не растворился
осадок серебра хлорида растворился
+ HNO3 разв.

Слайд 9Комплексонометрический метод (прямое титрование)
Титрант: 0,05 М раствор трилона Б.
Индикатор: хромовый
темно-синий.
Среда: аммиачный буфер с рН 9,5-10,0.
Переход окраски от красной к
сине-фиолетовой.
Содержание кальция хлорида в препарате рассчитывают по формуле:
Раствор
кальция хлорида 5%-200 мл
Количественное определение

Слайд 10Комплексонометрический метод
В точке эквивалентности:
окраска раствора за счет
свободного индикатора
CaInd +
Na2H2ТrБ CaNa2ТrБ + H2Ind
Раствор
кальция хлорида 5%-200 мл
Количественное определение
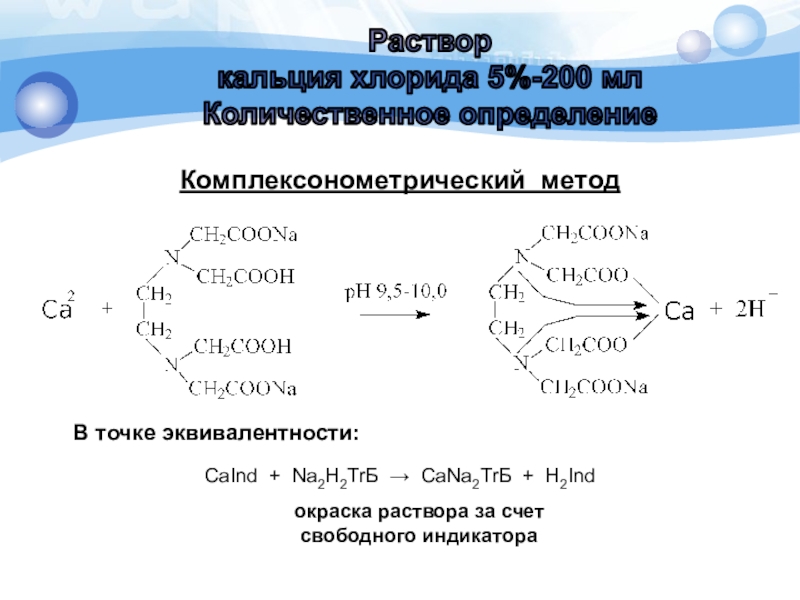
Слайд 11Комплексонометрический метод
(прямое титрование)
К 1 мл препарата прибавляют 5 мл
воды, 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси
хромового темно-синего и титруют 0,05М раствором трилона Б до сине-фиолетового
окрашивания.
Раствор
кальция хлорида 5%-200 мл
Количественное определение

Слайд 12
Отмеривают пипеткой навеску препарата

Слайд 13Прибавляют воду очищенную

Слайд 14Прибавляют аммиачный буферный раствор

Слайд 15Прибавляют индикаторную смесь
хромового темно-синего

Слайд 16Окраска раствора до начала титрования

Слайд 17
Титруют раствором трилона Б до сине-фиолетового окрашивания

Слайд 18Окраска раствора в конце титрования

Слайд 19
Список литературы
Беликов, В.Г. Фармацевтическая химия / 4-е
изд., перераб. и доп. – М., МЕДпрессинформ», 2008. – 613
с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
Государственная фармакопея Российской Федерации [Текст]. – 12-е изд. – М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. – 696 с.
Практическое руководство к лабораторным занятиям по фармацевтической химии для студентов III курса / Т.И. Ярыгина, О.Л. Визгунова, В.А. Дубовик и др. / под ред. Л.М. Коркодиновой – Пермь, 2011. – 102 с.
Руководство к лабораторным занятиям по фармацевтической химии: учеб. пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. / под. ред. А.П.
Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина, 2001. – 384 с. : ил.1.

Слайд 20Иллюстрированные методики подготовили:
Саттарова Ольга Евгеньевна, доцент кафедры фармацевтической химии факультета очного
обучения
ГБОУ ВПО ПГФА, кандидат фармацевтических наук,
директор Центра дистанционного обучения. Ярыгина Татьяна
Ивановна, профессор кафедры фармацевтической химии факультета очного обучения ГБОУ ВПО ПГФА, доктор фармацевтических наук.
Источник: theslide.ru