9,45 . 10 — 26 м 2 и 3,3 . 10 — 30 м 2 (для прир. смеси изотопов 6,7 — 7,1 . 10 — 27 м 2 ). Конфигурация внеш. электронной оболочки 2s 1 ; степень окисления +1; энергия ионизации Li° : Li + 5,39178 эВ; сродство к электрону 0,591 эВ; электроотрицательность по Полингу 0,95; ат. радиус 0,157 нм, ионный радиус Li + (в скобках приведены координац. числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8). Содержание лития в земной коре 6,5 . 10 — 3 % по массе. Осн. минералы: сподумен LiAl[Si 2 O 6 ], лепидолит KLi 1,5 Al 1,5 [Si 3 AlO 10 ](F,OH) 2 и петалит (Li,Na)[Si 4 AlO 10 ]. Перспективные источники сырья для произ-ва лития — межзернистая рапа соленосных отложений (41% мировых экзогенных запасов) и подземные воды (до 10 мг/л). Общие запасы Li 2 O в недрах и водах зарубежных стран, кроме вод Мирового океана, составляют ок. 24 млн. т. наиб. крупные разведанные месторождения пром. руд находятся в СССР, США, Канаде, Чили, Зимбабве, Бразилии и Намибии.
Свойства. Литий — серебристо-белый металл. Выше — 193°С существует модификация с кубич. объемноцентрир. решеткой, а = 0.350 нм, z = 2, пространств. группа Im3m, плотн. 0,533 г/см , ниже — 193°С она переходит в гексагoн. плотноупакованную форму, а = 0,308 нм, с = 0,482 нм, z = 2, пространств. группа Р6 3 /ттс. Т. пл.
Литий — самый легкий металл на Земле.
180,54 °С, т. кип. 1340°С; С 0 p 24,86 Дж/(моль . K); D H 0 пл 3,0 кДж/моль, D H 0 возг 159,3 кДж/моль (298,15 К); S 0 298 29,12 Дж/(моль . К); теплопроводность 246,0 Вт/(м . К) при 0 °С и 172,2 Вт/(м . К) при 427 °С; r 8,12 мкОм . см при 0°С и 25,55 мкОм . см при 227 °С; парамагнетик, магнитная восприимчивость +1,42 . 10 — 5 ; g 0,3983 Н/м при 181 °С и 0,3778 Н/м при 327 °С; h 5,307 . 10 — 4 Па . с при 227°С и 3,584 . 10 — 4 Па . с при 427 o С температурный коэф. линейного расширения 5,6 . 10 К -1 , объемного расширения 9,2 . 10 — 8 К — 1 (273-451 К).Л итий — мягкий и пластичный металл, может обрабатываться прессованием и прокаткой; твердость по Бринеллю 7850 Па, модуль упругости 4,9 ГПа, s раст 1,16 МПа.
Мн. хим. р-ции лития протекают менее энергично, чем у др. щелочных металлов. С совершенно сухим воздухом он практически не реагирует при комнатной т-ре и окисляется в нем только при нагревании. Во влажном воздухе образует преим.
Li 3 N, при влажности воздуха более 80% — LiOH и Li 2 CO 3 . С сухим О 2 при комнатной т-ре не реагирует, при нагр. горит голубым пламенем с образованием Li 2 O; для чистого лития т. всп. 640 °С. С водой реагирует, давая LiOH и выделяя Н 2 без плавления и вспышки; расплав лития при контакте с водой взрывает.
Литий непосредственно соединяется с F 2 , Сl 2 и Вr 2 , а при нагр. и с I 2 . С разб. к-тами взаимод. бурно, давая соли и выделяя Н 2 . В жидком NH 3 раств., образуя синий р-р с металлич. проводимостью. В этом р-ре литий медленно реагирует с NH 3 (катализатором служит влага) с выделением Н 2 и образованием LiNH 2 . С Н 2 при 500 °С дает лития гидрид LiH, при небольшом нагревании в токе сухого N 2 -нитрид Li 3 N, с расплавленной S — сульфид Li 2 S, при нагр. в токе С 2 Н 2 или С 2 Н 4 — карбид Li 2 C 2 . Литий легко сплавляется почти со всеми металлами и хорошо раств. в ртути.
ЛИТИЙ из СПИРТА и ЖИЖЫ
С Mg, Zn и Аl образует твердые р-ры, с Ag, Hg, Mg, Zn, Tl, Al, Pb, Bi и др. — интерметаллиды (напр., LiAg, LiHg, LiMg 2 , Li 2 Zn 3 ). Важнейшим соед. лития посвящены отдельные статьи (см., напр., Литийорганические соединения, Лития гидроксид, Лития карбонат, Лития оксид, Лития фторид). Ниже приводятся сведения о др. важных соед. лития. Амид LiNH 2 — 6ecцв. кристаллы, с тетрагон. решеткой; т. пл. 430 °С; плотн.
1,178 г/см 3 (17,5°С); с водой образует LiOH и NH 3 , с к-тами — соли лития и аммония; во влажном воздухе медленно гидролизуется, при нагр. до 450 °С переходит в Li 2 NH с выделением NH 3 . Применяется как катализатор. Нитрид Li 3 N — зеленовато-черные кристаллы с гексагон. решеткой (а = 0,366 нм, с = 0,388 нм, z = 1, пространств. группа P/6mmm); т. пл. 813°С; плотн.
1,38 г/см 3 ; С 0 p 75,2 Дж/(моль . К); D H 0 обр -164,0 кДж/моль; S 0 298 62,6 Дж/(моль . К); энергично взаимод. с водой с образованием LiOH и NH 3 ; при нагр. в среде Н 2 переходит в LiH с выделением NH 3 . Сульфид Li 2 S — зеленовато-желтые кристаллы с кубич. решеткой (а = 0,571 нм, z = 4, пространств. группа Fm3m); т. пл. 1370°С; плотн. 1,63 г/см 3 ; D H 0 обр -447,3 кДж/моль; S 0 298 62,8 Дж/(моль . К); О 2 , Н 2 О 2 , КСlO 3 , РbО 2 и др. окисляют Li 2 S при 300 °С до Li 2 SO 4 ; с Н 2 не взаимод. даже при высокой т-ре; водой легко гидролизуется.
Получение. Минералы лития в зависимости от состава разлагают H 2 SO 4 (кислотный способ) или спеканием с СаО и СаСО 3 (щелочной способ), K 2 SO 4 (солевой способ), СаСО 3 и СаСl 2 (щелочно-солевой способ).
По первому методу получают р-р Li 2 SO 4 , к-рый освобождают от примесей обработкой Са(ОН) 2 и Na 2 CO 3 . При выщелачивании спека водой при щелочном методе в р-р переходит LiOH, при солевом — Li 2 SO 4 , при щелочно-солевом — LiCl. Все эти методы, кроме щелочного, предусматривают получение готового продукта в виде Li 2 CO 3 , используемого непосредственно и служащего источником для синтеза др. соединений лития.
Металлич. литий получают электролизом расплавл. смеси LiCl и КСl (или ВаСl 2 ) с послед. очисткой от примесей вакуумной дистилляцией, ректификацией или зонной плавкой. Его также получают вакуум-термич. восстановлением LiAlO 2 алюминием при 13-66 Па и 1150-1200°С, Li 2 O -кремнием или алюминием в присут. СаО при 950-1000 °С и 0,1 Па, сподумена — ферросилицием в присут. СаСО 3 при 1050-1150 °С и 1,3-4,0 Па.
Определение. Качественно литий обнаруживают по карминово-красному окрашиванию пламени горелки летучими соед. лития и по наиб. четко выраженным спектральным линиям лития: 670,78 и 610,36 нм. Количественно литий определяют пламенно-фотометрич. (при содержании лития в пробе 0,1-10%), спектрографич. и гравиметрич. методами. В последнем случае литий отделяют от др. щелочных металлов в виде LiCl экстракцией безводным ацетоном, после отделения LiCl переводят в Li 2 SO 4 , к-рый прокаливают и взвешивают. Литий определяют также фотометрически с помощью хиназолиназо (при содержании лития в пробе 4 . 10 — 4 — 6 . 10 — 2 %), флуориметрически — с помощью 5,7-дибром-8-гидроксихинолина (предел обнаружения 0,1 мкг/мл лития).
Применение. Литий используют: в произ-ве анодов для хим. источников тока на основе неводных и твердых электролитов; как компонент сплавов с Mg и Аl, антифрикц. сплавов (баббитов), сплавов с Si для изготовления холодных катодов в электровакуумных приборах; для раскисления, дегазации, модифицирования и рафинирования Сu, медных, цинковых и никелевых сплавов с целью улучшения их структуры и повышения электрич. проводимости; как катализатор полимеризации (напр., изопрена), ацетилирования и др.
Жидкий литий — теплоноситель в ядерных реакторах. Изотоп 6 Li используют для получения трития. Мелкие крошки лития вызывают хим. ожоги влажной кожи и глаз. Загоревшийся литий засыпают NaCl или содой.
Хранят литий в герметически закрытых жестяных коробках под слоем пастообразной массы из парафина и минер. масла или в тонкостенных алюминиевых или медных оболочках; допускается хранение под слоем газолина или петролейного эфира. Отходы утилизируют обработкой этанолом с послед. разложением образовавшегося этилата водой. Л итий открыл А. Арфведсон в 1817, металлич. литий получил впервые Г. Дэви в 1818.
===
Исп. литература для статьи «ЛИТИЙ» : Плющев В. Е., Степин Б. Д., Химия и технология соединений лития, рубидия и цезия, М., 1970; Теплофизические свойства щелочных металлов, под ред. В. А. Кириллина, М., 1970; Полуэктов Н. С., Мешкова С. Б., Полуэктова Е. Н., Аналитическая химия лития. М., 1975; Hart W. A., Beumel О. F., Whaley Т. P., The chemistry of lithium, sodium, potassium, rubidium, cesium and francium, Oxf., 1975 (Pergamon texts in inorganic chemistry, v. 13). Б. Д. Cmenин.
Страница «ЛИТИЙ» подготовлена по материалам химической энциклопедии.
Еще по теме:
- Литий-висмут — справочник по веществам
- Литий — справочник по веществам
Источник: xumuk.ru
2.1.4. Сплавы лития с металлами
Литий, как было сказано ранее, образует сплавы со многими металлами, из которых наибольший интерес представляют сплавы Li-Al и Li-Mg.
Сплавы Li-Al.В системе Li-Al образуются интерметаллиды AlLi и AlLi2, предполагается также образование метастабильного Al3Li. Растворимость лития в алюминии максимальна при температуре эвтектики (600 ºC) и составляет ~30 ат.%, при понижении температуры уменьшается и при 15ºC равна 6,8 ат.%. Растворимость алюминия в литии ничтожна.
Интерметаллид AlLi имеет широкую область гомогенности (1,5-56 ат. % Li) (рис. 8). Высокая растворимость лития в алюминии объясняется близостью ионных радиусов и одинаковой структурой (ГЦК). Введение лития сообщает алюминиевым сплавам повышенную коррозионную устойчивость, повышенную пластичность.
Рис. 8. Диаграмма состояния системы Al — Li
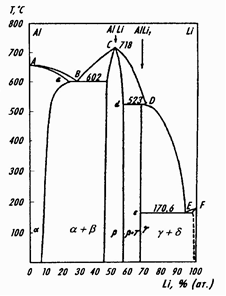
Сплавы Li-Mg. В системе Li-Mg образуется один интерметаллид LiMg2с Тпл.около 600 ºC и широкой областью гомогенности (29-95 ат. % Li), это объясняется близким значением атомных и ионных радиусов лития и магния. Алюминий и магний являются важнейшими металлами, на основе которых создаются легкие сплавы для авиа-космической техники.
Однако магний обладает недостаточной ковкостью, хрупок при низких температурах, что устраняется введением в состав сплава лития (до 4,6 ат. %). В настоящее время литий занимает особое место среди легирующих металлов для магния.
2.2. Важнейшие области применения лития и его соединений
Благодаря своим уникальным свойствам литий играет важную роль в индустриальном развитии современного общества. Области его практического применения, неразрывно связанные с применением высоких технологий, весьма разнообразны и включают:
- производство первичных и вторичных аккумуляторных батарей;
- производство химических компонентов для ядерных энергетических реакторов;
- производство специальных масел и смазок;
- производство стекла, керамики и синтетических волокон;
- производство первичного алюминия;
- металлургию легких конструктивных сплавов;
- производство хладагентов и систем осушки воздуха;
- производство дезинфицирующих средств и др.
Металлургия алюминия.Одна из наиболее важных и традиционных областей применения лития – применение его в электролитическом получении алюминия. Добавка карбоната лития (Li2CO3) в электролитическую ванну позволяет снизить температуру плавления электролита, уменьшить выделение фтора, увеличить электропроводность электролита, уменьшить расход анода и криолита (K3AlF6) и, следовательно, уменьшить расход электроэнергии, т.е. снизить себестоимость металла. На 1 тонну алюминия расходуется 2,5-3,5 кг Li2CO3. Потребление лития растет с каждым годом пропорционально объему мировой добычи алюминия. Ядерная энергетика– это главная применения лития, делающая его одним из важнейших металлов. Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и среда их применения различна. Гафнат лития входит в состав специальных ядерных отходов, содержащих плутоний. Изотоп Li-6 применяется в термо-ядерной энергетике. При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный изотоп тритий: 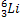
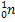 =
= 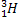 +
+ 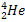 (21) Благодаря этому 6 Li может применяться как замена радиоактивного нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития 6LiD. Изотоп Li-7 используется в ядерных реакторах в качестве теплоносителя (часто в виде сплава с Na или Cs-133) для охлаждения реакторов. Использование лития как теплоносителя основано на том, что он имеет большой диапазон жидкого состояния при малой плотности и высокой теплопроводности. Фторид 7 Li в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосиловых реакторах. Смазочные материалы.В авиации и военной технике широко применяются литиевые консистентные смазки, содержащие до 10 % стеарата лития. Они сохраняют уникальные физические свойства в температурном интервале от — 50 до + 150 ºC. Силикатная промышленность.Высококачественные концентраты минералов лития, а также Li2CO3, Li2SiO3широко используются в производстве стекла и керамики, Добавки лития повышают химическую и физическую устойчивость. Глазури и эмали с добавкой лития более плотны, блестящи, устойчивы к атмосферным воздействиям. Добавки лития используются в производстве стекла для катодно-лучевых трубок, сверхчувствительных, легкоплавких и других специальных стекол. При варке стекла добавки лития снижают температуру плавления и вязкости расплава. Литий как дегазатор и рафинирующий агент. Так как литий химически активен, его используют для удаления газов из расплавленных металлов. Литий реагирует с водородом, кислородом, серой и азотом. Образующиеся при этом соединения имеют сравнительно низкие плотности и температуры плавления. Это важно для удаления твердых примесей из металла. Металлический литий обычно используют для дегазации меди, в особенности для получения отливок с высокой электропроводностью. Количество добавляемого лития составляет 0,01 % для бронз и 0,02 % для меди с высокой электропроводностью (вес отливки ~90 кг). Сплавы. Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием – новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии и, в перспективе, термоядерной энергетике. Литий эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии. Эффективны стандартные алюминиевые сплавы, дополнительно легированные 1-3 % лития для использования в авиаракетокосмической технике. Пример такого сплава, %: 94,98 Al; 2,2 Li; 2,7 Cu; 0,12 Zr. Плотность таких сплавов меньше плотности стандартных сплавов на 8-12 %, они более устойчивы к коррозии, прочностные характеристики сохраняются или улучшаются. Применение их в самолетостроении позволяет снизить массу самолета на 20 %. Применение этих сплавов сдерживается высокой стоимостью, которая в 6-10 раз выше стоимости конкурирующих композиционных материалов. Электроника.Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития, LiNbO3, и танталат, LiTaO3, являются нелинейными оптическими материалами и широко применяются в нелинейной и интегральной оптике. На их основе создаются устройства для модуляции и отклонения лазерного луча, устройства для обработки и отображения информации, запоминающие устройства. Лазерные материалы.Монокристаллы фторида лития используются для изготовления лазеров (КПД 80 %) на центрах свободной окраски и для изготовления оптики с широкой спектральной полосой пропускания. Кондиционирование воздуха.Высокогигроскопичный бромид, LiBr, и хлорид, LiCl, благодаря их способности поглощать дымы, пары H2O, CO2, NH3, органические вещества используют для кондиционирования воздуха в различных помещениях. Литий-ионные аккумуляторы.Литий-ионные аккумуляторы получили широкое распространение практически во всех сферах деятельности человека, начиная от бытовой техники и заканчивая оснащением космического оборудования, став в то же время объектом для исследований в направлении улучшения общей эффективности, долговечности и надежности. Классический литий ионный аккумулятор состоит из отрицательного графитового электрода (катод), положительного электрода (анод) и электролита, заполняющего пространство между электродами. В зависимости от типа анода литиевые элементы способны создавать напряжение от 1,5 до 3,6В, что выше, чем у любых других элементов. В качестве анода используется, как правило, оксид переходного металла, содержащего литий, например, кобальтит лития, литий-марганцевые шпинели (LiMn2O4); в последнее время показана перспективность использования более дешевого LiFeO4. Аккумуляторы такого типа используются в кардиостимуляторах, в портативных компьютерах. Они имеют большую плотность, чем металлогидридные, и работают без подзарядки в полтора раза дольше. Из рис. 9 видно, что процесс зарядки-разрядки батареи не ограничивается переносом только ионов лития. Одновременно в том же направлении происходит перенос электрона, так что убыль положительного заряда (Li + ) компенсируется уходом электрона, а прибыль положительного заряда (Li+) на катоде – приходом электрона. Перенос электронов осуществляется по внешнему токопроводу, соединяющих оба электрода. Уравнения основных реакций, протекающих в литий-ионном аккумуляторе: заряд: LiCoO2 – xLi+ – xē → Li1-xCoO2 (22) 6C + xLi+ + xē → LixC6 (23) разряд: Li1-xCoO2 + xLi+ + xē → LiCoO2 (24) Р
(21) Благодаря этому 6 Li может применяться как замена радиоактивного нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития 6LiD. Изотоп Li-7 используется в ядерных реакторах в качестве теплоносителя (часто в виде сплава с Na или Cs-133) для охлаждения реакторов. Использование лития как теплоносителя основано на том, что он имеет большой диапазон жидкого состояния при малой плотности и высокой теплопроводности. Фторид 7 Li в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосиловых реакторах. Смазочные материалы.В авиации и военной технике широко применяются литиевые консистентные смазки, содержащие до 10 % стеарата лития. Они сохраняют уникальные физические свойства в температурном интервале от — 50 до + 150 ºC. Силикатная промышленность.Высококачественные концентраты минералов лития, а также Li2CO3, Li2SiO3широко используются в производстве стекла и керамики, Добавки лития повышают химическую и физическую устойчивость. Глазури и эмали с добавкой лития более плотны, блестящи, устойчивы к атмосферным воздействиям. Добавки лития используются в производстве стекла для катодно-лучевых трубок, сверхчувствительных, легкоплавких и других специальных стекол. При варке стекла добавки лития снижают температуру плавления и вязкости расплава. Литий как дегазатор и рафинирующий агент. Так как литий химически активен, его используют для удаления газов из расплавленных металлов. Литий реагирует с водородом, кислородом, серой и азотом. Образующиеся при этом соединения имеют сравнительно низкие плотности и температуры плавления. Это важно для удаления твердых примесей из металла. Металлический литий обычно используют для дегазации меди, в особенности для получения отливок с высокой электропроводностью. Количество добавляемого лития составляет 0,01 % для бронз и 0,02 % для меди с высокой электропроводностью (вес отливки ~90 кг). Сплавы. Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием – новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии и, в перспективе, термоядерной энергетике. Литий эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии. Эффективны стандартные алюминиевые сплавы, дополнительно легированные 1-3 % лития для использования в авиаракетокосмической технике. Пример такого сплава, %: 94,98 Al; 2,2 Li; 2,7 Cu; 0,12 Zr. Плотность таких сплавов меньше плотности стандартных сплавов на 8-12 %, они более устойчивы к коррозии, прочностные характеристики сохраняются или улучшаются. Применение их в самолетостроении позволяет снизить массу самолета на 20 %. Применение этих сплавов сдерживается высокой стоимостью, которая в 6-10 раз выше стоимости конкурирующих композиционных материалов. Электроника.Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития, LiNbO3, и танталат, LiTaO3, являются нелинейными оптическими материалами и широко применяются в нелинейной и интегральной оптике. На их основе создаются устройства для модуляции и отклонения лазерного луча, устройства для обработки и отображения информации, запоминающие устройства. Лазерные материалы.Монокристаллы фторида лития используются для изготовления лазеров (КПД 80 %) на центрах свободной окраски и для изготовления оптики с широкой спектральной полосой пропускания. Кондиционирование воздуха.Высокогигроскопичный бромид, LiBr, и хлорид, LiCl, благодаря их способности поглощать дымы, пары H2O, CO2, NH3, органические вещества используют для кондиционирования воздуха в различных помещениях. Литий-ионные аккумуляторы.Литий-ионные аккумуляторы получили широкое распространение практически во всех сферах деятельности человека, начиная от бытовой техники и заканчивая оснащением космического оборудования, став в то же время объектом для исследований в направлении улучшения общей эффективности, долговечности и надежности. Классический литий ионный аккумулятор состоит из отрицательного графитового электрода (катод), положительного электрода (анод) и электролита, заполняющего пространство между электродами. В зависимости от типа анода литиевые элементы способны создавать напряжение от 1,5 до 3,6В, что выше, чем у любых других элементов. В качестве анода используется, как правило, оксид переходного металла, содержащего литий, например, кобальтит лития, литий-марганцевые шпинели (LiMn2O4); в последнее время показана перспективность использования более дешевого LiFeO4. Аккумуляторы такого типа используются в кардиостимуляторах, в портативных компьютерах. Они имеют большую плотность, чем металлогидридные, и работают без подзарядки в полтора раза дольше. Из рис. 9 видно, что процесс зарядки-разрядки батареи не ограничивается переносом только ионов лития. Одновременно в том же направлении происходит перенос электрона, так что убыль положительного заряда (Li + ) компенсируется уходом электрона, а прибыль положительного заряда (Li+) на катоде – приходом электрона. Перенос электронов осуществляется по внешнему токопроводу, соединяющих оба электрода. Уравнения основных реакций, протекающих в литий-ионном аккумуляторе: заряд: LiCoO2 – xLi+ – xē → Li1-xCoO2 (22) 6C + xLi+ + xē → LixC6 (23) разряд: Li1-xCoO2 + xLi+ + xē → LiCoO2 (24) Р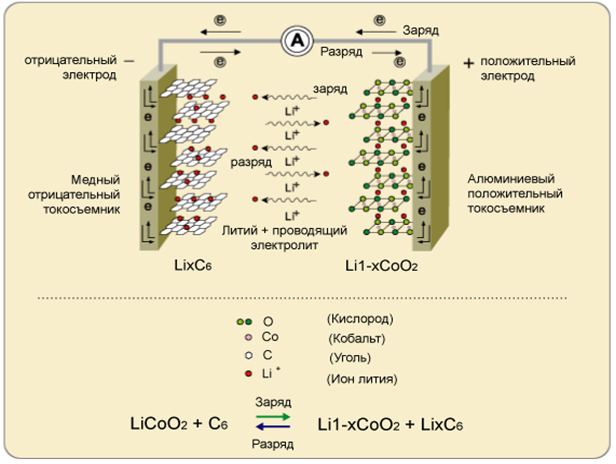 ис. 9. Механизм работы литий-ионного аккумулятора Технология производства литиевых аккумуляторов непрерывно совершенствуется в направлении поиска и усовершенствования материалов электродов и состава электролита. В 2009 году исследователи из Массачусетского технологического института (MIT) предложили новую технологию изготовления литий-ионных аккумуляторов, которая позволяет сократить время зарядки батарей с часов и десятка минут до секунд.
ис. 9. Механизм работы литий-ионного аккумулятора Технология производства литиевых аккумуляторов непрерывно совершенствуется в направлении поиска и усовершенствования материалов электродов и состава электролита. В 2009 году исследователи из Массачусетского технологического института (MIT) предложили новую технологию изготовления литий-ионных аккумуляторов, которая позволяет сократить время зарядки батарей с часов и десятка минут до секунд.
Источник: studfile.net
ЛИТИЙ СОДЕРЖАЩИЕ СПЛАВЫ

Сплавы в состав которых входит литий. С некоторыми металлами (магнием, цинком, алюминием) литий образует твердые растворы (значительной концентрации), со многими — интерметаллические соединения (LiAg, LiHg, LiMg и др.). Большинство интерметаллических соединений весьма тверды и тугоплавки, незначительно изменяются на воздухе, некоторые из них — полупроводниковые материалы.
Основное применение сплавов
Основное назначение литий сплавов — использование в качестве лигатур. Литиевые лигатуры (кремний — литий, алюминий — литий, железо — кремний — литий) и литий-кальциевые сплавы (30% Li, 70% Са) служат присадками к углеродистым, хромистым, аустенитным хромоникелевым и др. сталям, а также модификаторами литой малолегированной быстро-режущей стали.
В этом случае используют хорошее раскисляющее действие лития, его способность повышать жидко текучесть, мех. свойства и коррозионную стойкость сплавов. Оптимальные результаты добавка 0,03% Li. Литиевые лигатуры алюминии — литии, медь — литий, магний — литий и др. повышают коррозионную стойкость и улучшают мех. св-ва алюминия сплавов, модифицируют структуру силуминов (см. также Лигатура, Модифицирующие материалы).
Алюминиевые сплавы, содержащие 0,1% Li, 2—4% Сu и 12—13% Zn, легки, обладают высокой прочностью, пластичностью, стойки против коррозии, перспективны для авиа- и автомобилестроения, при изготовлении рам вагонов. Добавка лития (0,04%) повышает твердость и понижает коэффициент трения свинцовокальциевых антифрикционных сплавов.
Статья на тему литий содержащие сплавы
Похожие страницы:
Что такое германий содержащие сплавы Это сплавы германия с другими химическими элементами. С металлами германий образует германиды, с кремнием —.
ИТТРИЙ СОДЕРЖАЩИЕ СПЛАВЫ Сплавы, в состав которых входит иттрий. К иттрий содержащие сплавы относятся некоторые стали, чугуны, алюминиевые, кобальтовые и.
ЧТО ТАКОЕ ЦЕРИЙ СОДЕРЖАЩИЕ СПЛАВЫ Это сплавы, в состав которых входит церий. Применяются с 20-х гг. 20 в., в основном.
ЧТО ТАКОЕ КОБАЛЬТА СПЛАВЫ Это сплавы на основе кобальта. Отличаются малым коэфф. термического расширения — (15,9 — 16,5) 10-6 град-1.
Индий сплавы В которых индий является основным компонентом или определяет важные их свойства. Применяются с 30-х гг. 20 в. Индий.
ПРИМЕНЕНИЕ МАГНИЯ СПЛАВЫ В промышленном масштабе в первые получены в 1909 ( Германия ) под названием ( электрон ) Магний.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com