Введение 3
Глава I. Определение подлинности и количественное определение серебра нитрата 4
Глава II. Определение подлинности и количественное определение серебра в препаратах колларгол и протаргол. 9
Заключение 13
Список использованной литературы 14
Фрагмент для ознакомления
Полученный раствор исследуют методом тиоцианометрии.
3Ag +4HNO3 →3AgNO3 + NO↑ + 2H2O
AgNO3 + NH4SCN →AgSCN↓ +NH4NO3
Фактор стехиометричности f=1. Молярная масса эквивалента серебра равна М=107,9 г. 1 мл 0,1 М раствора аммония роданида соответствует 0,010709 г серебра, которого в препарате должно быть 7,8-8,3%.
Разработана методика количественного определения протаргола методом потенциометрического титрования. Данная методика не требует предварительного обеззоливания препарата.
Методика. 1 мл 2% раствора препарата «Протаргол» помещают в фарфоровую чашку и нагревают на водяной бане с азотной кислотой, взятой в трехкратном избытке до разложения органической основы и перехода коричневой окраски препарата в светло-желтую. Полученный раствор охлаждают, переносят в мерную колбу вместимостью 500 мл и разбавляют водой до метки. Для анализа отбирают аликвотную 50,00 мл полученного раствора. В качестве индикаторного электрода используют серебряный металлический электрод в паре с хлорид-серебряным электродом сравнения. В качестве титранта используют 0,01 М раствор иодида калия [11]
Производные имидазола и триазола.
2.4. Количественное определение колларгола. [13]
Количественное определение колларгола проводят методами аналогичными методам для количественного определения протаргола.
3Ag +4HNO3 →3AgNO3 + NO↑ + 2H2O
AgNO3 + NH4SCN →AgSCN↓ +NH4NO3
Фактор стехиометричности f=1. Молярная масса эквивалента серебра равна М=107,9 г. 1 мл 0,1 М раствора аммония роданида соответствует 0,010709 г серебра, которого в препарате должно быть 7,8-8,3%.
Методика. Около 0,2 г препарата (точная навеска) растворяют в 10 мл воды, затем добавляют 5 мл концентрированной азотной кислоты и взбалтывают. К желтоватому раствору прибавляют 100 мл воды и титруют 0,1 н. раствором роданида аммония до розового окрашивания (индикатор — железоаммониевые квасцы).
1 мл 0,1 н. раствора роданида аммония соответствует 0,01079 г серебра, которого в препарате должно быть не менее 70%.
Список использованной литературы
1.Беликов В.Г. Фармацевтическая химия. В 2 ч.: Учеб. пособие/В.Г. Беликов.- 4-е изд., перераб и доп.- М.: МЕДпресс-информ, 2007.- 624 с.
2.Государственная фармакопея СССР: Х1 издание. Вып.1.- М.: Медицина, 1987.-336 с.
3.Государственная фармакопея СССР: Х1 издание. Вып.2. М.: Медицина, 1986.-368 с.
4.Избранные лекции по фармацевтической химии. Ч1.Общая фармацевтическая химия, лекарственные средства неорганической природы./под. ред. Л.А. Чекрышкиной.- Пермь, 2012.-324 с.
5.Методы титриметрического анализа лекарственных веществ: Учеб.пособие/под общей ред. профессора Л.А. Чекрышкиной.- Пермь, 2012.- 131 с.
Фармацевтический анализ производных пиридина.
6.Руководство к лабораторным занятиям по фармацевтической химии: Учеб пособие/под ред. А.П. Арзамасцева.-3-е изд., перераб. и доп.- М.: Медицина, 2001.- 384 с.
7.Сливкин А.И. Функциональный анализ органических лекарственных веществ/А.И. Сливкин, Н.П. Садчикова; под ред. академика РАМН проф. А.П. Арзамасцева.- Воронеж: Воронежский гос. ун-т, 2007.- 426 с.
8.Фармацевтическая химия: Учеб. пособие/ под ред. А.П. Арзамасцева.-2-е изд., испр.- М.: ГЭОТАР – Медицина, 2008.- 640 с.
9.Физико-химические и биологические методы оценки качества лекарственных средств: учебное пособие / под ред. В.Г. Артюхова, А.И. Сливкина. – Воронеж: Издательство Воронежского государственного университета, 1999. – 368 с.
10. А.В. Халецкий. Фармацевтическая химия., Издательство «Медицина», Ленинградское отделение, 1966 г., — 382 с
11. С.В. Шумар. Потенциометрическое определение серебра с использованием математической модели процесса. Известия Томского политехнического университета. 2012.
Т.300, №3, стр116-119.
12. Мелентьева Г.А. Фармацевтическая химия. – М., Медицина, 1978 г. – 829 с.
13. Дудко В.В., Тихонова Л.А. Анализ лекарственных веществ по функциональным группам: Учебное пособие / Под ред. С.И. Краснова и М.С. Юсубова. – Томск, 2004, — 140 с.
Список использованной литературы
1.Беликов В.Г. Фармацевтическая химия. В 2 ч.: Учеб. пособие/В.Г. Беликов.- 4-е изд., перераб и доп.- М.: МЕДпресс-информ, 2007.- 624 с.
2.Государственная фармакопея СССР: Х1 издание. Вып.1.- М.: Медицина, 1987.-336 с.
3.Государственная фармакопея СССР: Х1 издание. Вып.2. М.: Медицина, 1986.-368 с.
4.Избранные лекции по фармацевтической химии. Ч1.Общая фармацевтическая химия, лекарственные средства неорганической природы./под. ред. Л.А. Чекрышкиной.- Пермь, 2012.-324 с.
5.Методы титриметрического анализа лекарственных веществ: Учеб.пособие/под общей ред. профессора Л.А. Чекрышкиной.- Пермь, 2012.- 131 с.
6.Руководство к лабораторным занятиям по фармацевтической химии: Учеб пособие/под ред. А.П. Арзамасцева.-3-е изд., перераб. и доп.- М.: Медицина, 2001.- 384 с.
7.Сливкин А.И. Функциональный анализ органических лекарственных веществ/А.И. Сливкин, Н.П. Садчикова; под ред. академика РАМН проф. А.П. Арзамасцева.- Воронеж: Воронежский гос. ун-т, 2007.- 426 с.
8.Фармацевтическая химия: Учеб. пособие/ под ред. А.П. Арзамасцева.-2-е изд., испр.- М.: ГЭОТАР – Медицина, 2008.- 640 с.
9.Физико-химические и биологические методы оценки качества лекарственных средств: учебное пособие / под ред. В.Г. Артюхова, А.И. Сливкина. – Воронеж: Издательство Воронежского государственного университета, 1999. – 368 с.
10. А.В. Халецкий. Фармацевтическая химия., Издательство «Медицина», Ленинградское отделение, 1966 г., — 382 с
11. С.В. Шумар. Потенциометрическое определение серебра с использованием математической модели процесса. Известия Томского политехнического университета. 2012.
Т.300, №3, стр116-119.
12. Мелентьева Г.А. Фармацевтическая химия. – М., Медицина, 1978 г. – 829 с.
13. Дудко В.В., Тихонова Л.А. Анализ лекарственных веществ по функциональным группам: Учебное пособие / Под ред. С.И. Краснова и М.С. Юсубова. – Томск, 2004, — 140 с.
Хранить лекарства перекись водорода в хорошо укупоренной таре, в защищенном от света месте. Раствор перекиси водорода и гидроперит используют как антисептики, а перекись магния — при желудочно-кишечных заболеваниях.
тиосульфат Натрия. Источник получения натрия тиосульфата — сульфиды и полусульфиды, которые подвергают окислению диоксидом серы или кислорода. Получают и через расплавленный ее кальциевой соли с сульфатом натрия.
Фармакопейный натрия тиосульфат, натрия кристаллогидрат. Он очень легко растворим в воде, практически нерастворимое в этаноле. Препарат дает характерные реакции на натрий-ион, его обнаруживают образованию опалесценции (вследствие выделения серы) и появлению запаха (диоксида серы) при добавлении к раствору препарата соляной кислоты. Для испытания подлинности и количественного определения используют окислительно-восстановительную реакцию натрия тиосульфата с йодом.
Поскольку препарат назначают, в том числе внутривенно, в больших дозах, проверяет на чистоту. В соответствии с требованиями ГФ и ФС устанавливают прозрачность и цвета 30% — ного раствора, щелочность 10% — ного раствора, максимальное количество примесей хлоридов, сульфидов, сульфитов и сульфатов, кальция, тяжелых металлов, железа, мышьяка и селена.
Хранить в хорошо укупоренной таре, учитывая, что в сухом тяжелом воздухе он выветривается и влажный, слегка расплывается, при 50 °С плавится в кристаллизационной воде.
Препарат используют как противотоксическое (антидотное) и десенсибилизирующее средство, если цианидами, ртутью, мышьяком, таллием, свинцом и при аллергических состояний.
Серы. находится в свободном состоянии (самородная сера) и в виде минералов, содержащих помимо серы и другие элементы. В медицинской практике применяется серу очищенную и серу осажденную.
Серу очищенную получают из серного цвета (самородная руда) путем тщательной очистки от примесей, в частности, токсичные — сульфида мышьяка, сернистой и серной кислоты. Серу осажденную получают путем тщательного измельчения очищенной серы или кипения в присутствии гидроксидов. Сера очищенная нерастворима в воде, мало растворима в эфире, а сера осажденная нерастворима в воде, растворима в жирных маслах (при нагревании на водяной бане) и при кипячении в смеси с раствором гидроксида натрия и этанола.
Определить подлинность серы может запах оксида серы образуется при обжиге, и характерной (синей) окраски пламени. Раствор серы в горячем пиридине от добавления нескольких капель раствора гидрокарбоната натрия после кипячения окрашивается в голубой или зеленый. Препарат подвергают испытанию на наличие мышьяка, селена, сульфидов и др.
Источник: www.homework.ru
ФАРМАКОПЕЙНЫЙ МЕТОД КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПЕРОКСИДА ВОДОРОДА
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Рекомендуем для прочтения:
Органы внутренних дел РФ: понятие, задачи, система органов Основную деятельность по обеспечению защиты жизни, здоровья, прав и свобод человека и гражданина в Российской Федерации.
Заработная плата: понятие, виды, формы, дифференциация Под заработной платой понимается цена, выплачиваемая за использование труда наемного работника.
Задатки и способности. Виды способностей «Способности — свойства и качества (индивидуальные особенности) человека.
СЕСТРИНСКИЙ ПРОЦЕСС ПРИ ЛИХОРАДКЕ I этап. Сестринское обследование. Медицинская сестра устанавливает доверительные отношения с пациентом и выясняет.
Кривые второго порядка 1. Цель работы Приобретение умений построения кривых второго порядка в декартовой прямоугольной системе координат и составления их.
Сейчас читают про:







Источник: studopedia.ru
Химические методы установления подлинности
Установление подлинности неорганических Л В основано на обнаружении с помощью химических реакций катионов и анионов, входящих в состав их молекул. С точки зрения приемов выполнения испытаний и получаемых при этом результатов можно выделить несколько общих способов.
Эту же реакцию используют для обнаружения фосфат-ионов. Арсенат-иопы дают аналогичные результаты:

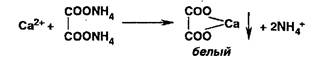
Попы калия осаждают винной кислотой:
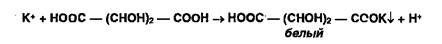
Ионы натрия осаждают цинкуранилацетатом:
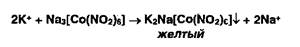
Ионы калия мож-чо осадить раствором гексанитрокобальтата (III) натрия:
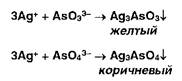
Некоторые реакции осаждения можно использовать для обнаружения и катионов, и анионов.
Попы магния образуют в присутствии фосфат- и аммоний-ионов осадок фосфата магния-аммония:

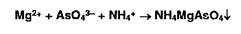
Фосфат-ионы образуют с раствором молибдата аммония желтый осадок фосфор-молибдата аммония:

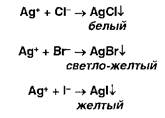
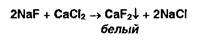
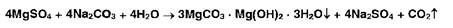
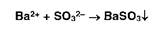
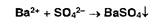
Ионы бария образуют белый осадок с сульфат-ионами: Аналогичную реакцию дают сульфиты:
Сульфит бария, в отличие от сульфата бария, растворим в хлороводородной кислоте. Ионы фтора открывают реакцией осаждения из раствора хлорида кальция:
Ионы серебра образуют осадки с хлоридами, бромидами, йодидами:
Образующиеся галогениды различаются по растворимости в растворе аммиака. Желтый осадок образуют ионы серебра с фосфатами:
Образует осадки ион серебра также с арсенит- и арсенат-ионами:
Ионы магния с растворами карбонатов образуют белый осадок основного карбоната магния:
Ионы железа (III) в растворе приобретают красное окрашивание в присутствии роданид-ионов, образуя малодис- социирующее соединение:
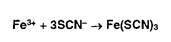
Ряд реактивов образуют белые или окрашенные осадки с несколькими катионами. Ионы ртути, цинка, висмута, мышьяка взаимодействуют с сульфидами:

Ионы железа (III) и цинка осаждаются растворами гсксацианоферрата (II) калия:
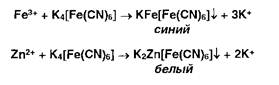
Ионы железа (II) дают аналогичные результаты с гексацианоферратом (III) калия:
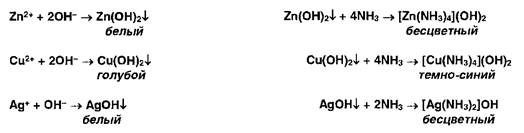
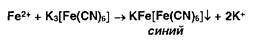
Ионы цинка, меди и серебра осаждаются гидроксидом аммония с образованием осадков, растворимых в избытке г г-ктива:
Ионы ртути (II) и висмута (III) осаждаются йодидами, осадки растворяются в избытке реактивов:

Окислительно -восстановительные реакции, используемые для испытаний подлинности, сопровождаются изменением окраски образующихся продуктов взаимодействия.
Бромид- и йодид-ионы окисляют хлором (хлорамином, другими окислителями):
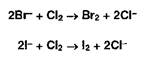
Выделившийся бром окрашивает слой хлороформа в оранжевый цвет, а йод — в фиолетовый. Йод обнаруживают также по синему окрашиванию крахмального клейстера.
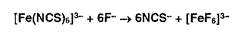
Фторид-ионы обесцвечивают красную окраску раствора роданида железа: Ионы меди, серебра восстанавливаются из оксидов и солей до свободных металлов:

Нитрат- и нитрит-ионы обнаруживают путем окисления дифениламина до дифенилбензидина, а затем до дифе- нилдифенохинондиимина гидросульфата (синее окрашивание) в присутствии концентрированной серной кислоты:
Нитрит-иоиы (в отличие от нитратов) обесцвечивают раствор перманганата калия, подкисленный серной кислотой:
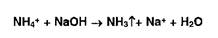
Взаимодействуя с антипирином (феназоном), нитриты образуют продукт замещения — нитрозоантипирин (зеленое окрашивание):
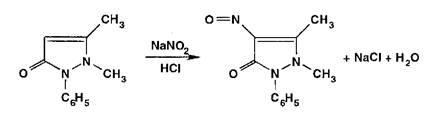
Ионы аммония разлагаются под действием растворов гидроксидов (запах аммиака или изменение окраски красной лакмусовой бумаги):
Карбонат-ионы под действием насыщенного раствора сульфата магния образуют белый осадок, а гидрокарбонат образует осадок только при кипячении смеси (см. реакцию на магний).
Карбонат- и гидрокарбонат-ионы образуют газ — диоксид углерода под действием минеральных кислот:
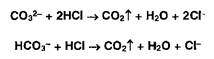
Сульфит-ионы в тех же условиях образуют диоксид серы (резкий запах):
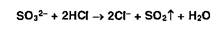
Нитрит-ионы, в отличие от нитрат-ионов, под действием кислот выделяют оксиды азота (диоксид азота имеет красно-бурую окраску):
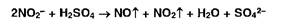
Превращения, происходящие при нагревании и прокаливании некоторых ЛВ. Йод кристаллический, соединения мышьяка, ртути возгоняются (испытания выполнять под тягой!). Цинка оксид при прокаливании желтеет (после охлаждения окраска исчезает). Висмута нитрат основной разлагается с образованием оксида висмута (желтое окрашивание) и диоксида азота (желто-бурые пары).
Соли алюминия при прокаливании с нитратом кобальта образуют плав синего цвета, представляющий собой алюминат кобальта (тенарова синь). Соли цинка в этих условиях образуют плав зеленого цвета (зелень Ринмана).
Установить наличие ряда элементов в неорганических и элементорганических ЛВ можно по изменению окраски бесцветного пламени горелки. Так, соль натрия, внесенная в пламя, окрашивает его в желтый цвет, калия — в фиолетовый, кальция — в кирпично-красный, лития — в карминово-красный. Соли бора, смоченные этанолом, окрашивают кайму пламени в зеленый цвет.
Источник: kazedu.com