
Ответы и задания для тренировочных вариантов ХИ2010101, ХИ2010102, ХИ2010103, ХИ2010104 тренировочная работа №1 ЕГЭ 2021 статград по химии 11 класс. Официальная дата проведения работы: 28.09.2020 (28 сентября 2020 год).
Ссылка для скачивания вариантов (ХИ2010101-ХИ2010102): скачать задания
Ссылка для скачивания вариантов (ХИ2010103-ХИ2010104): скачать задания
Ссылка для скачивания ответов и критериев для вариантов: скачать ответы
Решать тренировочные варианты ХИ2010101-ХИ2010102 ЕГЭ 2021 по химии 11 класс:
Решать тренировочные варианты ХИ2010103-ХИ2010104 ЕГЭ 2021 по химии 11 класс:
Видеоразбор варианта ХИ2010101:
Видеоразбор варианта ХИ2010102:
Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // Химия
Видеоразбор заданий №34 и №35:
Вариант ХИ2010101:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Be, 2) P, 3) Cl, 4) Co, 5) S. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите, какие из указанных элементов имеют в основном состоянии три неспаренных электрона. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 24
2)Из приведённого списка выберите три элемента, которые образуют летучие водородные соединения, и расположите их в порядке усиления кислотных свойств водородного соединения. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 253
3)Из приведённого списка выберите два элемента, которые в оксидах и гидроксидах проявляют степень окисления +2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 14
4)Из предложенного перечня выберите два вещества ионного строения, в которых есть ковалентные связи. 1) BaO2 2) MgO 3) CaF2 4) NaOH 5) N2O4
Ответ: 14
6)Из предложенного списка выберите два вещества, которые реагируют с кислородом при нагревании. 1) медь 2) золото 3) фосфор 4) хлор 5) аргон Запишите номера выбранных ответов.
Ответ: 13
7)В двух колбах находился раствор хлорида железа (III). В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выпал бурый осадок, а во второй выпал осадок и выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Ответ: 1431
10)Задана следующая схема превращений веществ: P2O5 X, t fi P 2 Y, H O fi PH3 Определите, какие из указанных веществ являются веществами X и Y. 1) KOH 2) H2SO4 3) C 4) SiO2 5) NH3
12)Из предложенного перечня выберите два вещества, в составе которых есть атом(-ы) углерода в sp2-гибридном состоянии. 1) бутин-1 2) полиэтилен 3) циклогексан 4) муравьиная кислота 5) изопропилбензол
Ответ: 45
13)Из предложенного перечня выберите два вещества, из которых в лаборатории в одну стадию можно получить толуол. 1) C2H4 2) C6H5Cl 3) C6H5CH=CH2 4) C6H5COOK 5) C6H5CH2COOK
Ответ: 25
14)Из предложенного перечня выберите два вещества, с каждым из которых реагирует пропанол-2, но не реагирует пропионовая кислота. 1) [Ag(NH3)2]OH 2) Na 3) HCl 4) Cu(OH)2 5) KMnO4
Ответ: 35
15)Из предложенного перечня выберите два вещества, которые могут образоваться при гидролизе белков. 1) глицин 2) глицерин 3) серилаланин 4) анилин 5) адипиновая кислота
Ответ: 13
19)Из предложенного перечня выберите все реакции, для осуществления которых требуется катализатор.
- 1) взаимодействие оксида азота(II) с кислородом
- 2) бромирование бензола
- 3) взаимодействие этанола с уксусной кислотой
- 4) взаимодействие фенола с бромной водой
- 5) окисление сернистого газа кислородом
Ответ: 235
20)Из предложенного перечня выберите все реакции, скорость которых возрастает с увеличением давления водорода.
27)Массовая доля хлорида натрия в насыщенном растворе при 20 оС равна 26,5 %. Сколько граммов хлорида натрия надо растворить в 200 г воды, чтобы получить насыщенный раствор? Ответ запишите с точностью до целых.
28)Чтобы вскипятить чайник, требуется 315,2 кДж теплоты. Сколько граммов угля надо сжечь, чтобы получить такое количество теплоты? Примите, что уголь – это чистый углерод. Термохимическое уравнение сгорания углерода имеет вид C + O2 = CO2 + 394 кДж. Ответ округлите до десятых.
29)При растворении ртути в азотной кислоте выделилось 4,48 л (в пересчёте на н. у.) оксида азота(IV). Сколько граммов азотной кислоты израсходовано? Считайте NO2 единственным газообразным продуктом. Ответ приведите с точностью до десятых.
Для выполнения заданий 30 и 31 используйте следующий перечень веществ: соляная кислота, хлорид железа(III), сероводород, сульфид цинка, гидроксид кальция, медь. Допустимо использование водных растворов веществ.
30)Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, приводящая к образованию двух солей, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31)Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32)Цинк растворили в разбавленной серной кислоте. К полученному раствору добавили раствор карбоната натрия, при этом выпал белый осадок и выделился газ. Осадок отфильтровали и прокалили. Газ, образовавшийся при прокаливании, пропустили через известковую воду и наблюдали её помутнение. Напишите уравнения четырёх реакций, соответствующих описанным превращениям.
34)Смесь порошков алюминия и серы общей массой 25 г нагрели. После окончания реакции к полученной смеси добавили 150 г 36,5 %-й соляной кислоты, при этом осталось 2,5 г нерастворившегося вещества. Рассчитайте массовые доли простых веществ в исходной смеси и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сжигании 4,0 г органической кислоты образовалось 3,92 л (н. у.) углекислого газа и 2,7 г воды. При сплавлении натриевой соли этой кислоты со щёлочью образуется углеводород, хлорирование которого на свету даёт только одно монохлорпроизводное. Определите молекулярную формулу кислоты и установите её структуру. Напишите уравнение взаимодействия её соли с гидроксидом натрия.
Вариант ХИ2010102:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Ca, 2) S, 3) Br, 4) Cu, 5) N. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите, какие из указанных элементов имеют в основном состоянии один неспаренный электрон. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 34
2)Из приведённого списка выберите три элемента, которые образуют летучие водородные соединения, и расположите их в порядке ослабления кислотных свойств водородного соединения. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ: 325
3)Из приведённого списка выберите два элемента, которые в соединениях могут иметь степень окисления –2. Запишите в поле ответа номера выбранных элементов в порядке возрастания.
Ответ: 25
4)Из предложенного перечня выберите два вещества атомного строения, в которых есть ковалентные неполярные связи. 1) SiO2 2) H2O2 3) Si 4) C(алмаз) 5) Сl2
Ответ: 34
5)Из предложенного списка выберите два вещества, которые реагируют с водородом при нагревании. 1) медь 2) хлор 3) литий 4) кремний 5) неон
Ответ: 134
7)В двух колбах находился раствор сульфита калия. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ, а раствор остался прозрачным. Во второй колбе выделился газ и выпал осадок. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Ответ: 4243
10)Задана следующая схема превращений веществ: SO2 X fi S Y fi H2SO4 Определите, какие из указанных веществ являются веществами X и Y. 1) KOH 2) KMnO4 3) HNO3 4) H2S 5) H2O
12)Из предложенного перечня выберите два вещества, в составе которых есть атом(-ы) углерода в sp3-гибридном состоянии. 1) ацетилен 2) бутадиен-1,3 3) бутен-2 4) щавелевая кислота 5) толуол Запишите номера выбранных ответов.
Ответ: 35
13)Из предложенного перечня выберите два вещества, из которых в лаборатории в одну стадию можно получить циклогексан. 1) C2H2 2) C6H6 3) CH3CH=CH2 4) Br(CH2)6Br 5) HOOC(CH2)4COOH
Ответ: 24
14)Из предложенного перечня выберите два вещества, с каждым из которых реагирует муравьиная кислота, но не реагирует этанол. 1) Na 2) NaHCO3 3) Br2(H2O) 4) Cu 5) KMnO4
Ответ: 23
15)Из предложенного перечня выберите два вещества, которые могут образоваться при гидролизе природных полисахаридов. 1) сахароза 2) мальтоза 3) дезоксирибоза 4) целлобиоза 5) фруктоза
Ответ: 24
19)Из предложенного перечня выберите все гетерогенные реакции. 1) взаимодействие диоксида марганца с соляной кислотой 2) взаимодействие оксида азота(II) с кислородом 3) взаимодействие водорода с серой 4) нейтрализация известковой воды соляной кислотой 5) взаимодействие лития с водой
Ответ: 135
20)Из предложенного перечня выберите все реакции, скорость которых возрастает с увеличением давления хлора. 1) MnO2 + 4HCl fi MnCl2 + Cl2 + H2O 2) H2 + Cl2 fi 2HCl 3) 2P + 5Cl2 fi 2PCl5 4) CO + Cl2 fi COCl2 5) CaCl2 + 2H2O fi H2 + Cl2 + Ca(OH)2
27)Массовая доля нитрата серебра в насыщенном растворе при 25 оС равна 71,4 %. Сколько граммов нитрата серебра надо растворить в 20 г воды, чтобы получить насыщенный раствор? Ответ запишите с точностью до целых.
28)Чтобы нагреть воздух в двухкомнатной квартире на один градус, требуется 250 кДж теплоты. Сколько литров метана (н. у.) надо сжечь, чтобы получить такое количество теплоты? Термохимическое уравнение сгорания метана имеет вид CH4 + 2O2 = CO2 + 2H2O + 800 кДж. Ответ округлите до целых.
29)При растворении меди в азотной кислоте выделилось 2,8 л (н. у.) оксида азота(II). Сколько граммов азотной кислоты израсходовано? Считайте NO единственным газообразным продуктом. Ответ приведите с точностью до десятых.
Для выполнения заданий 30 и 31 используйте следующий перечень веществ: фосфор, карбонат натрия, аммиачная вода, силикат кальция, азотная кислота, хлорид железа(III). Допустимо использование водных растворов веществ.
30)Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, сопровождающаяся выделением газа, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
31)Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к образованию осадка без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32)Зелёный порошок, образовавшийся при разложении дихромата аммония, смешали с порошком угля, взятым в избытке, и нагрели в атмосфере хлора. Полученное вещество растворили в воде и добавили избыток щёлочи. Через образовавшийся раствор пропускали хлор до тех пор, пока раствор не приобрёл жёлтую окраску. Напишите уравнения четырёх реакций, соответствующих описанным превращениям.
33)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: пропен fi X1 KOH(спирт.р-р) fi пропин C, t fi X2 fi X3 fi бензол При написании уравнений реакций используйте структурные формулы органических веществ.
34)Смесь порошков алюминия и углерода общей массой 25 г прокалили в электрической печи. После окончания реакции к полученной смеси добавили 365 г 20%-й соляной кислоты, при этом осталось 3,4 г нерастворившегося вещества. Рассчитайте массовые доли простых веществ в исходной смеси и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сжигании 3,65 г органической кислоты образовалось 3,36 л (н. у.) углекислого газа и 2,25 г воды. При сплавлении калиевой средней соли этой кислоты с гидроксидом калия образуется углеводород разветвлённого строения. Определите молекулярную формулу кислоты и установите её структуру, если известно, что в её молекуле только один третичный атом углерода. Напишите уравнение взаимодействия соли кислоты со щёлочью.
Источник: 100ballnik.com
Как правильно рассчитать массу вещества с использованием коэффициента растворимости
Задача 451.
Сколько граммов нитрата калия выкристаллизуется из 105 г насыщенного при б0 °С раствора, если охладить его до 0 °С? Коэффициенты растворимости соли при указанных температурах соответственно равны 110 и 13 г в 100 г Н2О.
Решение:
Коэффициент растворимости – это масса вещества, растворяющегося при данных условиях в 100 г воды с образованием насыщенного раствора.
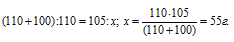
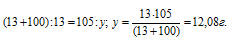
Таким образом, при охлаждении раствора нитрата калия в осадок выпадет 42,92 г соли (55 – 12,08 = 42, 98).
Ответ: 42,98 г.
Задача 452.
1 л воды насыщен СО2 при 0°С под давлением 506,6 кПа (3800 мм рт. ст.). Какой объем займет растворенный газ, если выделить его из воды и привести к нормальным условиям? Растворимость СО2 при 0°С равна 171 мл в 100 мл Н2О.
Решение:
Находим объём газа СО2 при заданных условиях из пропорции:
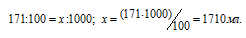
Согласно закону Генри 1 масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Следовательно, объём, который будет занимать 1710 мл СО2 при нормальных условиях найдём по уравнению:
V1- объём газа при определённом давлении, V2 — объём газа приведенного к нормальным условиям, P1 — давление газа при определённых условиях, P2 — нормальное давление.
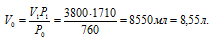
Ответ: 8,55л.
Задача 453.
Растворимость аммиака при 20 °С равна 702 мл в 1 мл воды. Найти массовую долю аммиака в насыщенном растворе. Парциальное давление NH3 считать равным нормальному атмосферному давлению.
Решение:
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает 22,4л.
Рассчитаем массу NH3, содержащуюся в 702 мл раствора из пропорции:
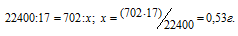
Массовую долю аммиака рассчитаем по формуле:


— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
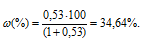
Ответ: 34,64%.
Задача 454.
В 1 л воды при 0 °С растворяется 4,62 л H2S. Под каким давлением надо растворять H2S, чтобы получить 5%-ный (по массе) раствор?
Решение:
Находим массу H2S, растворённого в 1 л воды из пропорции:
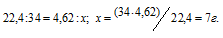
Массовую долю сероводорода рассчитаем по формуле:


— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
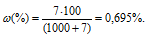
Значит, массовая доля 5%-ного раствора больше исходного в 7,2 раза (5/0,695 = 7,2).
При температуре 0 °С парциальное давление сероводорода равно 101,325 кПа. Известно, что масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Масса газа в 5%-ном растворе будет равна:
Теперь рассчитаем давление, при котором эта масса H2S растворится в 1 л воды из пропорции:
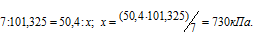
Ответ: 730 кПа.
1 Закон Генри — физический закон, согласно которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Назван по имени английского химика Уильяма Генри.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Коэффициент растворимости | Задачи 451 — 454
Источник: buzani.ru