Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
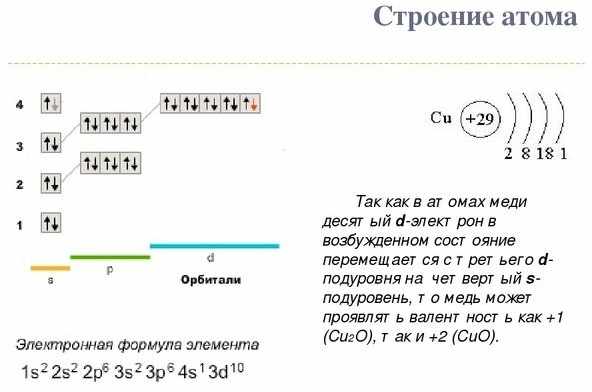
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.
Медь. Что мы знаем о меди? Интересные факты.

Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.
Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.

В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Медь: значение для организма, признаки дефицита
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.

Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди

Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
- оксид (I) – Cu2O,
- сульфид (I) – С
Двухвалентной
Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
- оксид (II) – CuO,
- соли.
Трехвалентной
Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
- оксид (III) – Cu2O3,
- купрат (III).
Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Источник: tarologiay.ru
Медь
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке.
Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Свойства меди
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого «Kyprium», то есть «кипрский металл», по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.94 — 8.95 г/см 3 |
| Радиоактивность (GRapi) | |
| Магнетизм | диамагнетик |
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по по шпинелевому закону |
Добыча и запасы меди
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
Способы применения меди в промышленности и дома
- кондиционеры;
- монеты, в чистом виде или в сплавах с другими металлами, такими как золото;
- краситель для стекла;
- пищевые добавки;
- в искусстве;
- обшивка корпусов судов;
- в печатных платах;
- канализация, слив воды;
- дверные ручки;
- посуда;
- сульфат меди используется, чтобы удалить плесень;
- электрические проводники;
- украшения;
- молниеотводы (молниезащита);
- микроволновые печи;
- музыкальные инструменты, в частности, духовая секция;
- реле;
- медная шина, токопроводы;
- крыша гидроизоляции;
- профнастил;
- статуя Свободы изготовлена из меди;
- микроэлементы для животных;
- используется, чтобы сделать латуни и бронзы;
- кондиционерные трубки и трубы для холодильного оборудования;
- трубы для теплообменных аппаратов;
- медная шина с покрытием.
Источник: metallolomkin.ru
Названия и состав сплавов меди
Сплавы меди — это соединение цветного металла с некоторыми элементами таблицы Менделеева. В процессе их формирования атомы кристаллической решетки меди замещаются атомами другого вещества. В результате образовывается новое твердое соединение. Каждое из них обладает своими физическими и химическими показателями.
Чаще всего, на основе меди получают бронзу и латунь, путем добавления цинка и олова. Новые соединения снижают цену основного металла, улучшая некоторые параметры. Идет повышение пластичности и коррозионной стойкости. Это дает возможность использовать их в некоторых отраслях промышленности.

Исторический ракурс
Согласно историческим данным, первый медный сплав появился к 7 тыс. до н.э. Позже в качестве добавки стало использоваться олово. В это время, именуемое бронзовым веком, из такого материала изготавливалось оружие, зеркала, посуда и украшения.
Технология производства менялась. Появились добавки в виде мышьяка, свинца, цинка и железа. Все зависело от требований, предъявляемых к предмету. Материал для украшений нуждался в особом подходе. Состав сплава состоял из меди, олова и свинца.
Начиная с 8 в. до н. э. в Малой Азии была разработана технология получения латуни. В это время еще не научились добывать чистый цинк. Поэтому в качестве сырья использовалась его руда. С течением времени производство медных сплавов постоянно расширялось и до сих пор находится на первых местах.
Сплавы химического элемента меди
Медь, в соединении с другими металлами, образует сплавы с новыми свойствами. В качестве основных добавок используются олово, никель или свинец. Каждый вид соединения обладает особыми характеристиками. Отдельно медь используется редко, поскольку у нее невысокая твердость.
К прочтению: Как сварить трубы отопления электросваркой
Немного о бронзе
Бронза — название сплава меди и олова. Также в состав соединения входит кремний, свинец, алюминий, марганец, бериллий. У полученного материала показатели прочности выше, чем у меди. Он обладает антикоррозионными свойствами.
С целью улучшения характеристик в сплав добавляются легирующие элементы: титан, цинк, никель, железо, фосфор.
Существует несколько разновидностей бронзы:
- Деформируемые. Количество олова не превышает 6%. Благодаря этому, металл обладает хорошей пластичностью и поддается обработке давлением.
- Литейные. Высокая прочность позволяет использовать материал для работы в сложных условиях.
Сплав никель и медь
В этом соединении используется медь и никель. Если к этой паре добавляются другие элементы, соединения носят такие названия:
Латунь
Это сплав меди с цинком. Колебание количественного содержания цинка влечет за собой изменение характеристик и цвета сплава.
Кроме этих 2 основных элементов в сплаве содержатся легирующие добавки. Их показатель составляет небольшой процент.
Латунь обладает высокими прочностными характеристиками, пластичностью и способностью противостоять коррозии. Также характеризуется немагнитными свойствами.

Физические и химические свойства сплавов
Химический состав и механические свойства медных сплавов обеспечивают им не только прочность, но и хорошую электро- и теплопроводность. Особенно это относится к латуни.
Все медные сплавы характеризуются хорошими антифрикционными свойствами. Отдельно стоит отметить бронзу.
Благодаря хорошим антифрикционным свойствам бронзы, материал идет на изготовление втулок в качестве подшипников скольжения. Такое изделие не требует смазки, поскольку с внутреннего диаметра, по которому идет скольжение, сминаются все шероховатости. Именно это и является источником смазки. Установка таких подшипников ведется даже на высокоточном оборудовании — координатно-расточных и координатно-шлифовальных станках.
Температура плавления меди без добавок составляет 1083 градуса. В зависимости от количества добавления цинка и олова, этот показатель меняется. Величина температуры плавления латуни составляет 900–1050 градусов, а бронзы — 930–1140 градусов.
К прочтению: Самые популярные виды горнов для ковки
Коррозионные свойства медных сплавов отличаются стойкостью. Связано это с тем, что медь не активный элемент. Особенно не корродируют полированные поверхности.
Коррозионная стойкость медных соединений проявляется в пресной воде и ухудшается в присутствии кислоты, которая препятствует образованию защитной оболочки.
Применение сплавов
Благодаря своим свойствам медь и ее сплавы нашли применение не только в промышленности, но и ювелирном деле.
Соединения меди также используются для изготовления следующих изделий:
- проволоки, благодаря хорошей электропроводности,
- труб, материал которых не вступает в реакцию с водой,
- посуды, в которой не развиваются бактерии,
- кровли для крыши, служащей длительное время,
- в качестве фурнитуры для мебели.

Способы получения металла
Основные сплавы на основе меди — латунь и бронза. Их процесс производства следующий:
- Латунь. Предварительно идет плавка меди. Затем цинк разогревается до 100 градусов и добавка его ведется на конечной стадии получения латуни. В качестве источника тепла используется древесный уголь.
- Бронза. Для ее производства применяются индукционные установки. Сначала плавится медь, а потом добавляется олово.
В обоих случаях формируются слитки, поступающие в прокатный цех, где происходит их обработка давлением в горячем и холодном виде.
Плавление меди в домашних условиях
Чтобы получить сплав меди в домашних условиях, нужно изготовить самодельное оборудование для плавления. Процесс проводится следующим образом:
- Изготавливается из силикатного кирпича опора.
- Сверху укладывается сетка из металла с мелкими ячейками.
- Насыпается уголь и разогревается газовой горелкой. Чтобы огонь разгорелся лучше, направляется струя воздуха из пылесоса.
- На огонь ставится тигель с мелкими кусочками металла.
- По окончании процесса жидкий металл сливается в форму.
Физические свойства медных сплавов сделали их незаменимыми во многих сферах хозяйственной деятельности. Без них не обойдется самолетостроение и судостроение. Нельзя представить без такого металла и часовые механизмы. Любая конструкция, в которой имеются работающие в паре детали, нуждается в антифрикционном материале.
Источник: xn—-ntbhhmr6g.xn--p1ai