Медь, серебро и золото — блестящие металлы красного, белого и желтого цветов. Они отличаются высокой плотностью, тепло- и электропроводностью. Металлы подгруппы меди обладают высокими температурами кипения и плавления (таблица 1.3), а также высокой (особенно золото) пластичностью. Из них могут быть получены тончайшие проволока и фольга. Они превосходят другие металлы по тепло- и электропроводности, а именно, серебро и медь занимают по этим показателям I и II места среди металлов.
На воздухе медь окисляется, покрываясь зелено-серой пленкой CuCO3 Cu(OH)2, серебро и золото устойчивы к окислению кислородом:
2Cu + O2 + CO2 + H2O = (CuOH)2CO3
При наличии в воздухе сероводорода серебро покрывается черным Ag2S.
Таблица 1.3. Физические свойства элементов подгруппы меди и их соединений
Химические свойства простых веществ
Металлы подгруппы меди малоактивны, причем химическая активность понижается в подгруппе сверху вниз.
Об уменьшении химической активности в ряду Cu-Ag-Au свидетельствуют значения стандартных электродных потенциалов, которые составляют соответственно +0,34; +0,80; +1,45 В.
Медь — Первый металл, полученный ЧЕЛОВЕКОМ!
Наиболее характерная степень окисления золота +3; известны соединения золота со степенями окисления +1 и +2.
Золото Д малоактивный в химическом отношении металл, нормальный электродный потенциал реакции Au3++3 e=Аu при 298 К Фо= 1,498 В. Для одновалентного золота Аu++е=Аu, при нормальных условиях этот потенциал составляет 1,962 В. В ряду напряжений, металлов золото располагается правее водорода, причем дальше всех остальных металлов. Поэтому в растворе соляной, серной и других кислот при отсутствии окислителей золото не растворяется.
Хорошо растворяет золото смесь кислот, состоящая из 1 объема азотной кислоты и 3Д4 объемов соляной («царская водка»). На воздухе золото не изменяет своего цвета и не взаимодействует с кислородом даже при иагревании до 400 °С.
При обычных условиях поверхность золота покрыта тончайшим адсорбированным слоем кислорода, однако непосредственно, даже при нагреве, золото не соединяется не только с кислородом, но и с серой, и селеном. Оксид Аu2О и оксид Аu2О3 могут быть получены только косвенным путем. С водородом золото не реагирует даже при высоких температурах.
Однако летучие гидриды типа АuН образуются в небольших количествах при обдувке золота струей водорода при температурах выше 1425 °С. Воздействуя на золото атомарным водородом, удается получить бесцветный твердый гидрид, который очень неустойчив. Водород крайне незначительно растворяется в твердом золоте. Максимальная растворимость при 900°Ссоставляет ~8*10-4%.
При воздействии аммиака на водную суспензию Аu2О образуется соединение Au3N*NH3, которое после промывки разбавленной азотной кислотой переходит в Au3N*H2О. В сухом состоянии оба соединения взрывоопасны. Золото не реагирует с углеродом даже при высоких температурах.
Соединение золота с этим элементом может быть получено косвенным путем Д воздействием ацетилена на раствор тиосульфатного комплекса золота, при этом образуется желтый карбид Аu2С2, точнее ацетилид золота, который крайне взрывоопасен. Золото реагирует с хлором, бромом и иодом. Реакция с бромом протекает при комнатной температуре с образоваинем бромида AuBr3.
Серебро — САМЫЙ БЛЕСТЯЩИЙ МЕТАЛЛ НА ЗЕМЛЕ!
С сухим хлором и иодом золото вступает в реакцию только при нагревании, при этом образуется хлорное золото AuCl3. Теплоты образования АиС13 и AuBr3 соответственно равны 117,08 и 54,15 кДж/моль. В водном растворе хлора (хлорной воде) золото легко растворяется. Еще более активно, чем ионы хлора, действуют на золото ноны CN-. В их присутствии золото окисляется даже кислородом воздуха.
Этот процесс лежит в основе получения золота цианидным выщелачиванием из золотоносной руды. Со своими ближайшими аналогами Д серебром и медью Д золото образует непрерывные твердые растворы, аналогичный характер взаимодействия наблюдается при сплавленнн золота с некоторыми элементами VIII группы Д платиной и палладием.
В системах золото Д медь и золото Д платина непрерывные твердые растворы существуют лишь при высоких температурах, при понижении температуры наблюдается их распад с образованием упорядоченных металлических соединений, так называемых фаз Курнакова. Золото образует ряд металлических соединений (ауридов) с электроположительными и переходными металлами ПА, IIIA, IVA, VIIA и VIIIA подгрупп.
Ограниченные твердые растворы и металлические соединения золото образует со многими элементами, более электроотрицательными по сравнению с ним. Так, золото образует широкие области ограниченных твердых растворов с металлами ПА подгруппы (цинком, кадмием, ртутью), IIIA подгруппы (алюминием, галлием, индием), IVA подгруппы (германием, оловом, свинцом) и VA подгруппы (мышьяком, сурьмой). За пределами растворимости в этих системах образуются соединения, имеющие во многих случаях переменные составы. Характерная черта золота Д большое разнообразие во взаимодействии с другими элементами Периодической системы, связанное с образованием твердых растворов н большого числа металлических соединений различного состава, с различной кристаллической структурой и различной природой химической связи. Все это обусловливает возможность создания на основе золота большого числа сплавов различного назначения.
Серебро проявляет химические свойства, характерные для элементов Iб подгруппы периодической системы Менделеева. В соединениях обычно одновалентно.
Серебро находится в конце электрохимического ряда напряжений, его нормальный электродный потенциал Ag = Ag+ + e- равен 0,7978 в.
При обычной температуре Ag не взаимодействует с О2, N2 и Н2. При действии свободных галогенов и серы на поверхности Серебра образуется защитная пленка малорастворимых галогенидов и сульфида Ag2S (кристаллы серо-черного цвета).
Под влиянием сероводорода H2S, находящегося в атмосфере, на поверхности серебряных изделий образуется Ag2S в виде тонкой пленки, чем объясняется потемнение этих изделий. Сульфид можно получить действием сероводорода на растворимые соли Серебра или на водные суспензии его солей. Растворимость Ag2S в воде 2,48·10-3 моль/л (25 °С). Известны аналогичные соединения — селенид Ag2Se и теллурид Ag2Te.
Из оксидов Серебра устойчивыми являются оксид (I) Ag2O и оксид (II) AgO. Оксид (I) образуется на поверхности Серебра в виде тонкой пленки в результате адсорбции кислорода, которая увеличивается с повышением температуры и давления.
Ag2O получают действием КОН на раствор AgNO3. Растворимость Ag2O в воде — 0,0174 г/л. Суспензия Ag2O обладает антисептическими свойствами. При 200 °С оксид Серебра (I) разлагается. Водород, оксид углерода (II), многие металлы восстанавливают Ag2O до металлического Ag. Озон окисляет Ag2O с образованием AgO.
При 100 °С AgO разлагается на элементы со взрывом. Серебро растворяется в азотной кислоте при комнатной температуре с образованием AgNO3. Горячая концентрированная серная кислота растворяет Серебро с образованием сульфата Ag2SO4 (растворимость сульфата в воде 0,79% по массе при 20 °С). В царской водке Серебро не растворяется из-за образования защитной пленки AgCl.
В отсутствие окислителей при обычной температуре НCl, HBr, HI не взаимодействуют с Серебром благодаря образованию на поверхности металла защитной пленки малорастворимых галогенидов. Большинство солей Серебра, кроме AgNO3, AgF, AgClO4, обладают малой растворимостью. Серебро образует комплексные соединения, большей частью растворимые в воде. Многие из них имеют практическое значение в химические технологии и аналитической химии, например комплексные ионы [Ag(CN)2]-, [Ag(NH3)2]+, [Ag(SCN)2]-.
Отношение к простым веществам
С водородом эти элементы гидридов не образуют.
С галогенами образуют галиды с соответствующими степенями окисления: медь окисляется до +1, +2 (при обычной температуре), остальные при нагревании: Ag до +1 (лучше всего взаимодействует с фтором), Au до +1, +3 (лучше всего взаимодействует с хлором).

Кислородом медь окисляется до степеней окисления +1, +2. Оксиды Ag2O, Au2O, Au2O3 получаются косвенным путем.

Оксид серебра (I) Ag2O образуется при окислении серебра озоном.
С серой образуют сульфиды все элементы, кроме золота.

С некоторыми малоактивными неметаллами (например, фосфором и углеродом) взаимодействуют только медь и серебро (образуются фосфиды и карбиды).

С металлами образуют сплавы, в том числе и между собой.
Известны сплавы меди: бронза, томпак, манганин, мельхиор, латунь, константан.
Медь, серебро и золото образуют сплавы друг с другом.
Все элементы подгруппы меди растворяются в ртути, образуя амальгамы.
Отношение к сложным веществам
Так как в ряду стандартных электродных потенциалов металлы подгруппы меди расположены правее водорода, то они взаимодействуют только с разбавленными кислотами в присутствии окислителя, например кислорода:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
С водой не взаимодействуют.
С кислотами — окислителями (разбавленная и концентрированная HNO3, концентрированная H2SO4) реагируют все металлы, кроме золота.
При этом кислоты могут окислять их только за счет аниона:

Золото растворяется лишь в горячей концентрированной селеновой кислоте, «царской водке» (HNO3(конц.) + 3HCl(конц.)) и в насыщенном хлором растворе HCl:
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
Au + HNO3 + 4HCl = HAuCl4 + NO + 2H2O
2Au + 6H2SeO4(конц.) = Au2(SeO4)3 + 3SeO2 + 6H2O
Au + 3Cl + 3HCl = HAuCl4
Все металлы устойчивы к щелочам.
Однако медь в присутствии кислорода растворяется в водных растворах аммиака:
4Cu + 8NH3 + O2 + 2H2O = 4[Cu(NH3)2]OH
Источник: studbooks.net
Медь и серебро физические свойства
Лекция 14. Элементы 11 группы. Часть 1
Лекция из курса:
Поделиться:
Лекция 14. Элементы 11 группы. Часть 1
1 / Загрузка
Скачать конспект лекции
Предыдущая лекция

Лекция 13. Элементы 10 группы
Следующая лекция

Лекция 15. Элементы 11 группы. Часть 2
Медь и ее характеристики
Чистая медь по электрической проводимости занимает следующее место после серебра, обладающего из всех известных проводников наивысшей проводимостью. Высокая проводимость и стойкость к атмосферной коррозии в сочетании с высокой пластичностью делают медь основным материалом для проводов.
На воздухе медные провода окисляются медленно, покрываясь тонким слоем окиси СuО, препятствующим дальнейшему окислению меди. Коррозию меди вызывают сернистый газ S02, сероводород H2S, аммиак NH3, окись азота NО, пары азотной кислоты и некоторые другие реактивы.
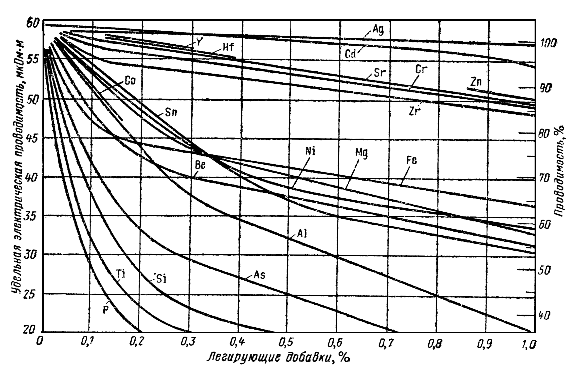
Рис. 8-1. Влияние примесей на электрическую проводимость меди.
Проводниковую медь получают из слитков путем гальванической очистки ее в электролитических ваннах. Примеси, даже в ничтожных количествах, резко снижают электропроводность меди (рис. 8-1), делая ее малопригодной для проводников тока, поэтому в качестве электротехнической меди применяются лишь две ее марки (М0 и M1) по ГОСТ 859-66, химический состав которых приведен в табл. 8-1.
В табл. 8-1 не указана бескислородная медь марки М00 (99,99% Си), свободная от содержания кислорода и окислов меди, отличающаяся от меди марок М0 и M1 меньшим количеством примесей и существенно более высокой пластичностью, позволяющей ее волочение в тончайшие проволоки. По проводимости медь М00 не отличается от меди М0 и M1. Медь повышенной чистоты широко используется в электровакуумной технике.
Примеси Bi и Рb в больших количествах, чем указано в табл. 8-1, делают невозможным горячую прокатку меди. Сера не вызывает горячеломкость меди, но повышает ее хрупкость на холоде. Примеси в небольших количествах Ni, Ag, Zn и Sn не ухудшают технологических свойств, повышая механическую прочность и термическую стойкость меди.
Кислород как примесь в малых дозах, не затрудняя заметно прокатку, несколько повышает проводимость меди, так как находящиеся в меди другие примеси в результате окисления выводятся из твердого раствора, где они наиболее сильно влияют на снижение проводимости металла.
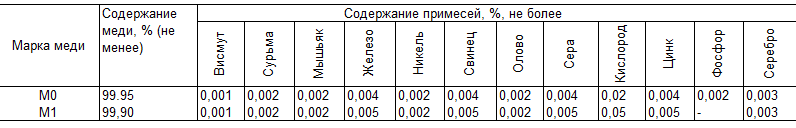
Таблица 8-1 Химический состав проводниковой меди (ГОСТ 859-66)
Почти все изделия из проводниковой меди изготовляются путем проката, пресования и волочения. Так, волочением могут быть изготовлены провода диаметром до 0,005 мм, ленты толщиной до 0,1 мм и медная фольга толщиной до 0,008 мм.
Проводниковая медь применяется как в отожженном после холодной обработки виде (мягкая медь марки ММ), так и без отжига (твердая медь марки МТ).
При холодной обработке давлением прочность меди в результате обжатия (наклепа) растет, а удлинение падает, однако длительные рабочие температуры наклепанной меди ограничены и лежат в пределах до 160-200 °С, после чего из-за процесса рекристаллизации происходят разупрочнение и резкое падение твердости наклепанной меди. Чем выше степень обжатия при холодной обработке, тем ниже допустимые рабочие температуры твердой меди.
При температурах термообработки выше 900 °С вследствие интенсивного роста зерна механические свойства меди резко ухудшаются. Физические и технологические свойства меди приведены в табл. 8-2.
Влияние температуры отжига на механические свойства и электрическую проводимость меди представлено на рис. 8-2.
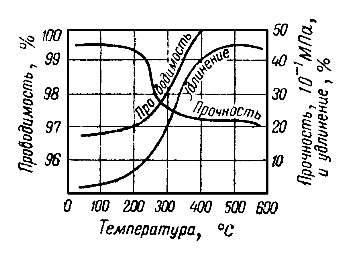
Рис. 8-2. Влияние температуры отжига на свойства меди.
Для электротехнических целей из меди изготовляют проволоку, ленту, шины как в мягком (отожженном) состоянии, так и в твердом.
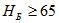
Согласно ГОСТ 434-71 число твердости Бринелля твердых лент при испытании шариком диаметром 5 мм, нагрузке 2500 Н и выдержке 30 с.
В зависимости от рабочей температуры механические свойства меди представлены в табл.8-3.
В целях повышения предела ползучести и термической устойчивости медь легируют серебром в пределах 0,07-0,15%, а также магнием, кадмием, хромом, цирконием и другими элементами.
В настоящее время медь с присадкой серебра применяется для обмоток быстроходных и нагревостойких машин большей мощности, а медь, легированная различными элементами, используется в коллекторах и контактных кольцах сильно нагруженных машин.
Температура плавления, °С
Источник: www.ess-ltd.ru