Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
ПОЧЕМУ Я СЕРЕБРО И МЕДЬ НИКОГДА НЕ ПРОМЕНЯЮ НА ЗОЛОТО? СМОТРЕТЬ ВСЕМ !
Медь, серебро, золото (подгруппа IB)
Электронная конфигурация предпоследнего и последнего электронных слоев атомов меди Си, серебра Ag и золота Au соответственно имеет вид: 3d 10 4s 1 ; 4d 10 5s 1 ; 5d 10 6s 1 . Радиусы атомов элементов подгруппы IB почти в два раза меньше радиусов атомов соответствующих элементов подгруппы IA. Этим объясняются сравнительно высокие значения их первого потенциала ионизации (соответственно 7,72; 7,57 и 9,22 эВ), значительно более низкая восстановительная способность по сравнению со щелочными металлами и химическая инертность в целом.
Поскольку заполнение d-подуровня у атомов этих элементов произошло за счет «провала» одного s-электрона с последнего слоя, он не отличается высокой стабильностью. d-Электроны меди и золота могут участвовать в образовании связей наряду с s-электроном. Медь может проявлять в соединениях степени окисления +1, +2, +3, а золото — +1, +3.
Малые радиусы и большие заряды ионов Cu 2+ Аи 3+ обусловливают их высокую способность к комплексообразованию. Не лишены такой способности также катионы Ag+ и Си+.
Металлы подгруппы IB характеризуются пластичностью, высокой тепло- и электропроводностью. В ряду Си — Ag — Аи химическая активность металлов резко снижается, о чем свидетельствуют стандартные электродные потенциалы (соответственно +0,34; +0,80 и + 1,68 В). Все они не вытесняют водород из кислот. Однако медь растворяется в концентрированной соляной кислоте в присутствии кислорода:

Подобным образом протекает растворение меди в растворах цианидов:

Медь и серебро окисляются азотной кислотой, а золото — «царской водкой» (HNO3 + НС1) и селеновой кислотой:

Как разделить золото, палладий и платину в присутствии меди. Первый опыт
Концентрированная азотная кислота будет восстанавливаться до NO2:

Тетрахлороауратная (золотоводородная) кислота Н[АиС14]-4Н2О в виде светло-желтых игл — продажный препарат золота. Известна также ее соль — тетрахлороаурат натрия — Na[AuCl4].
С кислородом взаимодействует только медь, образуя два оксида — Си2О (красный) и СиО (черный). Косвенным путем можно получить оксид меди (III) — Си2О3 (сильный окислитель). Два первых оксида не растворяются в воде, реагируют с кислотами с образованием солей Cu +1 и Си+ 2 , а в водном растворе аммиака образуют комплексные соединения:

Из соединений меди следует отметить

Медный купорос представляет собой неорганический полимер, построенный из элементарных звеньев [Си(ОН2)4] 2+ , связанных мостиновыми сульфат-анионами. Пятая молекула воды удерживается в кристаллической решетке за счет водородных связей:

Гидроксид меди (II) представляет собой аморфное вещество синего цвета, легко отщепляющее воду при нагревании:

Двухвалентная медь — окислитель, восстанавливающийся чаще всего до Cu +1 :

Известно много амино- и аквакомплексов на основе катиона Сп 2+ . Например, [Cu(NH3)4]SO4-H2O, [Cu(NH 3)4(H2O)2]SO4, [Си (еп)2 (Н2О)2] SO4 (еп — этилендиамин H2NCH2CH2NH2). Высокотемпературные керамические сверхпроводники (BaYCu3O6_x) содержат медь в высших степенях окисления ( + 2, +3).
Для серебра наиболее характерны соединения типа Ag2O, AgHal, Ag2S, AgNO3.
Ag2O мало растворим в воде, образующийся при этом AgOH — основание средней силы (Кд = 5-10“ 3 ), поэтому соли серебра практически не гидролизуются.
Подобно меди, серебро образует устойчивый аминокомплекс:

Соединения Ag +1 легко восстанавливаются до металлического серебра. Хорошо известна реакция серебряного зеркала на альдегидную группу (проба Толленса):

Эта реакция является химической моделью биологического окисления. Суть ее заключается в том, что вода выступает в роли донора кислорода, передавая его субстрату. Собственно окислению подвергается гидратированная молекула альдегида, отщепляющая молекулу водорода, которая в свою очередь передает пару электронов катионам Ag+:

Освободившиеся два протона связываются с противоионами катиона Ag +1 , т. е. ОН-, образуя воду.
В качестве окислителя альдегидной группы может быть использован и катион Си 2+ в виде следующих реактивов: 1) комплекса с винной кислотой (тартратов) (реактив Фелинга); 2) свежеосажденного гидроксида меди (II) (CuSO4 + 2NaOH) (реакция Троммера); 3) ацетата меди. Во всех случаях Си(II) восстанавливается до Cu(I) (CuOH, Cu2O).
Медь и ее сплавы (латунь, бронза) широко используются в электротехнике, приборостроении, машиностроении. Сплавы меди, серебра и золота применяются для изготовления ювелирных изделий и в стоматологии.
Бромид серебра широко используется в фотографии. AgBr (в желатине) нанесенный на фотобумагу или пленку при попадании света разлагается:

Мельчайшие частицы Ag адсорбируются на неразложившемся AgBr, который затем восстанавливают проявителем, например, гидрохиноном. Остатки бромида серебра вымывают раствором тиосульфата натрия — Na2S2O3 (фиксаж).
Медь связана со многими биоактивными структурами (ферментами, гормонами, витаминами) влияет на углеводный, белковый, водный и минеральный обмен. В частности, Си принимает участие в синтезе гемоглобина и формировании эритроцитов, обеспечивая ассимиляцию гемоглобинового железа, активность цитохромоксидазы и клеточного дыхания в целом. При недостатке меди в организме развиваются анемия, остеопороз, рахит, нарушения в развитии мозга и потеря эластичности кровеносных сосудов.
Биокомплексы меди стимулируют образование гликогена в печени.
Медь обеспечивает активность ряда металлоферментов (цитохро-моксидазы, уратоксидазы, полифенолазы и других гидрогеназ), участвующих в окислительно-восстановительных процессах.
В то же время Си 2+ является ингибитором ряда ферментов (амилазы слюны, липазы, аденозинтрифосфотазы мышц и др.). При нарушении функции печени, а также в результате излишнего поступления меди в организм она накапливается в печени, мозге и почках (болезнь Вильсона). Для выведения меди из организма используют D-пеннициламин HS—С (СН3)2—CH (NH2)—СООН, образующий прочный комплекс с катионом Сп 2+ .
Препараты меди применяются в медицине для лечения анемии, эндемического зоба и торможения нервной возбудимости. Сульфат меди (в смеси с MnSO4 и CoSO4) назначается при маточных кровотечениях, а в композиции с йодом и цинком — для лечения гипогалакто-мии (недостаточное отделение молока).
CuSO4 — антисептическое и прижигающее вещество, компонент глазных капель (при конъюнктивитах, трахоме), повышает фагоцитарную активность лейкоцитов, укрепляет иммунную систему.
В растениях медь входит в состав ряда оксидаз и нитратредуктаз. Она участвует в биосинтезе хлорофилла, антоцианов, белков, а также в фиксации молекулярного азота. Медь активирует витамины группы В.
Оксиды, хлороксид и соли меди (арсенат, ацетат, борат, сульфат, карбонат, фосфат и др.) обладают пестицидным действием. В частности, различные соединения меди применяются самостоятельно или в смеси с органическими препаратами в качестве средств борьбы с болезнями растений (фунгицидов). Так, на вегетирующих растениях используется медный купорос в виде «бордосской жидкости» — продукта обработки известковым молоком 1 %-го раствора медного купороса:

Все растворимые соли меди ядовиты!
Источник: studme.org
Химия d-элементов (медь, серебро, цинк, хром, марганец, железо)
Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29 Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 , наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:
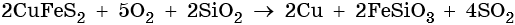
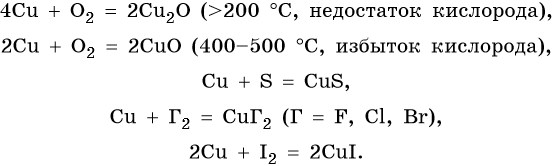
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:
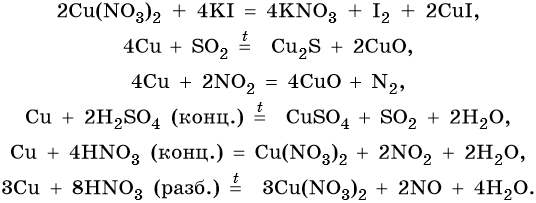
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
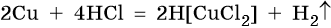
Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
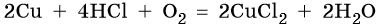
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
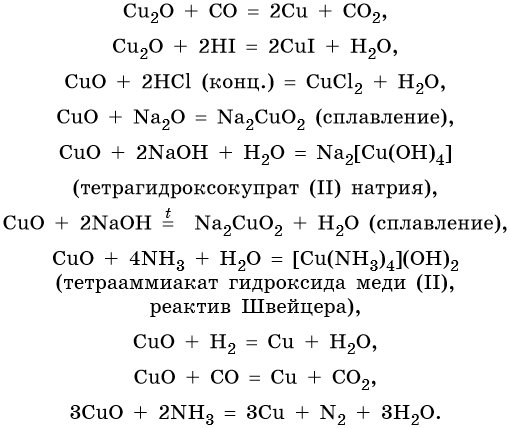
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
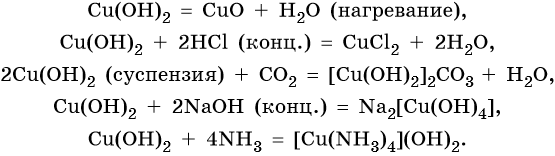
Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 . В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:
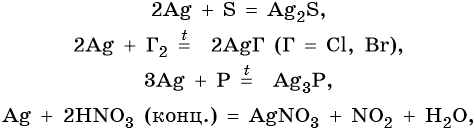
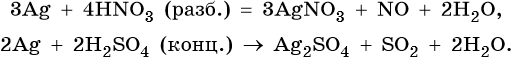
Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:
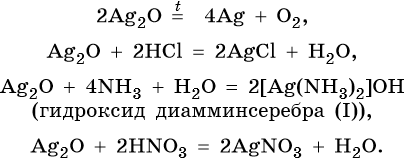
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30 Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 . В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:
Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
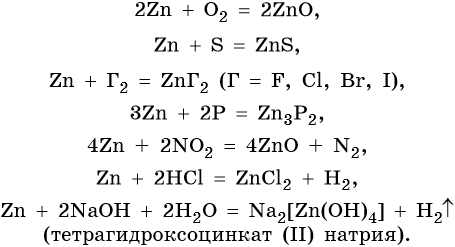
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:
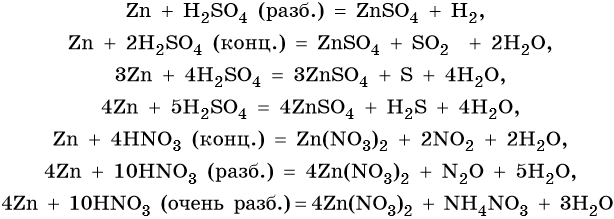
Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:
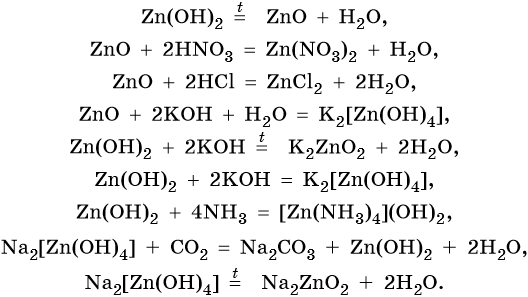
Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 . Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:

Его характерные химические реакции:
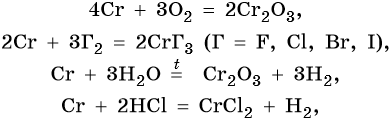

Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
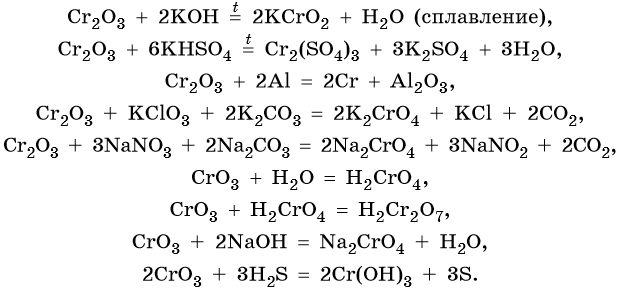
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:
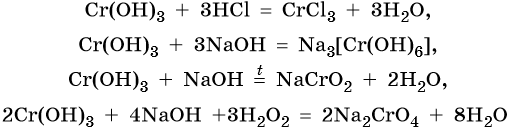
Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 . Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
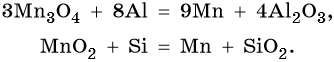
Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:
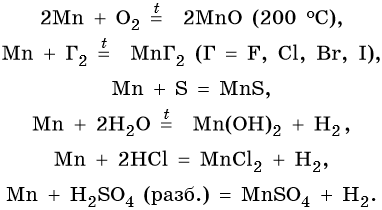
Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:
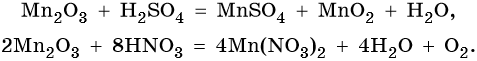
MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:
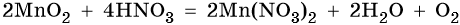
Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.
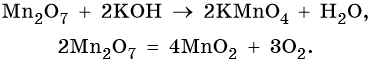
Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26 Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
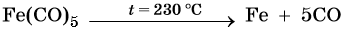
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:
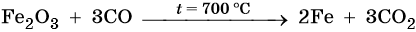
Характерные для железа химические реакции:
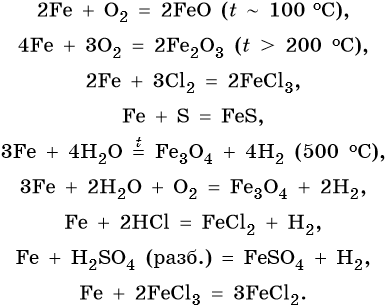
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
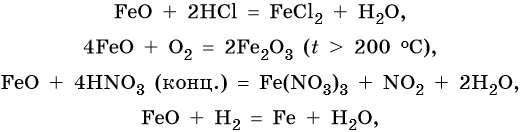
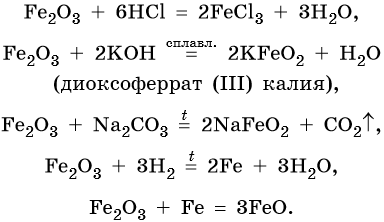
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:
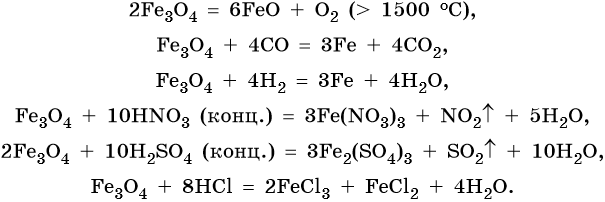
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
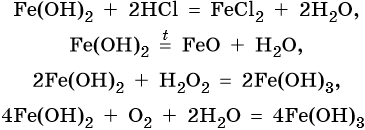
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
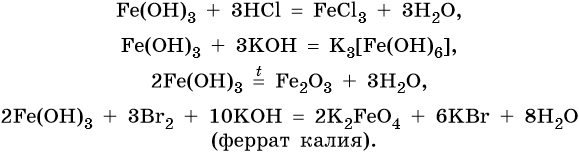
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Источник: himi4ka.ru