Привет Лёва Середнячок
С чем не взаимодействует концентрированная серная кислота?
1) с медью
2) с железом
3) с калием
4) с серебром
Ответ проверен экспертом
0 (0 оценок)

хихимик 7 лет назад
Светило науки — 3685 ответов — 38807 раз оказано помощи
на холоду не взаимодействует концентрированная серная кислота 2) с железом
0 (0 оценок)

dimonsnake 7 лет назад
Светило науки — 441 ответ — 1561 помощь
Вообще, с металлами до Н не вступает То бишь с медью и серебром не должно
Лучшие помощники
За сегодня
Ежедневный Еженедельный Ежемесячный За 3 месяца
Мозг Отвечающий
Лёва Середнячок
Мозг Отвечающий
Лёва Середнячок
Мозг Отвечающий
серебро меланжем из волновода и почему нельзя нагревать в меланже силикон
Лёва Середнячок
Мозг Отвечающий
Лёва Середнячок
2023 ВашУрок
Этот сайт использует cookies. Политика Cookies Вы можете указать условия хранения и доступ к cookies в своем браузере.
Установи приложение ВашУрок
Источник: vashurok.com
РЕАКЦИИ НЕ УРАВНЕНЫ, ОСТАВЛЯЮ ЭТО ТЕБЕ
Смотри, на самом деле, тут всё просто: все кислоты, кроме двух (серная H₂SO₄ и азотная HNO₃) реагируют с металлами по одной схеме: металл замещает в кислоте водород, образуя соль, а замещенный водород выделяется, собственно, в виде газа водорода Н₂ꜛ
Но! Обязательно нужно помнить про ряд активности металлов.
Если дан металл, который в ряду стоит после водорода, ТО ОН НИКОГДА НЕ ВЫТЕСНИТ ВОДОРОД ИЗ КИСЛОТЫ, а, следовательно, такая реакция не идёт!

Примеры: HCL + Al = AlCl₃ (тройка маленькая имеется ввиду, это индекс. У алюминия заряд +3, вспоминает – он в третьей группе, отдаст 3 электрона, у Cl заряд -, так как хлор в седьмой группе и принять может только один электрон, поэтому, чтобы молекула получилась не заряжена, на один трёхзарядный алюминий, нам нужно взять три однозарядных хлора. Надеюсь, обо всём этом помнишь) + Н₂
HCl + Al = AlCl₃ + H₂ꜛ (еще раз написала эту реакцию уже без пояснений всяких, чтобы водород точно не потерялся)
РЕАКЦИИ НЕ УРАВНЕНЫ, ОСТАВЛЯЮ ЭТО ТЕБЕ

Н₂SO₄(разбавл.) + Fe = FeSO₄ + H₂ (разбавленная серная кислота ведёт себя абсолютно как любая обычная, безо всяких изысков:))

НО!! HCl + Cu = Такая реакция не пойдёт, так как медь стоит в ряду активности металлов после водорода и просто не сможет его вытеснить. Проще говоря, тут принцип «кто сильней, тому и тапки». Ниже прикреплю этот ряд, чтобы всё было в одном месте.

Про разбавленную серную кислоту H₂SO₄ я уже говорила, что она реагирует как обычная, а вот с концентрированной всё не так банально.
Во-первых, с концентрированной серной кислотой при обычных условиях НЕ ВЗАИМОДЕЙСТВУЮТ Pt, Au, Fe, Al, Cr
Ну не взаимодействуют и всё тут. Fe, Al, Cr реагируют при нагревании, золото и платина не реагирует вообще никак.
Вот при температуре железо, алюминий и хром будут взаимодействовать с концентрированной серной кислотой. Алюминий (Аl) — с образованием оксида алюминия в степени окисления +3, (это стандартная для него степень окисления, так как на внешнем уровне у него три электрона, алюминий металл – значит эти три электрона он с легкостью отдаст. Вспоминаем, что электроны заряжены отрицательно. Когда металл отдает отрицательно заряженные электроны, он становится положительный), воды и серы: Al₂O₃ + Н₂О + S
Например, H2SO4(концентр) + 2Al = Al₂O₃ + H₂O + S
Не забывай, что это всё при температуре!
Железо (Fe) – с образованием соли железа в степени окисления +3 (так как концентрированная серная кислота сильный окислитель, а тем более при нагревании, отнимает сразу 3 электрона у железа и получается соль Fe₂(SO₄)₃), плюс также образуется оксид серы (4) (то есть SO₂, 4 – имеется ввиду степень окисления серы) и вода;
Как это выглядит: 2Fe + 6H₂SO₄ (концентр) = Fe₂(SO₄)₃+ 3SO₂ + 6H₂O
Что касается того, как остальные металлы реагируют с серной концентрированный и кто насколько сильный – прикрепляю пару картинок для наглядности и простоты объяснения и запоминания. Не забывай, что схема реакции: Металл + H₂SO₄(концентр) = соль + что-то с серой (H₂S, S, SO₂), смотря какой металл дан, + Н₂О!! не забываем про водичку! А то ничего не уравняется.
Что касается азотной кислоты, тут тоже всё несложно.
Концентрированная азотная кислота также, как и концентрированная серная кислота, при обычных условиях НЕ РЕАГИРУЕТ с Al, Fe, Cr!!
При нагревании реакция с этими металлами идёт по общей схеме с образованием соли этого металла, воды и оксида азота (4) (для железа Fe вместо NO₂ будет образовываться NO): МеNO₃ + Н₂О + NO₂/NO Ме – это металл какой-то имеется ввиду.
Например, 6HNO3(концентр) + Al = Al(NO₃)₃ + 3H₂O + 3NO₂ꜛ
HNO₃(концентр) + Fe = Fe(NO₃)₃ + H₂O + NOꜛ
При взаимодействии с железом, скорее будет образовываться именно NO, а не NO2, так как железо куда менее активное, чем тот же алюминий (смотреть в ряду активности металлов):
Fe + 4HNO₃(концентр) = Fe(NO₃)₃ + NOꜛ + 2H₂O
С концентрированной азотной кислотой, как и с концентрированной серной, не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt)
И концентрированная, и разбавленная азотная кислота прекрасно реагирует с медью, несмотря на то, что она находится после водорода в ряду активности.

4HNO₃(концентр) + Cu = Cu(NO₃)₂ + 2H₂O + 2NO₂

8HNO₃(разбавлен) + 3Cu = 3Cu(NO₃)₂ + 4H₂O + 2NO
Как видим, разница только в продукте с азотом.
По поводу взаимодействия металлов с концентрированной азотной кислотой всё крааайне неоднозначно: кто-то говорит, что не важно какой металл и какая у него активность – всегда побочным продуктом получается только NO₂, кто-то говорит, что важно какой активности металл даже в реакциях с концентрированной азотной кислотой и могут получиться как NO, так и NO₂, в зависимости от активности.
Я считаю и в большинстве умных книжек считают также, что с концентрированной азотной кислотой с щелочными и щелочноземельными металлами (напомню, что это металлы первой группы и второй, начиная с Ca. Be и Mg не наши;)) продукт с азотом получается N₂O (именно так, именно N₂O), ну и + Н₂О и соль не забываем, конечно же.
Все остальные металлы, не считая ВСЕХ вышеописанных случаев про азотную концентрированную, реагируют с ней с образованием соли, воды и NO2.
Например, 4Ca + 10HNO₃(концентр) = 4Ca(NO₃)₂ + 5H₂O + N₂O (это как пример на щелочные/щелочноземельные металлы)
4HNO3(концентр) + Cu = Cu(NO₃)₂ + 2H₂O + 2NO₂ (как пример реагирования обычных металлов с концентрированной кислотой).
Про разбавленную азотную кислоту также ходят легенды по поводу того, какой металл как с ней взаимодействует. Опять же, я прикреплю хорошие картинки где наглядно показано что, куда и как, хотя если разобраться, то всё очень несложно.
Смотри, первое – как и концентрированная, разбавленная азотная кислота не реагирует с благородными металлами (Au, Pt, Ir, Ta, Rh)
Второе – щелочные и щелочноземельные металлы реагируют с разбавленной азотной кислотой с образованием NH₃ (или NH₄NO₃, но роли вообще никакой, ты можешь писать, что получается как одно, так и другое, на выбор. По сути ничего не меняется оттого, поставишь ты в продукты аммиак или нитрат аммония, уравниваются они одинаково несложно, так что выбор за тобой – легально и одно, и другое).
Пример, 8Na + 9HNO₃(разбавленная) = 8NaNO₃ + 3H₂O + NH₃
8Na + 10HNO₃(разбавленная) = NaNO₃ + 3H₂O + NH₄NO₃
Как видишь, разницы нет, но опять же, принято считать, что NH₄NO₃ образуется в тех случаях, когда кислота ОЧЕНЬ разбавлена. Поэтому проще и лучше использовать в качестве продукта NH₃, а вот если говорят о щелочных и щелочноземельных металлах, растворенных в ооочень разбавленной азотной кислоте, тогда можно козырнуть вторым вариантом))
Третье – металлы, стоящие в ряду напряжения после водорода реагируют с разбавленной азотной кислотой с образованием NO

Пример, 8HNO₃(разбавлен) + 3Cu = 3Cu(NO₃)₂ + 4H₂O + 2NO
Для всех остальных, которые стоят в ряду активности металлов до водорода – картинка ниже
НЕ ЗАБЫВАЕМ В РЕАКЦИЯХ ДОПИСЫВАТЬ ВОДУ И СОЛИ – НИТРАТЫ (например, NaNO₃, Cu(NO₃)₂, Al(NO₃)₃) МЕТАЛЛОВ!

P.S на картинке могут быть отличия от того, что я написала, например – Mg не щелочной и не щелочноземельный металл, но судя по картинке, он реагирует как щелочн.зем металл и такое вполне может быть, так как он относится к активным металлам. Опять же, в этой теме сколько людей, столько и мнений. Важно понять суть! Таблица вполне адекватная, ей можно пользоваться.
А Fe и Zn не обязательно образуют NH₃ или NH₄NO₃, как указано в таблице, могут также образовать NO
Надеюсь, по теории всё стало более понятно)
Источник: poisk-ru.ru
Взаимодействие кислот с металлами
При взаимодействии соляной и разбавленной серной кислоты с металлами окислителем является ион водорода Н . Поэтому они взаимодействуют с металлами, стоящими в ряду напряжений до водорода. При этом образуется соль и выделяется водород:

Металлы переменной валентности, проявляющие переменную степень окисления, соляной и разбавленной серной кислотами окисляются, как правило, до низших степеней окисления, например:

Свинец практически не взаимодействует с соляной и разбавленной серной кислотами, так как на его поверхности образуется плотная нерастворимая пленка хлорида или сульфата свинца (II).
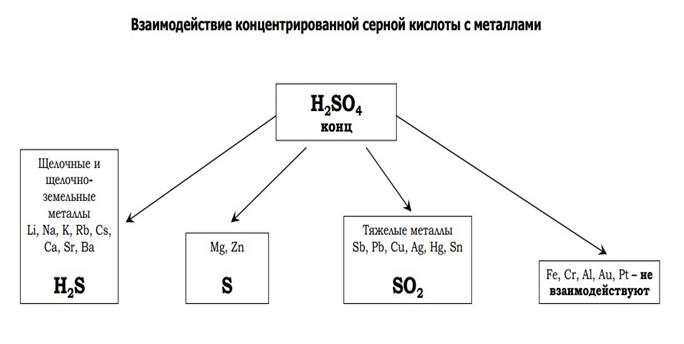
В концентрированной серной кислоте окислителем являются суль- фаг-ионы , в которых сера находится в степени окисления +6. Окисляя металл, серная кислота восстанавливается до сероводорода, серы и оксида серы (IV).

При взаимодействии концентрированной серной кислоты с активными металлами образуются соль, вода и преимущественно сероводород:
Малоактивные металлы восстанавливают концентрированную серную кислоту преимущественно до БСЬ, например:

а металлы средней активности — преимущественно до серы:

Металлы переменной валентности концентрированной НгБС^ окисляются, как правило, до высшей степени окисления, например:

Благородные металлы с концентрированной серной кислотой не взаимодействуют ни при каких условиях. Некоторые металлы (А1, Бе, Сг, N1, Тц V и др.) не взаимодействуют с концентрированной серной кислотой при обычных условиях (пассивируются), но взаимодействуют при нагревании.
Большое практическое значение имеет пассивация железа: концентрированную серную кислоту можно хранить в ёмкостях из обычной нелегированной стали.

Свинец с концентрированной серной кислотой взаимодействует с образованием растворимой кислой соли (гидросоли), оксида серы (IV) и воды:
В азотной кислоте, независимо от её концентрации, окислителем являются нитрат-ионы N0,, содержащие азот в степени окисления +5. Поэтому при взаимодействии металлов с азотной кислотой водород не выделяется. Азотная кислота окисляет все металлы за исключением самых неактивных (благородных). При этом образуются соль, вода и продукты восстановления азота (+5): 1ЧН4МОз, Ы2, N20, N0, НЫ02, Ы02. Свободный аммиак не выделяется, так как он взаимодействует с азотной кислотой, образуя нитрат аммония:


При взаимодействии металлов с концентрированной азотной кислотой (30-60 % НЬЮз) продуктом восстановления НЫОз является преимущественно оксид азота (IV), независимо от природы металла, например:
Металлы переменной валентности при взаимодействии с концентрированной азотной кислотой окисляются до высшей степени окисления. При этом те металлы, которые окисляются до степени окисления +4 и выше, образуют кислоты или оксиды. Например:

В концентрированной азотной кислоте пассивируются алюминий, хром, железо, никель, кобальт, титан и некоторые другие металлы. После обработки азотной кислотой эти металлы не взаимодействуют и с другими кислотами.
При взаимодействии металлов с разбавленной азотной кислотой продукт её восстановления зависит от восстановительных свойств металла: чем активнее металл, тем в большей степени восстанавливается азотная кислота.
Активные металлы восстанавливают разбавленную азотную кислоту максимально, т.е. образуются соль, вода и ЫН4ЫОз, например:

При взаимодействии с разбавленной азотной кислотой металлов средней активности образуются соль, вода и азот или N2O, например:

При взаимодействии разбавленной азотной кислоты с малоактивными металлами образуются соль, вода и оксид азота (II), например:

Но уравнения реакций в данных примерах условны, так как в действительности получается смесь соединений азота, причем, чем выше активность металла и ниже концентрация кислоты, гем ниже степень окисления азота в том продукте, которого образуется больше других.
Царской водкой называется смесь концентрированных азотной и соляной кислот. Она применяется для окисления и перевода в растворимое состояние золота, платины и других благородных металлов. Соляная кислота в царской водке затрачивается на образование комплексного соединения окисленного металла. Уравнения реакций золота и платины с царской водкой записываются гак:


В некоторых учебных пособиях встречается другое объяснение взаимодействия благородных металлов с царской водкой. Считают, что в этой смеси между HNO3 и НС1 происходит катализируемая благородными металлами реакция, в которой азотная кислота окисляет соляную но уравнению:
Хлорид нитрозила NOCI непрочен и разлагается но уравнению:

Окислителем металла является атомарный (т.е. очень активный) хлор в момент выделения. Поэтому продуктами взаимодействия царской водки с металлами являются соль (хлорид), вода и оксид азота (II):


а комплексные соединения образуются при последующих реакциях как вторичные продукты:
Источник: ozlib.com