В концентрированной серной кислоте окислителем является не катион водорода, а более сильный окислитель – сульфат-ион, который в разбавленной серной кислоте не проявляет себя как окислитель из-за сильной гидратации, и, как следствие – малоподвижности.
Н2SO4 (конц.) окисляет все металлы в ряду стандартных электродных потенциалов до серебра включительно.
Этим процессам восстановления серной кислоты соответствуют следующие ионно-электронные равновесные полуреакции:
SO4 2- + 8H + +6e ↔ S + 4H2O E o = +0,36B
Пользоваться данными значениями ОВПОТ некорректно, т.к. концентрация серной кислоты значительно превышает 1моль/л
Cхематично реакции окисления металлов в конц. Н2SO4 можно записать в виде:
H2S и S выделяются в случае активных металлов до цинка включительно (Е о ме Е о Zn).
SO2 выделяется при взаимодействии металлов, стоящие в таблице СЭП, ниже цинка (Е о ме Е о Zn).
Необходимо помнить, что при изменении условий реакция для одного и того же металла можно получить разные продукты, так что предложенная схема является до некоторой степени условной. Например, при длительном нагревании взаимодействие алюминия с конц. серной кислотой может идти до образования не только серы, но и сероводорода:
Реакция концентрированной серной кислоты с медью
Со щелочными металлами серная кислота конц. и разб. взаимодействует одинаково по реакции: Na + Н2SO4 (разб.,конц.) = Na2SO4 + Н2О + H2S
Существуют особенности взаимодействия свинца с серной кислотой — образуется кислая растворимая соль – гидросульфат свинца:
К каждой реакции необходимо составить уравнения ионно-электронного баланса и расставить коэффициенты. Концентрированная серная кислота — сильный окислитель, и окисляет металлы, стоящие в таблице СЭПОТ до серебра включительно
Следует иметь в виду, что металлы, проявляющие разные степени окисления, в случае кислот, в которых окислителем является катион водорода, окисляются до низших степеней окисления, а в конц. Н2SO4 – до высших. Например, железо:
Вторая реакция идет только при нагревании. В холодной конц. Н2SO4 железо, а также алюминий, хром, марганец — пассивируются. Реакцию пассивации можно написать следующим образом:
Взаимодействие концентрированной серной с неметаллами-восстановителями.
Под понятием «неметаллы-восстановители» подразумевают не только атомы неметаллов, но и их ионы, например галогенид-ионы, которые в разной степени проявляют восстановительные свойства. В зависимости от силы восстановителя (значения ОВПОТ системы) серная кислота может восстанавливаться до диоксида серы или сероводорода (в случае такого сильного восстановителя, как ион иода).
HCl + Н2SO4 реакция не идет, т.к. хлорид-ион –слабый восстановитель
Источник: studfile.net
Серная кислота не взаимодействует с металлом:
1) Mg
2) Cu
3) AL
4) Zn
Концентрированная серная кислота не реагирует при н.у с алюминием, так как металл начинает пассивировать.
Медь с серной кислотой П
Объяснение:
1) Mg + H2SO4 (р-р) = MgSO4 + H2↑ — раствор кислоты (разб.)
4Mg + 5H2SO4 (к) = 4MgSO4 + H2S↑ + 4H2O — конц.к-та
2) Cu + H2SO4 (р-р) ≠ не реагирует, так как медь не может вытеснить более «активный» водород из состава кислоты, поскольку находится правее его в ряду активности
Cu + 2H2SO4 (к) = CuSO4 + SO2↑ + 2H2O — с концентрированной идет реакция ОВР с выделением сернистого газа
3) 2Al + 3H2SO4 (р-р) = Al2(SO4)3 + 3H2↑ — алюминий легко реагирует с растворами кислот, в том числе с разбавленной серной кислотой
Al + H2SO4 (к) ≠ но данная реакция не идет, так как алюминий пассивирует
2Al + 6H2SO4 (к) =(t)=> Al2(SO4)3 + 3SO2↑ + H2O — реакция с концентрированной кислотой идет только при кипячении
4) Zn + H2SO4 (р-р) = ZnSO4 + H2↑ — цинк вытесняет водород из состава кислоты
4Zn + 5H2SO4 (к) = 4ZnSO4 + H2S + 4H2O — реагирует с концентрированной кислотой
Источник: znanijam.net
Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.

Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
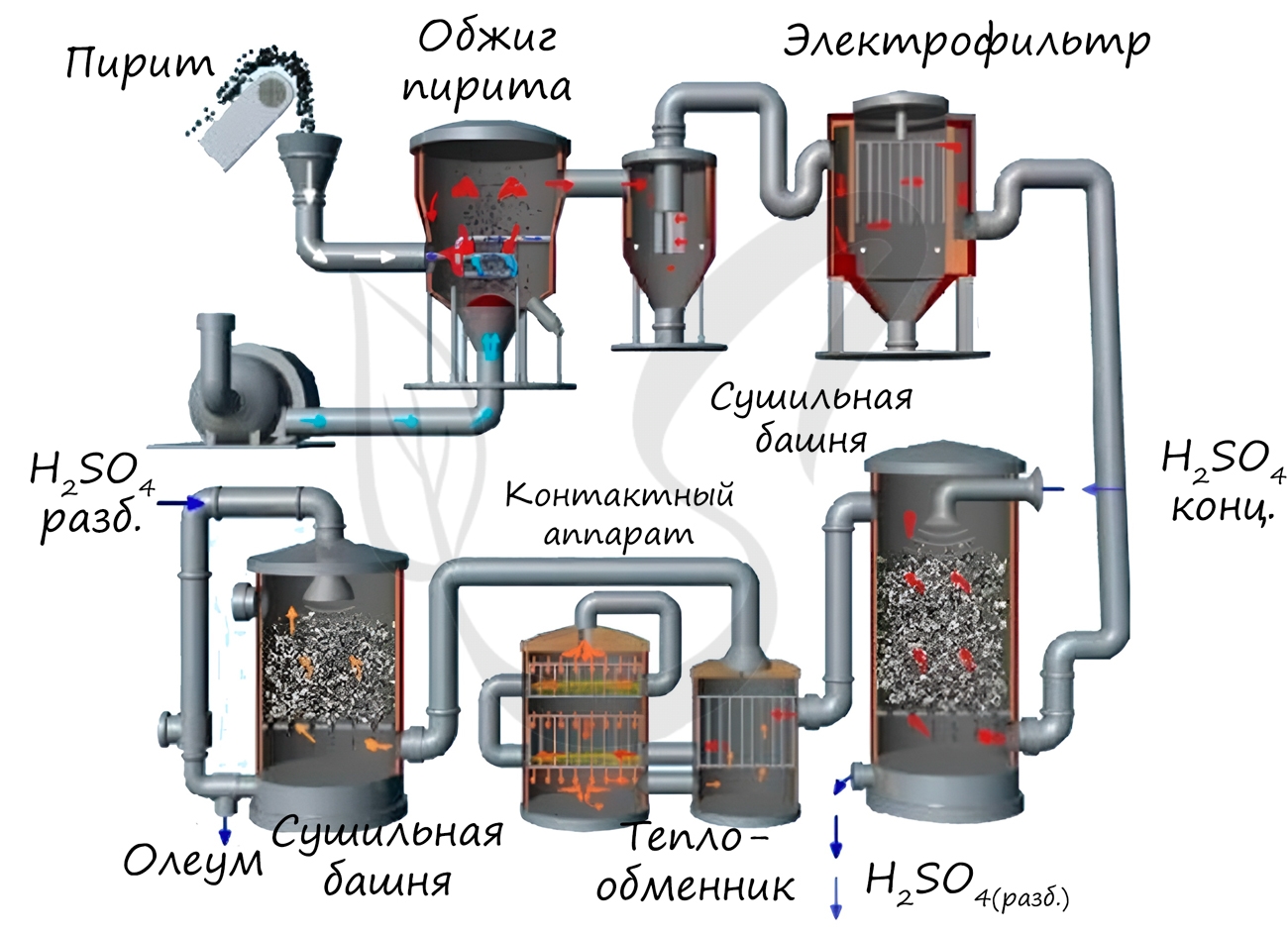
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:

Химические свойства
- Кислотные свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.


Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Серная кислота
Источник: studarium.ru