Настоящая общая фармакопейная статья предназначена для определения хлоридов методом обратного осадительного титрования в иммунобиологических лекарственных препаратах (ИЛП) и их растворителях, не содержащих другие галогениды (иодиды, фториды, бромиды), окислители или соли ртути. Методы осадительного титрования основаны на реакциях осаждения определяемого компонента титрантом — раствором, образующим осадок с определяемыми компонентами.
Для проведения реакции осаждения при титриметрическом анализе необходимо соблюдение следующих условий:
1) осадок должен быть практически нерастворим;
2) выпадение осадка должно происходить достаточно быстро;
3) результаты титрования не должны искажаться явлениями адсорбции (соосаждения);
4) при титровании должна фиксироваться точка эквивалентности.
Ионы хлора (Cl‾) определяют тиоцианометрическим (роданометрическим, аргентометрическим) методом по Фольгарду (обратное титрование). В качестве титранта используют стандартный раствор аммония тиоцианата (аммония роданида) NH4SCN, в качестве индикатора для определения точки эквивалентности — насыщенный раствор квасцов железоаммонийных (NH4Fe(SO4)2 12Н2О).
Выпадение хлорида серебра
Cущность метода обратного титрования по Фольгарду заключается в следующем: при добавлении к раствору, содержащему ионы хлора, избытка титрованного раствора серебра нитрата (AgNO3) образуется осадок серебра хлорида (AgCl). Избыток серебра нитрата оттитровывают раствором аммония тиоцианата с образованием практически нерастворимого осадка серебра роданида (AgSCN) в присутствии индикатора — квасцов железоаммонийных. В точке эквивалентности ионы железа (III) взаимодействуют с тиоцианат-ионами (SCN‾), образуя растворимое комплексное соединение тёмно-красного цвета.
Процесс обратного титрования (по методу Фольгарда) протекает по следующей схеме реакций:
Cl ‾ + Ag + = ↓AgCl + Ag + (избыток)
Ag + (избыток) + SCN ‾ = ↓Ag SCN
Fe 3 + + 3 SCN ‾ = [ Fe ( SCN)3 ]
Определение хлоридов в лекарственных средствах
В коническую колбу вместимостью 50 -100 мл вносят точный объём образца (А), содержащий 0,3–1,5 мг хлор-ионов (что при пересчёте соответствует 0,5–2,5 мг натрия хлорида), прибавляют 8–10 мл воды очищенной, 5 мл (точный объём) 0,01 М раствора серебра нитрата, 1,0 мл азотной кислоты концентрированной и перемешивают. Содержимое колбы нагревают, доводят до кипения, и осторожно по каплям прибавляют насыщенный раствор калия перманганата, не допуская вспенивания и выплёскивания, до получения фиолетово-коричневого окрашивания, не исчезающего в течение 5 мин выдерживания колбы при температуре кипения. К горячему испытуемому раствору на конце шпателя прибавляют глюкозу (40–140 мг) до исчезновения окраски.
Пробы охлаждают до комнатной температуры, прибавляют 0,5 мл насыщенного раствора квасцов железоаммонийных и при непрерывном перемешивании избыток 0,01 М раствора серебра нитрата медленно титруют 0,01 М раствором аммония тиоцианата до появления отчетливой светлой коричневато-оранжевой окраски.
Восстановление хлорида серебра
Параллельно проводят контрольный опыт с пробой, не содержащей испытуемый образец (А).
Количество ионов Cl ‾, вступивших в реакцию с AgNO3 , определяют по разнице объёмов 0,01 М раствора NH4SCN, пошедшего на титрование контрольного и анализируемого растворов.
Содержание хлоридов (Х) в процентах вычисляют по формуле:

Vк – объем 0,01 М раствора аммония тиоцианата, пошедший на титрование контрольного раствора, мл;
Vоп – объем 0,01 М раствора аммония тиоцианата, пошедший на титрование испытуемого раствора, мл;
А – объем испытуемого раствора, взятого на анализ, мл;
К – поправочный коэффициент к молярности аммония тиоцианата;
0,0003544 – титр по хлор-иону* — количество хлоридов в г, соответствующее 1 мл 0,01М раствора аммония тиоцианата;
(*для пересчёта на натрия хлорид используют значение титра по натрия хлориду – 0,0005844, г/мл);
100 – коэффициент пересчёта в проценты.
- Приготовление испытуемого раствора – указывают в фармакопейной статье или нормативной документации.
- Приготовление 0,1 М титрованного раствора серебра нитрата. В мерной колбе вместимостью 1000 мл растворяют в воде очищенной 17 г серебра нитрата, доводят объём раствора тем же растворителем до метки и перемешивают.
Около 0,15 г (точная навеска) натрия хлорида, прокалённого при температуре 250–300 ºС до постоянной массы, растворяют в 50 мл воды очищенной, добавляют 1,0 мл 5 % раствора калия хромата (К2СrO4) и титруют приготовленным раствором серебра нитрата до появления слабой красновато-оранжевой окраски, не исчезающей при перемешивании.
Молярность (М) приготовленного раствора серебра нитрата проверяют по формуле:
а – навеска натрия хлорида, г;
0,05844 – количество натрия хлорида, соответствующее 1 мл 1 М раствора натрия хлорида, г/мл;
V – объём раствора серебра нитрата, пошедший на титрование навески натрия хлорида, мл.
При несоответствии заданной молярности раствор укрепляют или разводят до 0,1 М, повторно проверяя титр раствора.
Раствор хранят в склянке из тёмного стекла с притёртой пробкой в защищённом от света месте при комнатной температуре.
- Приготовление 0,01 М раствора серебра нитрата. В мерную колбу вместимостью 50 мл вносят 5 мл 0,1 М титрованного раствора серебра нитрата, доводят объём раствора водой очищенной до метки и перемешивают. Раствор готовят перед использованием.
- Приготовление 0,1 М титрованного раствора аммония тиоцианата. В мерной колбе вместимостью 1000 мл в воде очищенной растворяют 7,6-8,0 г аммония тиоцианата, доводят объём раствора тем же растворителем до метки и перемешивают.
Титр аммония тиоцианата устанавливают по 0,1 М раствору серебра нитрата. К 20 мл 0,1 М раствора серебра нитрата прибавляют 25 мл воды очищенной, 0,5 мл азотной кислоты концентрированной, 1 мл насыщенного раствора квасцов железоаммонийных и титруют приготовленным раствором аммония тиоцианата до появления светлой жидкости коричневато-оранжевого цвета. Молярность раствора аммония тиоцианата вычисляют по формуле:
М0 – молярность 0,1 М раствора серебра нитрата, г;
V0 – объём 0,1 М раствора серебра нитрата, мл;
V – объём 0,1 М раствора аммония тиоцианата, мл.
После определения титра раствор укрепляют или разводят до 0,1 М раствора, повторно проверяя титр.
Возможно приготовление 0,1 М раствора аммония тиоцианата из стандарт-титра в ампуле (фиксанала) согласно инструкции по применению.
- Приготовление 0,01 М растворааммония тиоцианата. В мерную колбу вместимостью 50 мл вносят 5 мл 0,1 М раствора аммония тиоцианата, доводят объём раствора водой очищенной до метки и тщательно перемешивают. Раствор готовят перед использованием.
- Приготовление насыщенного раствора квасцов железоаммонийных. В 100 мл воды очищенной растворяют 40 г квасцов железоаммонийных, фильтруют, добавляют 16 % раствор азотной кислоты до перехода коричневой окраски в желтовато-зелёную. Раствор хранят во флаконе из тёмного стекла в защищённом от света месте при комнатной температуре.
- Определение поправочного коэффициента к молярности аммония тиоцианата. Поправочный коэффициент определяют как отношение теоретически заданного объёма титранта (5 мл) к его объёму в контрольном эксперименте (5/Vк). Показатель поправочного коэффициента должен находиться в пределах (1 ± 0,02).
Источник: pharmacopoeia.ru
Лабораторная работа № 20 Аргентометрическое определение хлоридов по методу Мора
Сущность метода.Метод Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калияK2CrO4. Нитрат серебра при наличии в растворе хлоридов первоначально реагирует с ними, а лишь затем после связывания всех хлоридов образуется хромат серебра оранжево-красного цвета.
Реактивы и оборудование
Нитрат серебра, раствор 0,01 моль-экв/дм 3
Хлорид натрия, раствор 0,01 моль-экв/дм 3
Хромат калия, 5 % раствор
Конические колбы для титрования
Ход определения
При содержании хлоридов менее 250 мг/дм 3 берут 100 см 3 фильтрованной испытуемой воды. При большем содержании хлоридов берут 10 – 50 см 3 исследуемой воды и разбавляют до 100 см 3 дистиллированной водой. В две конические колбы для титрования вносят по 100 см 3 анализируемой воды, прибавляют по 5 капель раствораK2CrO4. Раствор в одной колбе титруют 0,01 Н AgNO3 до изменения окраски раствора по сравнению с окраской во второй колбе (цветной свидетель).
Стандартизация титранта. Для стандартизации титранта в коническую колбу вносят 10 см 3 0,01 Н раствораNaCд и 90 см 3 дистиллированной воды, прибавляют 5 капельK2CrO4. Содержимое колбы титруют 0,01 Н растворомAgNO3до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15 – 20 сек.
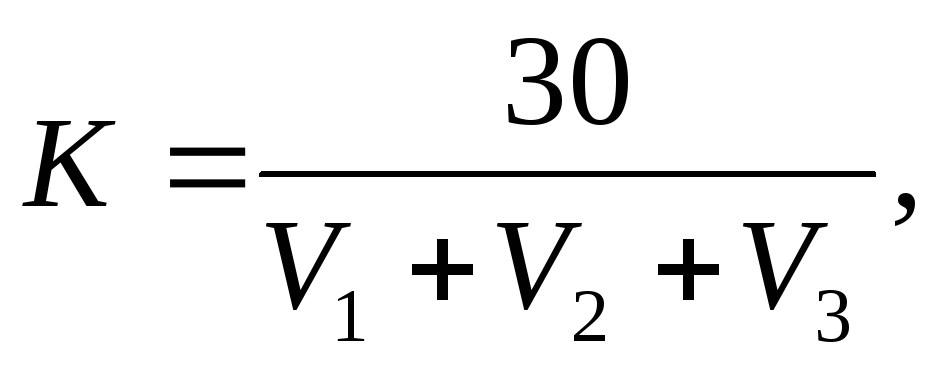
Поправочный коэффициент к титруAgNO3рассчитывают по результатам трех титрований
где V1, V2, V3 – объемы AgNO3, пошедшие на каждое из трех титрований, см 3 .
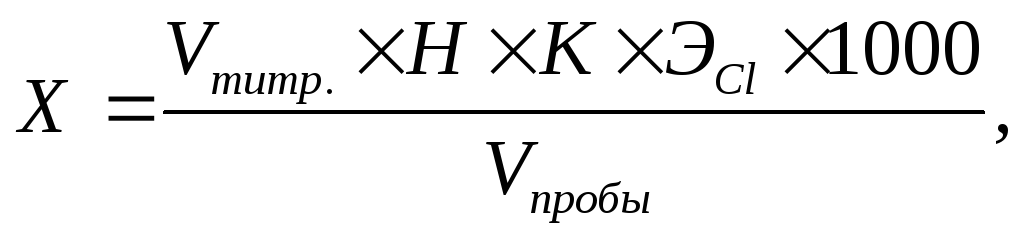
Расчет. Содержание хлорид-иона Х (мг/дм 3 ) рассчитывают по формуле:
где Vтитр. – количество раствора AgNO3, пошедшее на титрование, см 3 ;
Н – концентрация титранта – нитрата серебра, моль-экв/дм 3 ;
К – поправочный коэффициент к концентрации титранта;
ЭCl – эквивалент хлорид-иона, г/моль-экв;
Vпробы – объем воды, взятой для анализа, см 3 ;
1000 – коэффициент для перехода от граммов к миллиграммам.
Лабораторная работа № 21 Определение хлоридов с помощью ионоселективного электрода
Сущность метода.Потенциометрический метод определения хлоридов основан на определении ЭДС электродной системы, состоящей из хлоридного ионоселективного электрода и вспомогательного хлоридсеребряного электрода. Он позволяет определить суммарную концентрацию хлоридов (всех его форм: иона хлора, его комплексных соединений). Метод используется для растворов с концентрацией хлоридов 0,1 – 10,0 мг/дм 3 .
Мешающие вещества. Мешают большие количества сульфидов, хлоридов, бромидов, роданидов, образующих на поверхности электрода нерастворимые соли, а также сильные восстановители и вещества, образующие комплексные соединения с серебром (например, ЭДТА).
Реактивы и оборудование
Иономер с иононоселективным хлоридным и хлоридсеребрянным электродами
Хлорид натрия, 0,1 М раствор.
Ацетатный буферный раствор
Стаканы на 50 см 3
Мерные колбы на 100 см 3
Пипетки на 5 и10 см 3
Ход определения.
Построение градуировочного графика. Из основного стандартного раствора хлорида натрия с концентрацией 0,1 М методом последовательного десятикратного разбавления готовят растворы 10 -2 М, 10 -3 М,10 -4 М, 10 -5 М, для чего 10 см 3 раствора с более высокой концентрацией наливают в колбу на 100 см 3 и доводят водой до метки.
Полученные растворы имеют значения рCl= 1, 2, 3, 4, 5. В стакан вместимостью 50 см 3 вливают 20,0 см 3 рабочего стандартного раствора с рCl= 5, приливают 5 см 3 ацетатного буферного раствора, перемешивают на магнитной мешалке. Измеряют ЭДС при перемешивании раствора магнитной мешалкой. Аналогично измеряют ЭДС для других стандартных растворов. При выполнении измерений необходимо следить за тем, чтобы на поверхности мембраны хлоридного электрода не налипали пузырьки воздуха.
По результатам измерений строят градуировочный график зависимости значение ЭДС, милливольты – значение рCl.
Определение хлоридов в анализируемой воде. В стакан вместимостью 50 см 3 помещают 20 см 3 анализируемой воды (температура воды не должна отличаться от температуры стандартных растворов, по которым калибруют электрод, более чем на2 0 С, в противном случае воду следует подогреть или охладить). Затем помещают в раствор магнит от магнитной мешалки, приливают 5 см 3 буферного раствора и погружают в раствор тщательно промытые дистиллированной и анализируемой водой ионоселективный хлоридный и вспомогательный электроды. Измеряют ЭДС. По градуировочному графику находят значение рClанализируемой воды.
Расчет.Концентрация хлоридов в воде (Х) вмг/дм 3 рассчитывается по формуле:
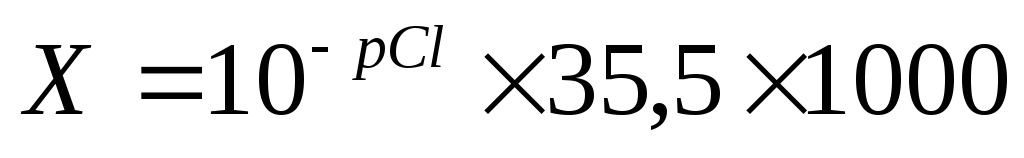
,
где рСl– показатель концентрации хлорид-иона; найденный по графику;
35,5– молярная масса иона хлора, г/моль;
1000 – коэффициент для перехода от граммов к миллиграммам.
Источник: studfile.net
4.8 Определение хлористого натрия в сливочном масле методом с азотнокислым серебром (ГОСТ 3627081)
Сущность метода сводится к следующему: при растворении навески масла в горячей воде жир всплывает наверх, а соль растворяется в воде. При добавлении азотнокислого серебра хлористый натрий вступает с ним в соединение, образуя азотнокислый натрий и хлористое серебро:
Хлористое серебро выпадает в колбе в виде белого осадка.
Как только весь хлористый натрий, содержащийся в титруемой вытяжке, будет связан азотнокислым серебром, последний вступает в реакцию с хромовокислым калием, образуя хромовокислое серебро кирпично-красного цвета. Реакция идет по следующей схеме:
Аппаратура, материалы, реактивы:
Стаканы и колбы на 100 мл; бюретки и пипетки; рабочий раствор азотнокислого серебра (2,906 г азотнокислого серебра растворяют в 100 мл дистиллированной воды); 10%-ный раствор двухромовокислого калия.
Подготовка к анализу. Пробу нагревают до температуры не выше 30 о С, обеспечивающей гомогенное состояние при смешивании механической мешалкой или вручную. Затем охлаждают до температуры (20 ± 5) о С при постоянном перемешивании.
Проведение анализа. Взвешивают около 5 г приготовленной пробы с погрешностью не более 0,001 г в коническую колбу. Осторожно добавляют к пробе 100 см 3 кипящей дистиллированной воды. Дают постоять от 5 до 10 мин, перемешивают круговыми движениями. После охлаждения до температуры 50—55 °С добавляют 2 см 3 раствора хромовокислого калия и перемешивают содержимое несколько раз.
Если масло кислосливочное (рН менее 6,5), то перед титрованием добавляют на кончике шпателя углекислого кальция и размешивают круговыми движениями. Титруют раствором азотнокислого серебра при непрерывном перемешивании до тех пор, пока не появится окраска оранжево-коричневого цвета, не исчезающая в течение 30 с.
Параллельно проводят контрольный опыт при использовании 5 см 3 дистиллированной воды вместо 5 г сливочного масла.
Массовую долю хлористого натрия в сливочном масле X3, %, вычисляют по формуле
где 5,85 — коэффициент для выражения результатов в виде процентного содержания хлористого натрия;
с — молярная концентрация титрованного раствора азотнокислого серебра, моль/дм 3 ;
νо — объем раствора азотнокислого серебра, израсходованный на титрование контрольной пробы, см 3 ;
ν1 — объем раствора азотнокислого серебра, израсходованный на титрование при анализе сливочного масла, см 3 ;
М — масса навески сливочного масла, г.
За окончательный результат анализа принимают среднеарифметическое результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,02 %.
Источник: myzooplanet.ru