Способы осаждения серебра делятся на две группы: осаждение серебра в виде нерастворимой соли с помощью химических реагентов и восстановление серебра каким-либо неблагородным металлом. В качестве химических реагентов применяют кристаллический сернистый натрий, гидросульфат натрия, формалин. Металлическим осадителем обычно является цинковая пыль. Иногда применяют также алюминиевую пыль или стружку, а также железную стружку. [19]
Способы осаждения серебра делятся на две группы: осаждение серебра в виде нерастворимой соли с помощью химических реагентов и восстановление серебра каким-либо неблагородным металлом. В качестве химических реагентов применяют кристаллический сернистый натрий, гидросульфит натрия, формалин. Металлическим осадителем обычно является цинковая пыль. Иногда применяют также алюминиевую пыль или стружку, а также железную стружку. [21]
При осаждении серебра из цианистых растворов, в которых поверхность электрода в большинстве случаев не пассивируется, как правило, обеспечивается хорошее сцепление покрытия с основным металлом. [22]
самый простой и быстрый метод аффинажа тех. серебра! Метод Соды! Как очистить техническое серебро.
При осаждении серебра на хромоникелевую нержавеющую сталь предварительно осаждают подслой никеля, затем меди и лишь потом осаждают серебро. Осаждение серебра на алюминий начинают с контактного осаждения цинка, затем изделие подвергают меднению и серебрению. [23]
При осаждении серебра из цианистых растворов, в отличие от азотнокислых, на поверхности электрода образуется большое число мелких кристаллов. [24]
Фильтрат от осаждения серебра ( фильтрат VI), а при отсутствии его-первоначальный азотнокислый раствор-выпаривают на водяной бане досуха до полного удаления кислоты. Остаток обрабатывают водой-появление мути или осадка возможно при наличии висмута. [25]
Таблица Продолжительность осаждения серебра при выходе по току 100 %, мин. [26]
Современные способы осаждения серебра из фиксажа позволяют восстановить ( регенерировать) этот фиксаж и использовать его повторно после добавления недостающего количества тиосульфата натрия, израсходованного на химические реакции при фиксировании. [27]
В случае осаждения серебра в аппарате М-4 применяют цинковую пыль, не вызывающую образования сернистого натрия. Сначала в бутыль засыпают расчетное количество цинковой пыли, а затем заливают фиксаж примерно на 2 / з объема бутыли. Процесс осаждения серебра продолжается около суток. Бутыль при этом периодически через 3 — 4 ч покачивают для перемешивания раствора и обеспечения полноты осаждения серебра. [28]
Современные способы осаждения серебра из фиксажа позволяют восстановить ( регенерировать) этот фиксаж и использовать его повторно после добавления недостающего количества тиосульфата натрия, израсходованного на химические реакции при фиксировании. [29]
Существующие способы осаждения серебра из серебросодер-жащих растворов делятся на химические и электролитические. [30]
Источник: www.ngpedia.ru
Аффинаж технического серебра методом электролиза! Простой способ очистки тех. серебра
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ. КЛАССИФИКАЦИЯ МЕТОДОВ, ТРЕБОВАНИЯ К РЕАКЦИЯМ. АРГЕНТОМЕТРИЯ. МЕРКУРИМЕТРИЯ
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, растворимых солей серебра, среди которых NaCl, КВг, КI, AgNО3 и др. входят в состав лекарственных форм. Эти методы также применяют для определения лекарственных препаратов: димедрола гидрохлорида, бромкамфоры, новокаина гидрохлорида и других. Титриметрические методы осаждения основаны на применении при титровании реакций, сопровождающихся образованием малорастворимых соединений. От гравиметрического метода осаждения они отличаются тем, что при титровании к определяемому веществу прибавляют эквивалентное количество осадителя в виде стандартного раствора. Содержание определяемого компонента (вещества) рассчитывают по величине объема титранта, израсходованного на осаждение определяемого вещества.
В количественном анализе могут быть использованы только те, которые отвечают следующим требованиям:
1. Реакция между определяемым веществом и стандартным раствором (титрантом) должна протекать в условиях, обеспечивающих образование осадка с минимальной растворимостью (S ≤ 10 -5 моль/дм 3 ).
2. Реакция образования осадка должна протекать быстро, количественно, стехиометрично. При этом не должно наблюдаться образование пересыщенных растворов.
3. Должна быть возможность выбора индикатора для фиксирования конечной точки титрования.
4. Явления адсорбции и соосаждения не должны влиять на результаты определения.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами: — серебра Аg + + Вr — ↔ AgВr↓ — ртути Hg2 2+ + 2Сl — ↔ Hg2Cl2↓ — бария Ва 2+ + SO4 2- ↔ BaSO4↓ — свинца Pb 2+ + CrO4 2- ↔ PcrO4↓
Наиболее широко применяют методы, основанные на реакциях осаждения малорастворимых солей серебра: Аg + + Наl — ↔ AgНаl↓ где Наl — являются Сl, Br — , I — и др. Эти методы объединены в раздел титриметрического анализа, называемый аргентометрией. В титриметрии применяют также метод меркурометрии, основанный на осаждении малорастворимых солей ртути (I), таких как Hg2C12, Hg2Br2, Hg2I2 Hg2 2+ + 2Сl — ↔ Hg2Cl2↓
АРГЕНТОМЕТРИЯ
Аргентометрический титриметрический метод анализа основан на применении в качестве осадителя стандартного раствора серебра нитрата: Аg + + Наl — ↔ АgНаl↓
Стандартный раствор 0,1 моль/дм 3 серебра нитрата может быть приготовлен:
— как первичный стандартный раствор;
— вторичный стандартный раствор.
Концентрация стандартных растворов серебра нитрата изменяется при длительном хранении. Причиной нестойкости растворов серебра нитрата является их светочувствительность, потому эти растворы следует хранить в склянках из темного стекла либо в посуде, обернутой черной бумагой или покрытой черным лаком, и в защищенном от света месте. Их концентрацию необхо-димо периодически проверять.
СПОСОБЫ ОПРЕДЕЛЕНИЯ КОНЕЧНОЙ ТОЧКИ ТИТРОВАНИЯ
В методе аргентометрии используют как безындикаторные, так и индикаторные способы фиксирования конечной точки титрования.
Безъиндикаторные способы
Хлорид — ионы определяют по так называемому способу равного помутнения (метод Гей-Люссака). При этом анализируемый раствор титруют стандартным раствором серебра нитрата, конец титрования определяют путем отбора двух проб титруемого раствора в две пробирки вблизи конечной точки титрования: в одну из них прибавляют каплю стандартного раствора серебра нитрата, в другую – каплю стандартного раствора натрия хлорида такой же концентрации. В недотитрованном растворе появляется помутнение в пробирке с серебра нитратом, в перетитрованном — в пробирке с натрия хлоридом. В конечной точке титрования раствор в обеих пробирках имеет одинаковое помутнение.
Бромид- и йодид- ионы определяют безъиндикаторным способом просветления. Суть его состоит в том, что при добавлении к анализируемому раствору из бюретки небольшими порциями стандартного раствора серебра нитрата в начале образуется коллоидный раствор серебра бромида, а в момент эквивалентности происходят коагуляция коллоидных частиц и осаждение их в виде творожистых хлопьев, раствор при этом осветляется. Этот метод достаточно точен, но в настоящее время применяется редко.
Из современных безъиндикаторных методов в аргентометрии чаще всего применяется потенциометрическое определение точки эквивалентности с использованием серебряных или галогенидселективных электродов.
Индикаторные способы
Подбор индикаторов в аргентометрии очень сложен. Для его выполнения, как и в кислотно-основном методе титрования, используют кривую титрования (рис. 1), представляющую собой графическое изображение изменения концентрации определяемых ионов в конце титрования, то есть когда недотитровано 10 % определяемого вещества и когда раствор перетитрован стандартным раствором на 10 %.
На кривой титрования видно, что вначале рСl изменяется медленно и лишь вблизи точки эквивалентности — скачкообразно. Резкое изменение pCl вблизи точки эквивалентности называется скачком титрования. Скачок титрования начинается, когда недотитровано 0,1 % NaCl, и заканчивается, когда раствор перетитрован на 0,1 %. Общая величина скачка титрования —
2 ед. рСl. Кривая титрования симметрична относительно точки эквивалентности ТЭКВ.
На величину скачка титрования влияют следующие факторы:
1. Концентрация реагирующих веществ: чем выше концентрация,
тем больше скачок титрования. Для растворов 1 моль/дм 3 NaCl и AgNO3скачок титрования составляет 4 ед. рСl; для раствора 0,1 моль/дм 3 (рассматриваемый нами случай) — 2 ед. рСl, а при концентрации 0,01 моль/дм 3 — 0,3 ед. рСl;
2. Растворимость осадка: чем ниже растворимость и чем меньше произведение растворимости (ПР), тем больше скачок титрования. Например, при Ks(AgCl) = 1,78 ∙ 10 -10 , Ks(AgBr) = 5,3 ∙ 10 -13 и Ks(AgI) = 8,3 ∙ 10 -17 скачок титрования для АgСl занимает 2 ед. рСl, AgBr — 4 ед. рВ и для АgI — 8 ед.соответственно.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Химия извлечения серебра из фиксирующих растворов
На построение фотографического изображения расходуется в среднем около 20% серебра, содержащегося в светочувствительном слое. Остальная часть серебра практически переходит в фиксирующий раствор. В 1 л использованного фиксажа обычно содержится от 2 до 7 г серебра. Серебро является драгоценным металлом, поэтому выливать в канализацию отработанный фиксаж нельзя. Серебро можно извлечь из раствора либо переводом его в труднорастворимуго соль Ag2S, либо восстановлением до металлического при помощи активного восстановителя.
Осаждение труднорастворимой соли сульфида серебра производят после предварительного подщелачивания раствора фиксажа едкой щелочью с целью последующей нейтрализации сероводорода H2S, который выделяется при осаждении серебра сульфидом натрия. К щелочному раствору фиксажа постепенно приливают при постоянном помешивании 20%-ный раствор сульфида натрия Na2S. Сульфид натрия, реагируя с комплексной солью серебра, образует труднорастворимую соль серебра Ag2S, которая выпадает в осадок. В общем виде реакция сульфидного способа осаждения серебра протекает по уравнению:
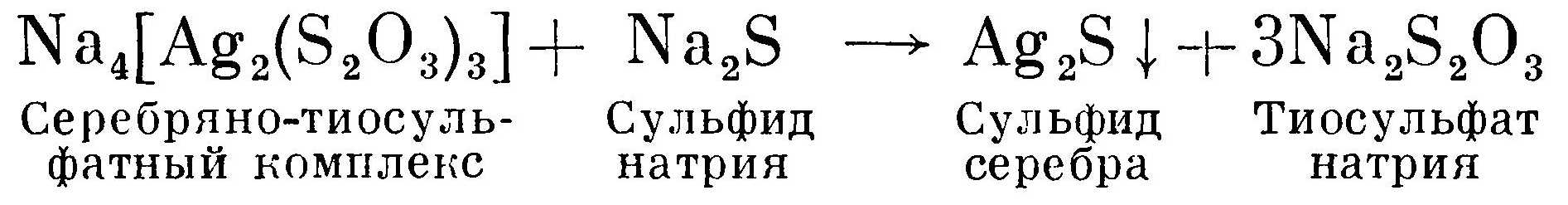
Через сутки после отстаивания на дне сосуда осаждается сульфид серебра. Осадок содержит около 87% серебра.
Сульфидный метод осаждения серебра очень прост, но имеет один недостаток: процесс осаждения сопровождается неприятным запахом.
Другой способ заключается в восстановлении серебра до металлического с помощью активного восстановителя — дитионита натрия Na2S2O4.
Раствор кислого фиксажа предварительно подщелачивают содой до рН = 7—8, после чего добавляют дитионит натрия. Необходимо подогревание раствора. Выпавший осадок почти на 100% состоит из металлического серебра. На 1 л отработанного фиксажа добавляют не менее 20 г безводной соды и 20 г дитионита натрия. Это наиболее эффективный способ регенерации серебра в непроизводственных условиях.
Реакция восстановления серебра из щелочного раствора отработанного фиксажа, по-видимому, протекает по следующей схеме:
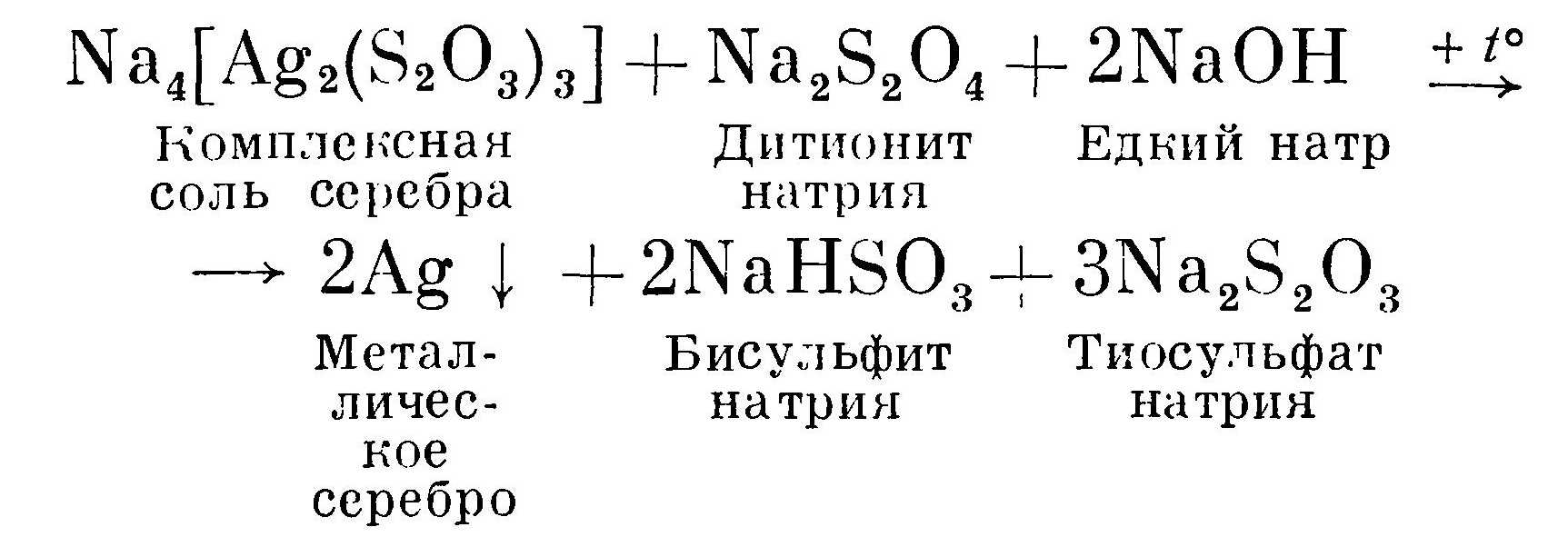
Осадок высушивают и сдают государству в установленном порядке.
Источник: 31belka.ru