Марганец – твердый металл серого цвета. Может менять свою степень окисления: +2, +4, +6, +7. Чем выше степень окисления, тем более ковалентный характер носит соединение.
Наиболее важное соединение – нерастворимый оксид марганца (IV) коричнево-черного цвета, который является весьма сильным окислителем.
Соединения со степенью окисления +6 малоустойчивы, но самое главное – манганат калия K2MnO4 устойчив в щелочной среде. Он получается в результате:
Степень окисления +7 марганец имеет в перманганате калия KMnO4. Это растворимая соль фиолетового цвета. Является очень сильным окислителем.
В кислой среде он восстанавливается до Mn 2+ :
Применение марганца.
В технике применяются тройные сплавы марганец-медь-никель – манганины. Они обладают большим электрическим сопротивлением, не зависящим от температуры, но зависящим от давления. Поэтому манганины используются при изготовлении электрических манометров.
Интересны сплавы марганца с медью (особенно 70% Mn и 30% Cu), они могут поглощать энергию колебаний, это находит применение там, где необходимо уменьшить вредные производственные шумы.
Химические св-ва соединений марганца Mn (+7) (KMnO4). Решаем окислительно-восстановительные р-ции.
Биологическая роль марганца.
Это важнейший микроэлемент, который участвует в регуляции биохимических процессов. Марганец участвует в основных нейрохимических процессах в центральной нервной системе, в образовании костной и соединительной тканей, регуляции жирового и углеводного обмена, обмене витаминов С, Е, холина и витаминов группы В.
Избыток марганца приводит к нарушению функционирования центральной нервной системы: утомляемость, сонливость, ухудшение памяти.
Дефицит марганца – одно из распространенных отклонений в элементном обмене современного человека. Это связано со значительным снижением потребления богатых марганцем продуктов (грубая растительная пища, зелень), увеличением количества фосфатов в организме (лимонады, консервы и др.), ухудшением экологической ситуации в крупных городах и психо-эмоциональной перенапряженностью. Коррекция дефицита марганца оказывает положительное влияние на состояние здоровья человека
Источник: www.calc.ru
Марганец — важный металл с широким спектром применения

Марганец — элемент таблицы Менделеева, черный металл, так же как и железо. В чистом виде не встречается, в основном существует в виде оксидов в марганцевых и железных рудах. Марганец — рассеянный элемент: в очень небольших количествах содержится в почвах, в растениях, в организмах животных. В воде почти не содержится, реками выносится с суши в Мировой океан, где накапливается в глубоких местах.
Свойства
Немагнитный металл светло-серебристого цвета, быстро покрывается оксидной пленкой, хрупкий, твердый. Активно вступает в реакции (при нагревании) с неметаллами, соляной и разбавленной серной кислотой, проявляет валентность от 2 до 7. Плохо реагирует с водой. Образует кислоты и щелочи, соответствующие им соли, сплавы со многими металлами.
Молярная масса. 8 класс.
Марганец играет важную роль в жизнедеятельности человека: участвует в работе нервной, иммунной, половой систем; в белковом, углеводном и жировом обмене; в процессах кроветворения, пищеварения, роста; необходим для правильного формирования плода. При длительном (около 3 лет) вдыхании пыли на промышленном производстве возможно отравление марганцем.
В различных сферах производства реактив применяется и в чистом виде, и в виде соединений.
Применение марганца
— Почти 90% всего металла расходуется в черной металлургии. В виде ферромарганца — сплава с железом, его добавляют в сталь, чтобы повысить ее ковкость, прочность, износоустойчивость. Хим. реактив необходим для процессов легирования, десульфурации, «раскисления» сталей.
— Добавляется в сталь Гадфильда (до 13%), обладающую выдающейся твердостью. Из нее делают землеройные и камнедробильные машины, элементы брони.
— В цветной металлургии входит в состав железо несодержащих сплавов, в бронзу, латунь, большинство алюминиевых и магниевых сплавов для улучшения их прочности и устойчивости к коррозии.
— Используется при изготовлении сплава из марганца, меди и никеля, отличающегося высоким сопротивлением. Этот сплав востребован в электротехнике.
— Применяется для создания устойчивых к коррозии гальванических покрытий металлических изделий.
Применение соединений марганца

— В органическом синтезе в качестве окислителей и катализаторов; в полиграфии и производстве красок; в стекольной и керамической индустрии.
— В сельском хозяйстве в качестве микроудобрений, для обработки семян.
— Двуокись марганца применяется в различных областях: при изготовлении гальванических элементов; цветных глазурей и эмалей для керамики; в химической индустрии, в органическом и неорганическом синтезе; мелкодисперсионный порошок применяют для поглощения вредных примесей из воздуха.
— Теллурид марганца используют в термоэлектрике.
— Арсенид марганца обладает выраженным магнитокалористическим эффектом, на основе которого основан перспективный метод для создания компактных и экономных холодильных установок нового типа.
— Перманганат калия — популярный антисептик в медицине, антидот при отравлении цианидами и алкалоидами; отбеливающее средство в текстильной промышленности; окислитель в органическом синтезе.
В Prime Chemicals Group вы можете купить различные соединения марганца, а также другие химреактивы, посуду и оборудование, необходимые для лабораторий и производств. Менеджеры помогут разобраться в широком ассортименте, выбрать нужные товары и оформить покупку. Хорошие цены и сервис делают сотрудничество с нами комфортным.
Источник: pcgroup.ru
Подгруппа марганца
Побочная подгруппа VII группы
Свойства элементов подгруппы марганца

Физические свойства
Серебристо-белые, тугоплавкие металлы.
Химические свойства
- В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H + -> Mn 2+ + H2
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
2. С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Марганец и его соединения
Марганец
Электронная конфигурация валентного слоя
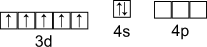
Получение
Химические свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Растворяется в кислотах:
(При этом образуются соединения двухвалентного марганца).
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
Гидроксид марганца (II) Mn(OH)2 — светло-розовое нерастворимое в воде основание:
Легко растворимо в кислотах:
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
При действии сильных окислителей наблюдается переход Mn 2+ в MnO4 — :
2Mn(OH)2 + 5Br2 + 12NaOH – кат.CuSO4 > 2NaMnO4 + 10NaBr + 8H2O
Оксид марганца (IV) MnO2 — тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C).
При сплавлении с содой и селитрой образует манганат натрия тёмно — зелёного цвета:
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Оксид марганца (VII) Mn2O7 — тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
При растворении в щелочах образует перманганаты:
Перманганат калия KMn +7 O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
Сильный окислитель, причём восстанавливается в кислой среде до Mn 2+ , в нейтральной – до Mn +4 O2, а в щелочной – до Mn +6 O4 2- .
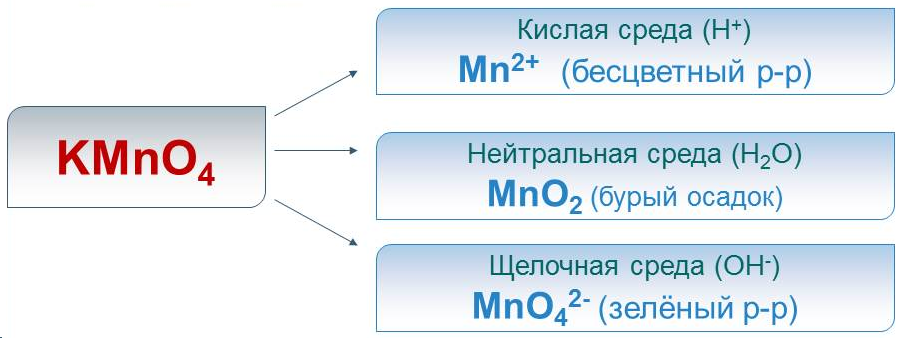
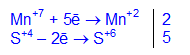
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
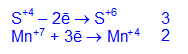
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
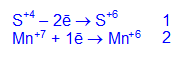
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Источник: kemuk.ru