Марганец (Mn), химический элемент VII группы периодической системы Менделеева с атомным номером 25, атомная масса 54,9380. А так это тяжелый серебристо-белый металл.
1. Соединения марганца, в частности пиролюзит (МnО2), известны и применяются с древних времен. Он именовался чёрной магнезией и использовался при варке стекла для его осветления. Первым металлический марганец в чистом виде впервые был получен в 1774 году химиками Ю.Ган и К.В.Шееле.
2. Между прочим, швед Карл Шелле, открывший марганец, является рекордсменом по общему количеству открытых химических элементов. В его копилке есть еще вольфрам, кислород, хлор, барий, фтор и молибден.
3. Сам термин «марганец» (или manganesium) был принят в 1787 г. Французской комиссией по номенклатуре, но лишь в нач. XIX в. он стал всеобщим. Позднее данный металл, чтобы избежать путаницы с магнием (magnasium), открытым Х. Дэвидом в 1808 г., был переименован в manganium.
4. В пер. пол. XIX в. в России его химики называли «марганцовик», а позднее «манганес», металл использовался в изготовлении пурпурной финифти. Лишь спустя какое-то время в России утвердилось наименование «марганец».
ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических Элементов
5. Во время разрухи, которая была вызвана гражданской войной начала ХХ века, молодая Советская Россия сильно нуждалась в иностранной валюте. Одним из самых первых продуктов экспорта Советского Союза была марганцевая Чиатурская руда. Рудник восстановили в 1923 г., и с тех пор у причалов Поти собирались десятки иностранных кораблей, вывозивших руду. В начале 30-х годов был построен Зестафонский ферросплавный завод, на котором из чиатурской руды получали ферромарганец.
6. В 1898 г. О. Гейслер обнаружил, свойство марганца образовывать сплавы с оловом, алюминием, сурьмой и медью. Такие сплавы могут намагничиваться, хоть в них и не содержатся ферромагнитные компоненты. Данное свойство появляется из-за того, что в этих сплавах образуются интерметаллические соединения. Также выяснилось, что олово можно заменить бором, алюминием, мышьяком, сурьмой или висмутом, а ферромагнетические свойства при этом все равно сохранятся. Такие материалы по сей день называют сплавами Гейслера.
8. Марганец в чистом виде не встречается в природе. В рудах элемент присутствует в форме карбонатов, окислов и гидроокисей. Основным минералом, содержащим марганец, является пиролюзит, представляющий собой относительно мягкий камень темно-серого цвета. Содержание марганца в нем составляет 63,2%. Существуют и другие руды марганца: манганит, псиломелан, браунит, гаусманит.
Все это силикаты и окислы марганца. В них валентность марганца составляет 2, 3, 4. Содержание марганца в земной коре равняется примерно 0,1 % по массе.
9. Марганец является 14-м элементом по распространённости на нашей планете, и второй тяжёлый металл после железа.
10. Температура плавления 1517 K, температура кипения 2235 K. Плотность (при н. у.) 7,21 г/см³.
11. На всех континентах нашей планеты есть месторождения марганцевых руд. Примерно 50% мировой добычи руд марганца приходится на долю Российской Федерации. Также богаты марганцем Бразилия, Индия, Гана, Марокко, Южно-Африканская Республика. Огромные залежи родонита, одного из основных минералов марганца, встречаются на Урале, где была когда-то найдена глыба родонита, имеющая массу в 47 тонн. Уральское месторождение родонита является самым крупным в мире.
Химический элемент или простое вещество? | 1 задание ОГЭ химия | XIMOZA
12. В глубоких местах Мирового океана концентрация марганца возрастает примерно до 0,3 % в результате окисления кислородом, растворённым в воде, с образованием оксида марганца, нерастворимого в воде, находящегося в гидратированной форме (MnO2•xH2O) и опускающегося в нижние слои водяной толщи, формируя железо-марганцевые конкреции, количество марганца в которых может достигать 45 % (в них также имеются примеси кобальта, меди и никеля). Такие конкреции в будущем могут стать промышленным источником марганца.
13. Сам по себе марганец достаточно активен, в результате нагревания энергично взаимодействует кислородом, образуется смесь оксидов Марганца различной валентности, азотом, фосфором, серой, углеродом и другими неметаллами. На комнатной температуре в атмосфере воздуха марганец не изменяется, металл очень медленно вступает в реакцию с водой. В разбавленной серной и в соляной кислоте легко растворяется, при этом образует соли марганца второй валентности. В результате нагревания в вакууме легко испаряется, в том числе из сплавов.
14. Марганец способен образовывать сплавы с огромным количеством химических элементов. Большинство существующих металлов растворяется в некоторых модификациях марганца и стабилизирует их.
15. Если растворить в воде пиролюзит, который сплавлен с едким кали и селитрой, получится зеленый раствор. Постепенно цвет раствора будет меняться. Раствор станет синим, затем фиолетовым, после малиновым, ну а в завершении на дно колбы выпадет бурый осадок. Однако стоит лишь взболтать колбу, как вновь раствор принимает зеленую окраску.
За такие изменения окраски Шееле прозвал КаМnO4 — марганцовистокислый калий — «минеральным хамелеоном». Данное название употреблялось на протяжении более чем сотни лет спустя открытие Шееле.
16. Основным потребителем марганца является черная металлургия, она расходует в среднем 8-9 килограмм марганца на 1 тону выплавляемой стали. Введение до 12-13 % марганца в сталь, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (такая сталь потом используется для изготовления броневых элементов).
17. Марганец относится к самым важным жизненно необходимым микроэлементам и принимает участие в регуляции наиважнейших биохимических процессов. Учеными установлено, что элемента № 25 в небольших количествах присутствует во всех известных живых организмах. Марганец принимает участие в важнейших нейрохимических процессах центральной нервной системы, в образовании соединительной и костной тканей, в регуляции углеводного и жирового обмена, а также в обмене витаминов группы В, витаминов С, Е и холина.
19. Марганец влияет на рост, образование крови и функции половых желёз.
21. Избыток марганца в организме сказывается на функционировании центральной нервной системы (появляется утомляемость, сонливость, ухудшение функций памяти). Токсическая доза для людей — 40 мг марганца в день. При отравление марганцем у людей нарушается психика, появляется галлюцинация «марганцевое безумие».
Ещё по теме:
Ваш Промблогер №1 Игорь (ZAVODFOTO)! Подписывайтесь на мой канал, я Вам ещё много чего интересного покажу: https://zen.yandex.ru/zavodfoto
На данный момент я уже лично посетил более 400 предприятий, а вот и ссылки на все мои промрепортажи:
Я всегда рад новым друзьям, добавляйтесь и читайте меня в:
Источник: dzen.ru
Марганец, цинк и серебро
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

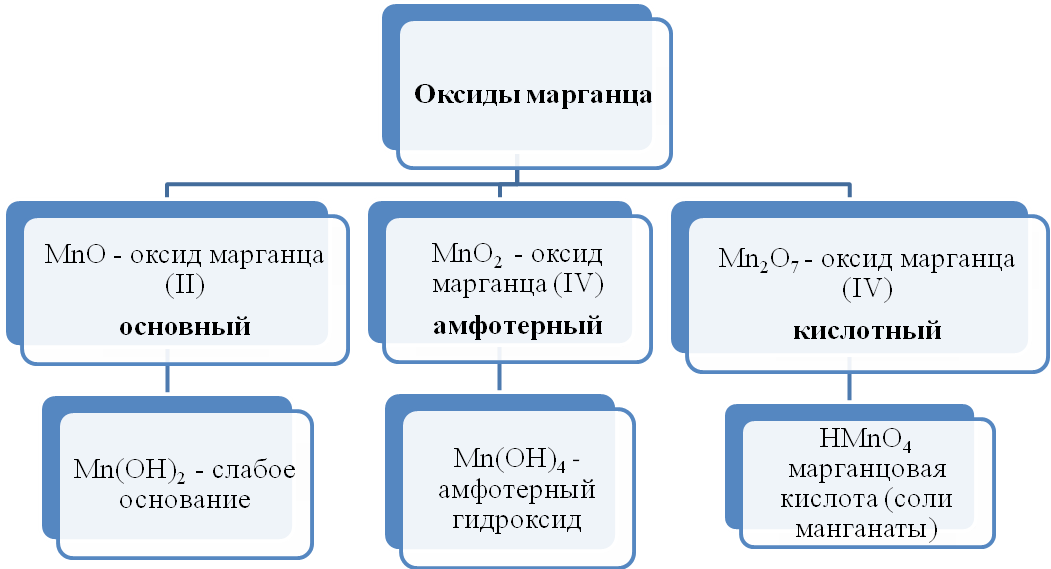
Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 — амфотерные, +6, +7 — кислотные.

- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
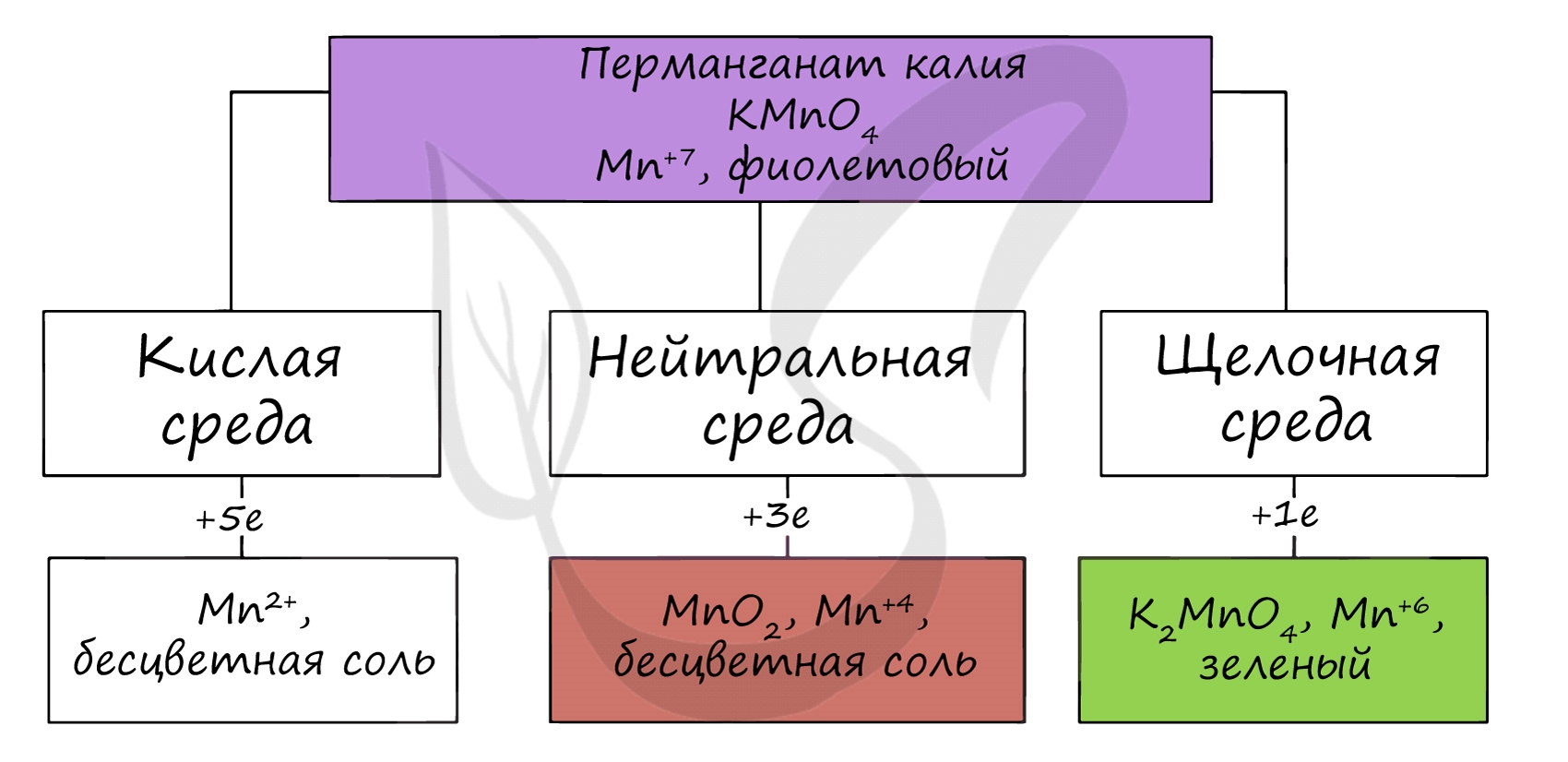
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn 2+ , в щелочной — Mn 6+ .
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
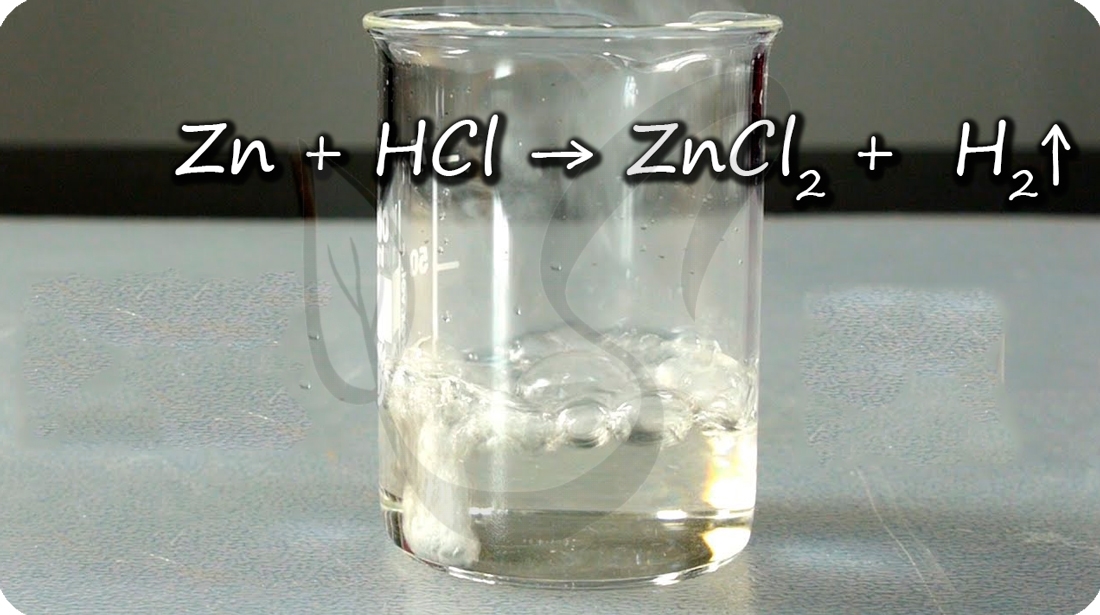
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Марганец, цинк и серебро
Источник: studarium.ru
Марганец

Mn, химический элемент с атомным номером 25, атомная масса 54,9. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55 Mn. Конфигурация двух внешних электронных слоев атома марганца 3s 2 p 6 d 5 4s 2 . В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 до +7, наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Марганец в компактном виде — твердый серебристо-белый, хрупкий металл.
Химические свойства
Марганец – активный металл.
- Взаимодействие с неметаллами
При взаимодействии металлического марганца с различными неметаллами образуются соединения марганца (II): Мn + С2 = МnСl2 (хлорид марганца (II)); Mn + S = МnS (cулъфид марганца (II)); 3Мn + 2 Р = Мn3Р2 (фосфид марганца (II)); 3Mn + N2 = Мn3N2 (нитрид марганца (II)); 2Mn + N2 = Мn2Si (силицид марганца (II)).
- Взаимодействие с водой
При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью: Mn + 2H2O = MnO2 + 2H2
- Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов марганец находится до водорода, он вытесняет водород из растворов неокисляющих кислот, при этом образуются соли марганца (II): Mn + 2HCl = MnCl2 + H2; Mn + H2SO4 = MnSO4 + H2; с разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II): 3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O. Концентрированная азотная и серная кислоты пассивируют марганец. Марганец растворяется в них лишь при нагревании, образуются соли марганца (II) и продукты восстановления кислоты: Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O; Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
- Восстановление металлов из оксидов
Марганец – активный металл, способен вытеснять металлы из их оксидов: 5Mn + Nb2O5 = 5MnO + 2Nb. Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами: 2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O. Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще) 2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH, так и восстановителей 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl. Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата: 2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. Применение: более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10.
Источник: studfile.net