Все знают, что крупный алмаз стоит больших денег. Почти все — что это самое твердое природное вещество. А мы знаем кое-что еще и с удовольствием поделимся этими знаниями.Неограненные
Горят ли алмазы
Алмаз считается самым твердым минералом на планете. Он способен разрезать стекло. Многие ученые ставили эксперименты, подвергая алмаз механическим и химическим воздействиям. И в итоге было найдено его слабое место: алмаз способен гореть.

- Горят ли алмазы
- Имеет ли алмаз блеск
- Имеет ли алмаз запах
Свойства алмаза
Слово «алмаз» пришло из греческого языка. На русский оно переводится как «непреодолимый». И действительно, чтобы повредить этот камень, нужно приложить нечеловеческие усилия. Он режет и царапает все известные нам минералы, при этом сам остается невредимым. Ему не вредит кислота. Однажды из любопытства был проведен эксперимент в кузнице: алмаз положили на наковальню и ударили по нему молотом. Железный молот почти раскололся надвое, а камень остался целым.
Как ГОРИТ настоящий АЛМАЗ? Эксперименты с бриллиантами.
Из всех твердых тел алмаз обладает самой высокой теплопроводностью. Он устойчив к трению, даже об металл. Это самый упругий минерал, обладающий самым низким коэффициентом сжатия. Интересное свойство алмаза — люминесцировать на солнце и под воздействием искусственных лучей. Он светится всеми цветами радугами и интересно преломляет цвет. Этот камень будто напитывается солнечным цветом, а затем излучает его. Как известно, природный алмаз некрасив, истинную красоту ему придает огранка. Драгоценный камень из обработанного алмаза называется бриллиантом.
История опытов
В 17 веке в Англии физик по фамилии Бойль сумел сжечь алмаз, наведя на него солнечный луч через линзу. Однако во Франции опыт с прокаливанием алмазов в плавильном сосуде не дал никаких результатов. Французский ювелир, проводивший эксперимент, обнаружил лишь тонкий слой темного налета на камнях. В конце 17 века итальянские ученые Аверани и Тарджони при попытке сплавить два алмаза воедино смогли установить температуру, при которой горит алмаз — от 720 до 1000оС.
Алмаз не плавится из-за прочной структуры кристаллической решетки. Все попытки расплавить минерал заканчивались тем, что он сгорал.
Великий французский физик Антуан Лавуазье пошел дальше, решив поместить алмазы в герметичный сосуд из стекла и наполнив его кислородом. С помощью крупной линзы он нагрел камни, и они полностью сгорели. Исследовав состав воздушной среды, они выяснил, что помимо кислорода в ней присутствует диоксид углерода, представляющий собой соединение кислорода и углерода. Таким образом, был получен ответ: алмазы горят, но только при доступе кислорода, т.е. на открытом воздухе. Сгорая, алмаз превращается в углекислый газ. Вот почему в отличие от угля после сгорания алмаза не остается даже золы. Опыты ученых подтвердили еще одно свойство алмаза: при отсутствии кислорода алмаз не горит, но меняется его молекулярная структура. При температуре равной 2000оС всего в течение 15-30 минут можно получить графит.
Бриллиант — это ограненный алмаз. Этот материал сегодня считается самым твердым в мире. Он состоит из углерода, как и каменный уголь. Тогда можно ли его поджечь? Чаще всего горение происходит в атмосфере кислорода. Есть вещества, способные гореть и в других газах, но их не так много. На теплоэлектростанциях в качестве топлива используется каменный уголь, большую часть которого составляет углерод.
Можно ли сжечь алмаз: 7 интересных фактов о редких драгоценностях
Все знают, что крупный алмаз стоит больших денег. Почти все — что это самое твердое природное вещество. А мы знаем кое-что еще и с удовольствием поделимся этими знаниями.

1. Алмазы образуются в земной мантии на глубинах порядка пары сотен километров. Там огромное давление и очень высокая температура. Если до той же температуры нагреть алмаз на поверхности, то он сгорит. Ведь это совершенно такой-же углерод, как и в печке, просто атомы расположены по-другому. А в земной мантии свободного кислорода нет, именно поэтому алмазы не сгорают.
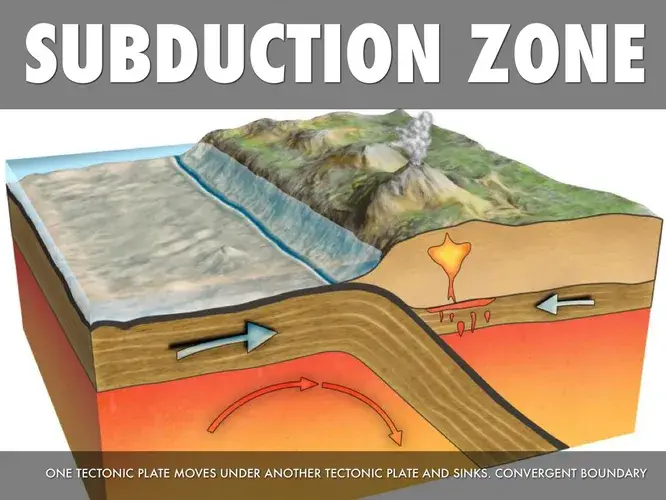
2. Углерод, из которого состоят алмазы, вроде бы не должен находиться на таких глубинах. Это легкий элемент, он распространен в земной коре, а глубже залегает то, что за миллиарды лет после формирования планеты успел «утонуть» в ее недрах. Видимо, дело в субдукции. Океаническая кора, состоящая в основном из базальтов, формируется в середине океанов, в зонах срединно-океанических хребтов. Оттуда она «раздвигается» в противоположные стороны. Упирающийся в материк край коры подгибается под него и постепенно тонет в мантийном веществе. Вместе с осадочными породами, в которых много углерода. Этот процесс идет со скоростью порядка сантиметров в год, но непрерывно.

3. Ценимые ювелирами и их покупателями голубые алмазы — это почти обычный алмаз, окрашенный небольшой примесью бора. Бор еще легче углерода и его наличие на больших глубинах еще менее вероятно. По всей видимости, он попадает туда так же, но в меньших количествах. Формируются голубые алмазы на рекордной глубине — 600-700 километров. Поэтому на поверхности они очень редки — около 0.02% мировой добычи.

4. При кристаллизации алмаза внутри него иногда оказываются окружавшие его в этот момент вещества. Это беда для ювелира и счастье для геолога. Дело в том, что кристаллическая решетка алмаза из-за своей прочности может удержать захваченные минералы при том же давлении, при котором они находились в момент формирования нашего «камешка». А это существенно, поскольку многие вещества по мере изменения давления переходят из одного состояния в другое. Скажем, стабильный при шести и более гигапаскалях стишовит при снижении давления превращается в коэсит, а при достижении поверхности — в хорошо знакомый нам кварц. Его химическая формула при этом, конечно, не меняется — это диоксид кремния, SiO2. Кроме того, по давлению во включениях можно точно определить глубину формирования алмаза.

5. На поверхность алмазы попадают с кимберлитом — древней магмой, когда-то прорвавшейся на поверхность через кимберлитовую трубку — относительно узкое, слегка расширяющееся к верху жерло. Названием трубка и минерал обязаны южноафриканскому городу Кимберли, возле которого в XIX веке была открыта первая такая трубка. Сейчас по всему миру известно примерно 1500 трубок. Увы, алмазы есть далеко не во всех, а примерно в каждой десятой. Как полагают геологи, на долю кимберлита приходится около 90% мировых запасов алмазов.


7. До открытия кимберлитовых трубок алмазы добывались в россыпях, преимущественно речных. Как сейчас ясно, они образовались при эрозии кимберлитовых вулканов, от которых к нашим дням остались только трубки. Россыпей, имеющих промышленное значение, в мире было немного. Бразильские были практически исчерпаны к концу XVIII века, индийские — парой веков раньше. Росcыпи в Южной Африке были найдены в XIX веке и именно их разработка около Кимберли в конечном итоге привела к находке первой трубки.
Алмазы горят. Дорогостоящий опыт по сжиганию алмаза в запаянном котле произвел французский химик Антуан Лавуазье в 1772 году. Так как вес котла при этом не изменился, то это привело также сжиганию флогистонной теории. 1. Самый точный способ определения подлинности алмаза или бриллианта — это роверка на сгораемость. Сгорел без остатка, значит хорррроший был бриллиант. 0. Вообще то алмаз это просто углерод сдавленный при огромном давлении и огромной температуре так что не думаю, что он может гореть от спички — там температура несколько тысяч градусов. Правда я не пробовал поджигать бриллиант, но уверен что он и не загорится. Знаете ответ? добавить: ссылку | фото | видео | аудио | карту.
uCrazy.ru
Алмаз — это не только самый твердый минерал на планете Земля, но также и один из самых ценных камней, ибо, будучи обработан, он превращается в бриллиант, высоко ценимый ювелирами всех времен и народов. Считается, что алмазы образовались более 3,3 миллиарда лет назад в верхних слоях земной мантии под воздействием высокой температуры и давления, хотя существует и гипотеза внеземного их происхождения.

Образуются алмазы в особых породах, богатых углеродом, который, будучи подвержен экстремальным давлениям и высоким температурам, меняет свою кристаллическую решетку, превращаясь в драгоценный камень.
По сути же алмаз является чистым углеродом, а раз так, он должен обладать по меньшей мере химическими свойствами углерода, например, взаимодействовать с кислородом, выделяя энергию в виде тепла и оксид углерода. Говоря более простым языком, алмаз, как и каменный уголь, должен гореть. На самом деле не всё так просто.
Химическая активность углерода во многом зависит от его модификации (они отличаются друг от друга не только строением кристаллической решётки, физическими и химическими свойствами), и алмаз в этом отношении предстает довольно инертным. Да ведь и обычный каменный уголь не так-то просто разжечь. Это известно каждому, кто хотя бы раз пробовал использовать для печки в качестве топлива всем известный антрацит.
Растопить печь можно и бриллиантами, но для этого нужно тронуться кукухой создать особые условия

То, что алмазы могут гореть, доказал еще Антуан Лавуазье в 1772 году, проведя публичный опыт по сжиганию этого драгоценного минерала в запаянном сосуде. Всё, что для этого нужно — это кислородосодержащая среда и как минимум в 2-3 раза более высокая температура, чем та, которая понадобилась бы для возгорания угля. С кислородом из воздуха алмаз начинает взаимодействовать при 850-1000 °C, в чистом кислороде химическая реакция начнется при чуть более «скромных» 700-800 °C. Но горит алмаз не совсем так, как уголь.
В реакцию с кислородом вступают внешние слои камня, перешедшие в газообразное состояние, образуя при этом свечение, а сам алмаз постепенно уменьшается в размерах. Чтобы увидеть образование пламени, сжигать минерал необходимо в чистом кислороде. Как правило, после сжигания алмаз не оставляет шлака, он как-бы истаивает, впрочем, конечный продукт реакции зависит от чистоты исходного материала.
Итак, алмаз, как и другие модификации углерода, может вступать в реакцию с кислородом, выделяя тепло и оксид углерода. Тем не менее, среди многих ювелиров до сих пор бытует миф, что алмаз невозможно сжечь, хотя в то же самое время многие из них заявляли о повреждениях камня при нагревании его в пламени кислородно-ацетиленовой горелки.
И вот еще что. При нагревании этого драгоценного камня до 3000 градусов по Цельсию без доступа воздуха он меняет свою кристаллическую решетку, превращаясь из самого твердого в один из самых мягких минералов — обычный графит, используемый в качестве стержня «простого» карандаша.
Вопрос горит алмаз или не горит мучал ученых очень давно. Ньютон когда-то предположил, что алмаз имеет органическую составляющую. Тогда до 1794 года, никто и не слышал слово углерод, и что алмаз и графит — это одно и то же. Если случилось страшное — пожар в доме или квартире, алмаз также может сгореть. Температура пожара в закрытом помещении может достигать 600 — 900 градусов, а значит, алмазы могут "испариться". Есть ли смысл держать инвестиционные бриллианты в местах, которые могут быть подвергнуты пожару? При таких температурах уже может начать плавиться золото (например, для пробы 585 температура плавления — 830-980 градусов Цельсия).
Can diamonds burn?

Diamonds are forever, or so the slogan goes. But with the proper application of heat and enough oxygen, a diamond can go up in smoke.
Diamonds are carbon, just like coal. It takes a bit more to get them burning and keep them burning than coal, but they will burn, as numerous YouTube demonstrations will attest. The trick is to create the right conditions so that a solid diamond can react with the oxygen required to fuel a fire.
"You have to convert that solid [carbon] into a gas form, so it can react with the air to make a flame," said Rick Sachleben, a retired chemist and member of the American Chemical Society.
The best way to do that? Heat — and lots of it. In room temperature air, diamonds ignite at around 1,652 degrees Fahrenheit (900 degrees Celsius), according to West Texas A&M University physicist Christopher Baird. For comparison, a high-volatile coal (coal containing a relatively high amount of easily released gases) ignites at about 1,233 F (667 C), whereas wood ignites at 572 F (300 C) or less, depending on the type.
When first heated, a diamond will glow red, then white. The heat enables a reaction between the surface of the diamond and the air, converting the carbon to the colorless and odorless gas carbon monoxide (a carbon atom plus an oxygen atom).
"The carbon plus the oxygen to make carbon monoxide generates heat; the carbon monoxide reacting with the oxygen generates more heat; the rising heat causes the carbon monoxide to move away, so more oxygen is brought in," he told Live Science.
That fire, however, will amount to only a glow. Nurturing a flame on the surface of a diamond usually requires an extra boost: 100% oxygen rather than room air, which is only 22% oxygen. This increase in concentration gives the reaction all that it needs to self-perpetuate. The carbon monoxide rising from the diamond ignites in the presence of oxygen, creating a fire that seems to dance on the stone’s surface.
"Almost everything burns incredibly in pure oxygen," Sachleben said.
Even without pure oxygen, diamonds can be damaged by flame, according to the Gemological Institute of America (GIA). Typically, a diamond caught in a house fire or by an overzealous jeweler’s torch will not go up in smoke, but instead will combust on the surface enough to look cloudy and white. Cutting away the burnt portions will reveal a smaller, but once again crystal-clear, stone, according to the GIA.
When carbon burns in oxygen, that reaction produces carbon dioxide and water. A pure carbon diamond could thus theoretically vanish entirely if burned for long enough; however, most diamonds do have at least some impurities like nitrogen, so the reaction is unlikely to be quite that simple.
Originally published on Live Science.
Stephanie Pappas is a contributing writer for Live Science, covering topics ranging from geoscience to archaeology to the human brain and behavior. She was previously a senior writer for Live Science but is now a freelancer based in Denver, Colorado, and regularly contributes to Scientific American and The Monitor, the monthly magazine of the American Psychological Association. Stephanie received a bachelor’s degree in psychology from the University of South Carolina and a graduate certificate in science communication from the University of California, Santa Cruz.
". When carbon burns in oxygen, that reaction produces carbon dioxide and water.."
.
‘Water’? That would be interesting. With just carbon and oxygen present, where did the hydrogen necessary for water come about?
I once saw a Youtube video where a guy burned diamonds, captured the CO2, and then used it to make carbonated water in a Sodastream! It’s a very fun video.
Technically, with a diamond, wouldn’t the very terminal carbons of the carbon-matrix which are in contact with atmosphere contain a hydrogen atom, as the carbon-carbon tetrahedral structure must end at that point? Either that, or perhaps a hydroxyl group. Hydrogen sounds most likely. Certainly would only produce an ultra-trace of water, but an ultra-trace is not nothing!
More importantly, as I think of "ideal" diamonds being a crystal of pure carbon, each atom in sp3 orbital links to four others, if it is pure and without cracks, aren’t you looking at a single molecule of carbon, since all of it is covalently bonded? This is the ideal of course. Inclusions muck up the notion, but not if they are trapped and there are no surface-to-surface cracks in the diamond, it seems like each could be a single "molecule" of carbon.
Diamond is s stable to 1000 °C in air, 1500 °C in inert or reducing atmosphere. No glow to ~1000 °C re Debye temperature. If you drop a really hot diamond into liquid oxygen, it skittles around burning.
However, in contact with carbiding metals, diamond catalyticaily decomposes to graphite at room temperature, If you put some diamond dust on your finger and draw ia across molybdenum, you can see the immediate darker grey streak from molybdenum carbide.
A poorly cut diamond will cleave into thin triangles with hardly more than a brisk tap.
Yes, diamond can be burned. The most common form of burning in everyday life is carbon combustion. In carbon combustion, carbon atoms break their bonds with each other and with other atoms (which requires energy) to form bonds with oxygen atoms (which releases even more energy than first required). The net extra energy released in this reaction can then go on to rip more carbon atoms free of their non-oxygen neighbors, thus continuing the reaction, or the energy can escape as heat and light. Carbon bonded with oxygen makes carbon dioxide and carbon monoxide, which are the waste products of combustion. They drift away from the fire as gases. Since biological organisms, and the fuels derived from biological organisms, contain a lot of carbon, much of the burning that goes on around us is carbon combustion. This includes camp fires, candles, car engines, and gas stoves. Pure diamond consists only of carbon atoms bonded into a dense, strong crystal lattice, so diamond can also undergo carbon combustion. In fact, Antoine Lavoisier first determined that diamond is made out of carbon by burning it and showing that the combustion product was carbon dioxide. The book Diamond Films and Coatings by Robert Foster Davis states, "In 1772 the French chemist Antoine L. Lavoisier found that the products of diamond combustion behaved as, and most assuredly were, solely carbon dioxide. He determined that the ignition and burning of each produced equal amounts of ‘bound air’."
Thanks for the science lesson — appreciate that youve given me some great help with my science homework.
Heat a diamond to about 800 °C and immediately drop it into liquid oxygen. Shhhhhoooosh.
Diamond does not glow even at 1000°C — Debye temperature.
I can add that to my notes for my homework -appreciate that
tYyd29-gtpA View: https://www.youtube.com/watch?v=tYyd29-gtpA
https://phys.org/news/2020-10-team-path-nanodiamond-graphene.html… diamane
Pull your thumb out and add something of your own effort. Put some flesh in the game — lonsdaleite.
Live Science newsletter
Stay up to date on the latest science news by signing up for our Essentials newsletter.
Thank you for signing up to Live Science. You will receive a verification email shortly.
There was a problem. Please refresh the page and try again.
By submitting your information you agree to the Terms & Conditions (opens in new tab) and Privacy Policy (opens in new tab) and are aged 16 or over.
Горят ли алмазы. Алмаз считается самым твердым минералом на планете. Он способен разрезать стекло. Многие ученые ставили эксперименты, подвергая алмаз механическим и химическим воздействиям. И в итоге было найдено его слабое место: алмаз способен гореть. Статьи по теме: Горят ли алмазы. Имеет ли алмаз блеск. Имеет ли алмаз запах. Вопрос «И всё-таки! Что появилось первым? Из всех твердых тел алмаз обладает самой высокой теплопроводностью. Он устойчив к трению, даже об металл.
- https://www.kakprosto.ru/kak-848042-goryat-li-almazy
- https://www.9111.ru/questions/7777777771714042/
- https://ucrazy.ru/interesting/1608122828-chto-budet-esli-almaz-brosit-v-ogon.html
- https://www.livescience.com/can-diamonds-burn.html