С аммиачным раствором оксида серебра реагирует только муравьиная кислота:
Найдем количество осадка (металлического серебра), составим соотношение между ним и муравьиной кислотой, найдем количество (моль) и массу муравьиной кислоты в смеси:
ν(Аg)=m/M=21,6 г/108 г/моль=0,2 моль
ν(Аg): ν(НСООН)=2:1 (по уравнению)
m(НСООН)=Мν =46 г/моль×0,1 моль=4,6 г
Найдем массу неизвестной кислоты:
Составляем уравнение реакции нейтрализации этих кислот:
НСООН +КОН→ НСООК + Н2О (1)
Определяем количество гидроксида калия, которое затрачивается на нейтрализацию муравьиной кислоты (ур-е 1):
ν(КОН): ν(НСООН)=1:1 (по уравнению)
ν(КОН)=0,1 моль, а всего гидроксида калия дано 0,2 моль (11,2 г/56 г/моль); следовательно, оставшийся гидроксид калия пошел на вторую реакцию:
Составляем соотношение между количеством гидроксида калия и неизвестной кислотой (ур-е 2), находим количество этой кислоты и ее молярную массу:
Составляем уравнение и находим (n):
Матки ИО Бакфаст Искусственного Осеменения для разведенческой специализации Купить ИО
Задача 4.
Смесь двух предельных монокарбоновых кислот массой 26,8 г полностью реагирует с 0,4 моль гидроксида натрия, а половина такой же массы смеси с оксидом серебра дает 21,6 г осадка. Определите формулы кислот и их массы в смеси.
Расчетные и графические задания Равновесный объем — это объем, определяемый равенством спроса и предложения.
Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности.

Обзор компонентов Multisim Компоненты – это основа любой схемы, это все элементы, из которых она состоит. Multisim оперирует с двумя категориями.

Композиция из абстрактных геометрических фигур Данная композиция состоит из линий, штриховки, абстрактных геометрических форм.
Принципы, критерии и методы оценки и аттестации персонала Аттестация персонала является одной их важнейших функций управления персоналом.
Пункты решения командира взвода на организацию боя. уяснение полученной задачи; оценка обстановки; принятие решения; проведение рекогносцировки; отдача боевого приказа; организация взаимодействия.
Что такое пропорции? Это соотношение частей целого между собой. Что может являться частями в образе или в луке.
Способы тактических действий при проведении специальных операций Специальные операции проводятся с применением следующих основных тактических способов действий: охрана.
Искусство подбора персонала. Как оценить человека за час Искусство подбора персонала. Как оценить человека за час.
Этапы творческого процесса в изобразительной деятельности По мнению многих авторов, возникновение творческого начала в детской художественной практике носит такой же поэтапный характер, как и процесс творчества у мастеров искусства.
❤ Муравьиная кислота против клеща варроа ❤
Источник: studopedia.info
HCOOH + Ag2O + NH3 = (NH4)2CO3 + Ag — Калькулятор химических реакций
Для уравнивания химической реакции, введите уравнение реакции и нажмите кнопку Уравнять. Решенное уравнение появится сверху.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Ионные заряды пока не поддерживаются и не будут приняты в расчет.
- Переместите неизменные группы в соединениях, чтобы не допустить неопределенность. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O не уравняется, но XC2H5 + O2 = XOH + CO2 + H2O уравняется.
- Промежуточные расстояния [такие, как (s) (aq) или (g)] не требуются.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- Al + PB(NO3)2 = PB + Al(NO3)3
- Al + H3Po4 = AlPo4 + H2
- CH3NH2ICH3 + KOH = CH3NHCH3 + H2O + KI
- Na2CO3 + NaOH = NaOH + Na2CO3
- CUSO4 + Fe = FeSO4 + CU
- FeI2 + Cl2 + H2O = FeCl3 + HIO3 + HCl
- C7H15COOC2H5 + NaOH = C7H15COONa + C2H5OH
- NH3 + Cu = Cu(NH3)4
- NH3 + CuO = Cu + N2 + H2O
- Na2CO3 + H3Po4 = Na3Po4 + H2O + CO2
- Mg + CUCl2 = MgCl2 + CU
- H3PO4 + HNO3 = HNO3 + H3PO4
Калькуляторы
Химическое уравнение
- Программа решения химических уравнений
- Калькулятор стехиометрических реакций
- Калькулятор Лимитирующего реагента
- Ionic Equation Calculator
- окислительно-восстановительные реакции
Источник: www.chemicalaid.com
Специфические свойства неорганических и органических кислот

Видеоурок содержит информацию о специфических свойствах неорганических кислот (серной и азотной), а также о специфических свойствах органических кислот, например муравьиной.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Специфические свойства неорганических и органических кислот»
Специфические свойства карбоновых кислот связаны с разрывом углерод-кислородной связи, при этом происходит замещение о-аш– группы. Например, взаимодействие со спиртами (реакция этэрификации).
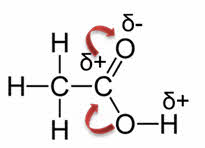
Так, в реакции уксусной кислоты с метанолом образуется сложный эфир – метилэтаноат, или метиловый эфир уксусной кислоты и вода.
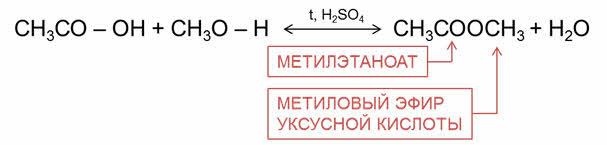
Причём, в образовании молекулы воды принимает участие группа о-аш от кислоты и атом водорода от спирта.
Карбоновые кислоты реагируют с аммиаком с образованием амидов.
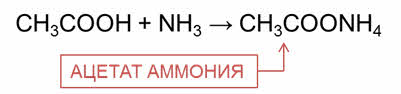
Эта реакция идёт через стадию образования аммониевой соли, которую затем нагревают. Например, в реакции уксусной кислоты с аммиаком образуется соль – ацэтат аммония, затем при нагревании образуется ацэтамид, или амид уксусной кислоты.
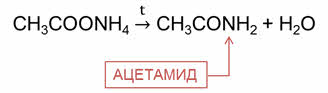

Так, реакции уксусной кислоты хлоридом фосфора пять образуется ацэтилхлорид, а в реакции муравьиной кислоты с тионилхлоридом образуется формилхлорид.
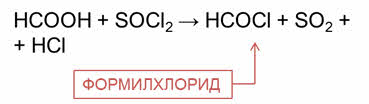
Межмолекулярная дэгидратация карбоновых кислот идёт с образованием ангидридов.
Ангидриды получают при пропускании паров кислот над водоотнимающим средством, например, оксидом фосфора пять. Например, при межмолекулярной дэгидратации уксусной кислоты образуется уксусный ангидрид.
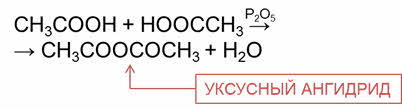
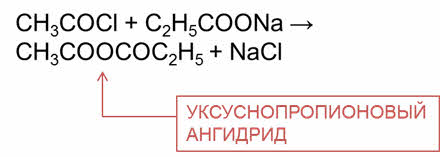
Смешанные ангидриды можно получить при взаимодействии хлор-ангидрида одной кислоты и соли другой кислоты. Так, в результате взаимодействия ацэтил-хлорида с пропионатом натрия образуется уксусно-пропионовый ангидрид и хлорид натрия.
Для карбоновых кислот характерны реакции с разрывом углерод-водородных связей у альфа-углеродного атома.
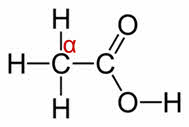
Эти реакции идут с участием радикала. Атомы водорода у альфа-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием альфа-галогенкарбоновых кислот. Например, в реакции уксусной кислоты с хлором образуется хлор-уксусная кислота.
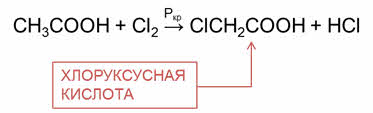
Муравьиная, или метановая кислота имеет свои особенности.
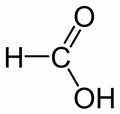
Во-первых, по своему строению и свойствам она отличается от других представителей гомологического ряда. Её карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. Поэтому она является самой сильной кислотой в гомологическом ряду одноосновных насыщенных карбоновых кислот.
В молекуле муравьиной кислоты можно также выделить альдэгидную группу. Поэтому, муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдэгидов.
Например, муравьиная кислота вступает в реакции окисления. Следовательно, для неё характерны качественные реакции на альдэгиды: окисление аммиачным раствором оксида серебра – реакция «серебряного зеркала» и окисление гидроксидом меди два.
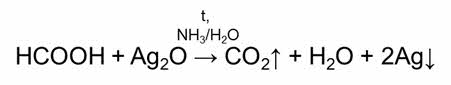
В реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется углекислый газ, вода и серебро; в реакции муравьиной кислоты с гидроксидом меди два при нагревании, образуется углекислый газ, вода и осадок оксида меди один кирпично-красного цвета.
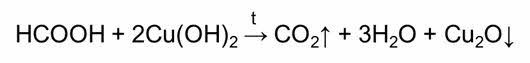
Специфическим свойством муравьиной кислоты является также её способность разлагаться на оксид углерода два и воду под действием концентрированной серной кислоты.

Ненасыщенные однооосновные карбоновые кислоты имеют свои особенности: они вступают в реакции присоединения.
Например, в реакции акриловой кислоты с водородом образуется насыщенная одноосновная карбоновая кислота – пропановая кислота.
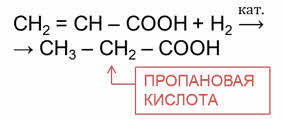
Ненасыщенные карбоновые кислоты также вступают в реакции присоединения с галогенами.
Так, в реакции акриловой кислоты с бромной водой, происходит её обесцвечиваение и образуется два-три-дибром-пропановая кислота.
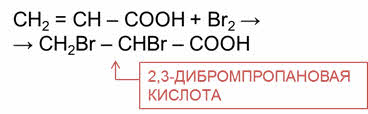
Неорганические кислоты также имеют свои специфические свойства.
Например, угольная кислота является слабой и распадается на углекислый газ и воду.
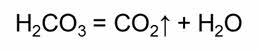
При нагревании кремниевой кислоты образуется оксид кремния четыре и вода.
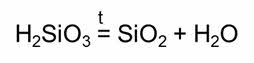
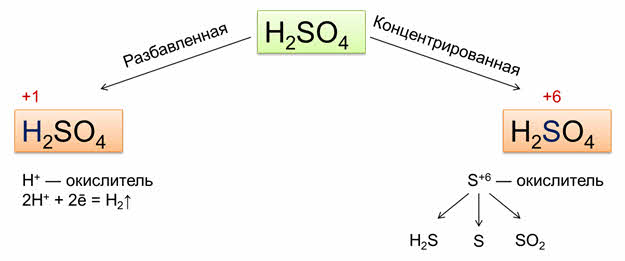
Специфическими свойствами обладают и другие неорганические кислоты. Так, в разбавленной серной кислоте окислителем являются ионы водорода, а в концентрированной – сульфат-ионы.
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород. Например, в реакции цинка с разбавленной серной кислотой образуется соль – сульфат цинка и газ – водород.
Металлы, которые стоят в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой. Например, медь не вступает в реакцию с разбавленной серной кислотой.
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода, образуются сульфаты металлов, а также продукт восстановления серной кислоты – оксид серы четыре.
Так, в реакции меди с концентрированной серной кислотой образуется соль – сульфат меди два, оксид серы четыре и вода.
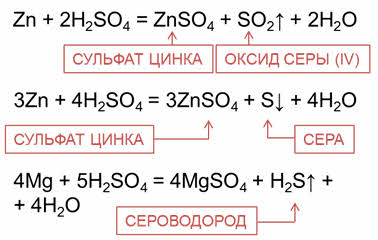
С более активными металлами концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода.
Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты могут образовываться различные продукты восстановления серной кислоты – оксид серы четыре, сера, сероводород.
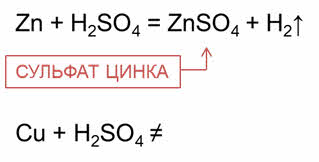
Так, в реакции цинка с концентрированной серной кислотой образуется соль – сульфат цинка, вода и оксид серы четыре или сера. В реакции магния с концентрированной серной кислотой образуется соль – сульфат магния, сероводород и вода.
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому его перевозят в железных цистернах.
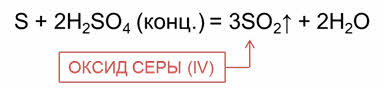
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и другие), восстанавливаясь до оксида серы четыре. Например, в реакции серы с концентрированной серной кислотой образуется оксид серы четыре и вода; в реакции углерода с концентрированной серной кислотой образуется оксид серы четыре, оксид углерода четыре и вода.
Азотная кислота является одним из сильнейших окислителей. Её окислительные свойства обусловлены присутствием в молекуле атома азота в высшей степени окисления в составе кислотного остатка.
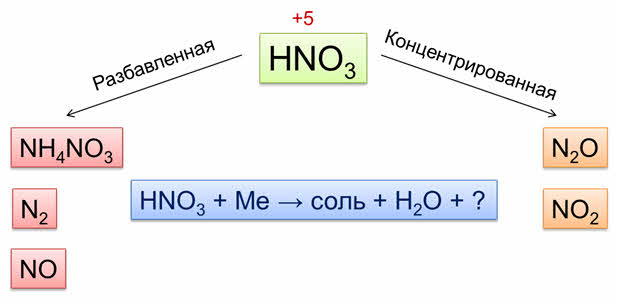
Окислительные свойства кислотного остатка значительно сильнее, чем ионов водорода, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины.
Нитрат-ионы при взаимодействии с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл.
Концентрированная азотная кислота при взаимодействии с наиболее активными металлами (до алюминия в ряду напряжений) восстанавливается до оксида азота один.
Так, в реакции концентрированной азотной кислоты с кальцием образуется соль – нитрат кальция, оксид азота один и вода.

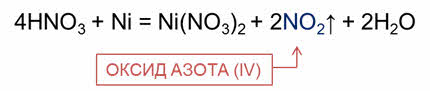
Концентрированная азотная кислота при взаимодействии с менее активных металлов восстанавливается до оксида азота четыре.
Например, в реакции концентрированной азотной кислоты с никелем образуется соль –нитрат никеля, оксид азота четыре и вода.
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. В реакции концентрированной азотной кислоты с фосфором образуется метафосфорная кислота, оксид азота четыре и вода.
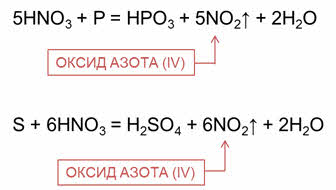
В реакции концентрированной азотной кислоты с серой образуется серная кислота, оксид азота четыре и вода.
Смесь концентрированной азотной и соляной кислот в объёмном отношении один к трём называется «царской водкой», потому что растворяет «царя металлов» ─ золото – и другие благородные металлы.
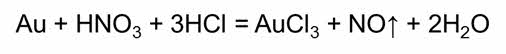

Такая пассивация заключается в образовании защитной плёнки, которая предохраняет металл от дальнейшего взаимодействия с кислотой.
Разбавленная азотная кислота реагирует с наиболее активными металлами до алюминия с образованием аммиака или нитрата аммония. Например, в реакции разбавленной азотной кислоты с магнием образуется соль – нитрат магния, нитрат аммония и вода.
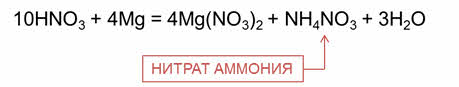
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота два. Так, в реакции разбавленной азотной кислоты с медью образуется соль – нитрат меди два, оксид азота два и вода.
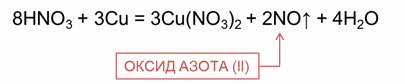
Таким образом, органические и неорганические кислоты имеют специфические свойства. Такими особыми свойствами обладает муравьиная кислота, непредельные одноосновные карбоновые кислоты. Из неорганических кислот специфические свойства характерны для кислот-окислителей: серной и азотной кислот.
Источник: videouroki.net