Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).,
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.
Законы Фарадея. Практическое применение электролиза
В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:
Первый закон Фарадея гласит, что эта масса, выделяющегося на электродах, пропорциональна заряду, прошедшему через электролит:
На каком железе обучать модели в вашем стартапе
Здесь роль коэффициента пропорциональности играет величина – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
Если вспомнить формулы из темы о постоянном токе:
То можно представить первый закон Фарадея в виде:
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:
Здесь: – молярная масса электролита; – элементарный заряд; – валентность электролита; – число Авогадро.
Величина называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия – покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 5)
Гальваническое покрытие


Рис. 5. Примеры гальванопластики и гальваностегии соответственно (Источник), (Источник)
Также электролиз применяется в металлургии для выплавки редких металлов в чистом виде (алюминий, натрий, кальций, магний).
На следующем уроке мы разберем методику решения задач на тему «Электрический ток в жидкостях».
4.3 Применение электролиза
Применение электролиза в технике (сообщение учащегося). (
- Гальваностегия — декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение).
- Гальванопластика — электролитическое изготовление металлических копий, рельефных предметов. Этим способом были сделаны фигуры для Исаакиевского собора в Санкт-Петербурге.
- Электрометаллургия-получение чистых металлов при электролизе расплавленных руд (Al, Na, Mg, Be).
- Рафинирование металлов — очистка металлов от примесей
5. Проверка понимание и осмысления нового материала, и применение нового материала на практике
1. Какие вещества называются электролитами?
2. Дайте определение:электрической диссоциации;степени диссоциации;рекомбинацией.
3. Какой процесс называется электролизом? Кто и когда открыл?
4. Сформулируйте закон Фарадея?
5. Физический смысл электрохимического эквивалента вещества и постоянной Фараде
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками? (Влага на руках всегда содержит раствор различных солей и является электролитом поэтому создает хороший контакт между проводами и кожей)
2) Почему для гальванического покрытия изделия чаще используют никель и хром? (большая химическая стойкость, механическая прочность и после полировки дают красивый блеск)
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи?
(так как влага на проводах представляет электролит и является проводником, а это может привести к короткому замыканию и пожару)
Примеры и разбор решения заданий:
1. Источник тока присоединили к двум пластинам, опущенным в раствор поваренной соли. Сила тока в цепи равна 0,3 А. Какой заряд проходит между пластинами в ванне за 7 минут?
Решение: Сила тока равна отношению заряда ко времени, в течение которого этот электрический заряд прошёл по цепи:

Подставив числовые значения, переведя время в СИ, получим q = 126 Кл.
Ответ: q = 126 Кл.
2. В процессе электролиза из водного раствора хлорида железа-2 выделилось 840 мг железа. Какой заряд прошёл через электролитическую ванну?


q = 840 · 10 -6 · 1,6 · 10 -19 · 2 · 6,02 · 10 23 / 0,056 = 2880 Кл.
Ответ: q = 2880 Кл.
Задачи
.1Сколько цинка получено при электролизе раствора ZnSO4, если была затрачена энергия 2 кВт*ч? Разность
потенциалов между зажимами ванны 2 В. Постоянная Фарадея 9,65*104 Кл/моль.
А. 0,22 кг Б. 1,22 кг В. 2,22 кг Г. 3,22 кг
ТЕСТЫ
5.Определите толщину слоя меди, выделившейся за 5 ч при электролизе медного купороса, если плотность тока
равна 0,8 А/дм2.
А. 1,3 *105 м Б. 2,3*105 м В. 4,3*105 м Г. 5,3*105 м
6.Амперметр, включённый последовательно с электролитической ванной, показывает ток I0 = 1,5 А. Какую
поправку надо внести в показания амперметра, если за время t = 10 мин на катоде отложилась масса меди m =
0,316 г? Эл/литический эквивалент меди k = 3,3*107 кг/Кл.
А. 0,1 А Б. 0,2 А В. 0,3 А Г. 0,4 А
7.Какими заряженными частицами создаётся эл ток в электролитах?
А. положительными и отрицательными ионами
Б. электронами В. Дырками Г. электронами и дырками
6.При электролизе раствора ZnSO4 была затрачена энергия 20 ГВт*ч. Определите массу выделившегося цинка,
если напряжение на зажимах ванны 4 В.
А. 312 г Б. 412 г В. 512 г Г. 612 г
7.Определите массу серебра, выделившегося на катоде при электролизе азотнокислого серебра за 2 ч, если к ванне
приложено напряжение 1,2 В, а сопротивление ванны равно 5 Ом.
А. 1,9 г Б. 2,9 г В. 3,9 г Г. 4,9
6 Рефлексия. «Что узнали? Что поняли? Что не поняли?»
8. Домашнее задание §113 решить № А1,А2 с.379
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Это важно знать:
Источник: studopedia.ru
Как наносится гальваническое покрытие на производстве и в домашних условиях
В деятельности каждого грамотного электрика встречаются моменты, требующие точного анализа явлений, происходящих при электролизе. Во многих случаях возникает необходимость точной настройки источников постоянного тока на рабочий режим с различными временны?ми характеристиками для полной автоматизации процесса.
Впервые основные законы, описывающие действие постоянного тока на поведение растворенных в электролитах веществ, установил английский ученый Майкл Фарадей.

Физико-химические процессы электролиза происходят в электролитической ячейке.
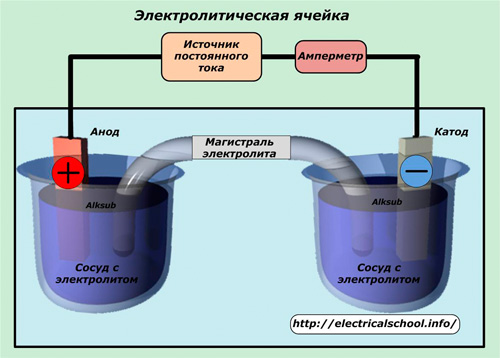
Она изготавливается в сосуде с электролитом. Внутри корпуса размещены два электрода, на которые подаются положительный и отрицательный заряды от управляемого источника постоянного напряжения. Сила тока, протекающего по общей цепи, регулируется по величине и контролируется оператором по измерительным приборам. Автоматизированные электрические ячейки работают под присмотром электроники.
Электрод, на который подается положительный заряд, называют «Анод», а отрицательный — «Катод». Под действием тока в электролите образуются ионы с зарядами противоположных знаков:
Положительно заряженные ионы называют «Катионами» потому, что, они движутся к катоду. Анионы — это ионы отрицательного заряда, притягиваемые к аноду.
Технологии, происходящие при электролизе, находятся на стыке двух наук:
Поэтому исторически сложилась практика, что гальванотехникой занимается специальный раздел электрохимии, изучающий как электрохимические, так и физические явления, которые происходят во время осаждения катионов металла на любом виде анода. Это делается для подбора оптимальных условий технологии, разработки специальных приемов и методов обработки, подбора номинальных режимов оборудования во время осаждения определенных металлов на различных подложках.
На практике гальванотехника давно разделилась на два отдельных, независимых направления:
Эти методы работают примерно по одинаковым технологиям, но отличаются материалами основы, на которую наносится гальваническое покрытие.
Это способ создания поверхностной копии объемного изображения неметаллической детали. Материалами основы могут служить легкообрабатываемые гипс, камень, дерево, пластмассовые заготовки и другие вещества.
В художественных мастерских создают уникальные формы украшений при покрытии слоем металла листочков различных деревьев, цветков, насекомых.
Основоположником гальванопластики считается россиянин Борис Семенович Якоби, разработавший технологию, позволившую создать знаменитые металлические скульптуры, которые украшают до сих пор здание Исаакиевского собора в Санкт Петербурге. За эту работу он получил всемирное признание, был поощрен самой почетной для ученых России Демидовской премией и награжден большой золотой медалью во время прохождения торжественной церемонии на Парижской выставке.

Толщина изделий, создаваемых методами гальванопластики, отличается увеличенными размерами для придания им прочности при эксплуатации. Она может достигать от 0,25 до двух и более миллиметров. Это реализуется длительностью протекания электрохимических процессов.
Гальванопластикой в художественных изделиях чаще всего наносят цветные благородные металлы:
Для технических целей используют:
При золочении, серебрении, никелировании медь применяют как промежуточный слой в технологических процессах гальванопластики.
Этот прием гальванического покрытия основан на нанесении тонкого слоя защитного металла на поверхность металлической детали или группы предметов. Верхнее покрытие может выполнять различные функции:
- предохранения от коррозии;
- защитного декорирования;
- облагораживания внешнего вида;
- придания поверхности различных электрических свойств с целью улучшения токопроводимости либо повышения изоляционных характеристик;
- поднятия противозадирочных характеристик прочности;
- продления износостойкости;
- улучшения адгезии при гуммировании сталей;
- повышения сцепляемости для припоев и ряд других свойств.
Широкий ассортимент изделий, покрытых методами гальваностегии, можно встретить во всех окружающих нас предметах.

На приведенной картинке показаны обработанные детали, которые окружают нас в быту: декорированные элементы мебели и светильников, защитные покрытия бытовой техники и консервных банок.
Качество наносимого слоя на изделие зависит от структуры создаваемого покрытия. В технических целях используются наиболее мелкозернистые и одновременно плотные слои осадков. Они создаются:
- подбором компонентов и состава электролита;
- поддержанием оптимального температурного режима рабочей среды при электролизе;
- уставками тока, стабильностью его плотности и длительностью производственного цикла.
Виды гальванических покрытий
Слой золота придает изделиям богатый вид, защищает от коррозии, увеличивает отражательные способности изделия. Токопроводящие свойства позолоченных поверхностей успешно работают в электронных приборах.
Серебреное покрытие используется в этих же целях и, одновременно, часто применяется для улучшения токопроводящих свойств силовых цепей. Его наносят на контакты пускателей, контакторов, электромагнитных и статических реле, ножки операционных усилителей, микросхем и других электронных компонентов.
Никелирование позволяет изделиям из стали, меди и ее сплавов, алюминия, цинка и реже вольфрама, титана и молибдена придавать декоративный вид и обеспечивать защиту от коррозии не только атмосферного воздействия, но и при работе в условиях:
- загрязнения растворами солей, щелочи, слабых кислот;
- повышенного воздействия механических истирающих нагрузок.
Хромирование повышает твердость и износостойкость металлов и позволяет восстанавливать отработавшие поверхности трущихся деталей до первоначальных параметров. Изменение характеристик технологического режима позволяет создавать:
- матовые покрытия с серым оттенком, обладающие наибольшей твердостью, хрупкостью, но наименьшей износоустойчивостью;
- блестящие поверхности с хорошими показателями износостойкости и твердости;
- пластичные молочные покрытия с низкой твердостью, но привлекательным видом и хорошими антикоррозионными свойствами. Цинкование позволяет защищать стальные листы и изделия из них от коррозии, часто используется в автомобилестроении и строительстве.
Омеднение стальных изделий защищает от коррозии и повышает токопроводящие свойства металла, применяется для покрытия электрических проводников, работающих на открытом воздухе.
Латунирование не только защищает стальные и алюминиевые сплавы от коррозии, но и обеспечивает их хорошую сцепляемость с резиной.
Бронзирование придает поверхностям уникальный вид.
- защиту серебра от потускнения;
- декорирование поверхностей;
- высокую химическую стойкость;
- повышенное сопротивление износу.
Особенности технологических процессов нанесения гальванического покрытия
Промышленные способы гальванотехники широко используются в производственных процессах.

Разнообразие оборудования и методик нанесения внешнего слоя определяют большое количество технологий наращивания поверхностного металла.
Обычно технологические процессы включают в себя этапы:
1. предварительной подготовки заготовок;
2. наращивания гальванического слоя в ваннах;
3. заключительную обработку детали.
На предварительном этапе производится механическая обработка и декапирование поверхностей:
- очистка от окислов и грязи;
- предварительное обезжиривание;
- закрепление на подвесном оборудовании;
- изолирование площадок, не требующих обработки;
- окончательное обезжиривание.
Во время проведения анодной обработки заготовок важно соблюдать оптимальные токовые параметры и их продолжительность.
Заключительный этап включает:
- проведение нейтрализации остатков электролита на обработанных деталях;
- поочередную обработку струями воды с разной температурой;
- снятие деталей с элементов подвески;
- ликвидация изолированного слоя с закрытых площадок;
- просушивание;
- выполнение при необходимости термической обработки;
- механическую доводку до требуемого размера.
Особенности конструкций современного оборудования для нанесения гальванических покрытий
Для размещения электролита используются гальванические ванны из стойких полимеров:
Их монтируют на прочном металлическом основании вместе с блоками управления в модульных конструкциях.
Высококачественная отмывка деталей обеспечивается методами создания:
- струйного течения;
- проточного способа;
- каскадного приема.
Окончательную оценку процесса отмывки осуществляет оператор методами визуального наблюдения.
Смонтированное электрическое оборудование и нагревательные приборы управляются автоматически или оператором. Для ускорения операций выполняется барботаж, покачивания и другие приемы.
Промышленные установки оборудуются защитными устройствами, вытяжными колпаками, бортовыми отсосами, системами очистки сточных вод и позволяют выполнять только определенные процессы, например:
- нанесение слоев никель-золото на промышленные изделия;
- покрытие никелем, серебром, медью, хромом на подвесках;
- никелирование в барабанах;
- обработка медью и оловом в маленьких барабанах;
- металлизация на подвесках;
- очистка сточных вод и другие технологии.
Промышленные установки, используемые на крупных предприятиях, объединяются в производственные линии.

Способы нанесения гальванических покрытий в домашних условиях
Применение способов галваностегии и гальванопластики в бытовых целях под силу любому домашнему мастеру. Однако, перед изготовлением таких устройств следует изучить и учесть правила безопасности, которые необходимо соблюдать при работе с агрессивными жидкостями и электроустановками, обеспечить хорошее проветривание помещений и удаление сточных вод.
Использование ванн из стекла нежелательно по причине их хрупкости. Лучше подбирать сосуды из прочных прозрачных полимеров.
Для протекания электрического тока постоянной величины в небольших резервуарах с электролитом можно использовать конструкции готовых блоков от компьютера или мобильного телефона либо изготовить их самостоятельно под конкретные нужды.
Довольно простые устройства блоков питания от старых радиоприемников с транзисторным регулированием можно найти в интернете или взять за основу следующую схему.
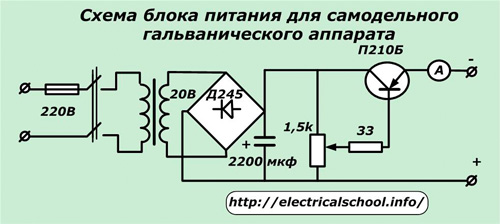
В ней можно применить трансформатор от любого старого телевизора либо намотать его самостоятельно. Номиналы силового транзистора, выпрямительного диодного моста и регулировочного резистора подбираются по мощности нагрузки. Электролитический конденсатор выравнивает сглаженное напряжение. Амперметр встраивается для постоянного контроля величины тока.
Компоновка деталей подобного блока, но с дополнительным узлом транзисторов управления показана на картинке.

Для лучшего охлаждения силового транзистора использован воздушный радиатор.
Очень просто можно сделать другой блок питания: выводы отдельных контактов «+» и «-»с зарядного устройства мобильника подключить через измерительный прибор и регулировочный нагрузочный резистор соответствующей мощности к электродам гальванической ванны.

Домашнему мастеру при выполнении работ методами гальваностегии или гальванопластики придется самостоятельно проводить эксперименты и записывать их результаты для приобретения опыта. Только так появится мастерство и практические навыки.
Телеграмм канал для тех, кто каждый день хочет узнавать новое и интересное: Школа для электрика
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Не пропустите обновления, подпишитесь на наши соцсети:
Источник: electricalschool.info
Что такое электролиз и где он применяется?
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.

Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.

Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:

k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl).
На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.

При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.

Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита . Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока . В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита . Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита . Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.

Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами.
Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Источник: odinelectric.ru