1)Пробу муравьиной кислоты COOH массой 2,32 г разбавили водой в мерной колбе емкостью 100,00 мл на титрование 10,00 мл разбавленного раствора затрачено 7,20мл KOH с молярной концентрацией 0,150 моль/л. Рассчитайте массовую долю муравьиной кислоты в исходном растворе
2)Найдите массу серебра, находящегося в виде ионов в 1л насыщенного раствора AgBr (ПРAgBr=6*10-13)
3) Рассчитать количество йодата калия в растворе, если после замещения его на I2, действием избытка KI и кислоты на титрование затрачено 21,45 мл 0,1010 М раствора Na2S2O3.
Источник: www.liveexpert.org
2. Сильные электролиты

Теперь, пользуясь соотношением а = f∙CM, находим активность каждого иона:
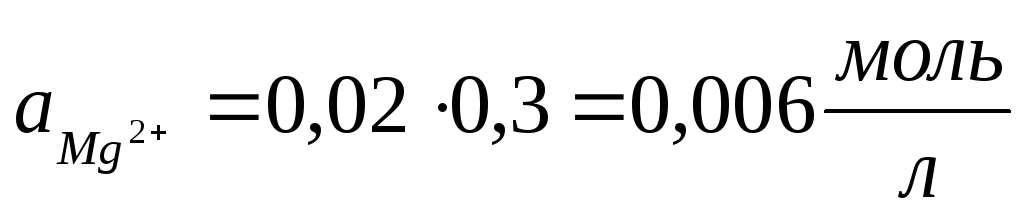
Растворимость веществ. Решение типовых задач. Часть 1.


Задачи для самостоятельной работы:
2.2. Вычислить приближенное значение активности ионов K + и SO4 2– в 0,01 М растворе K2SO4.
2.3. Вычислить приближенное значение активности ионов Ba 2+ и Cl – в 0,002 н. растворе BaCl2.
2.4. Найти приближенное значение коэффициентов активности иона водорода в 0,0005 М растворе H2SO4, содержащем, кроме того, 0,0005 моль/л HCl. Считать, что серная кислота полностью диссоциирует по обеим ступеням.
2.5. Вычислить ионную силу и активность ионов в растворе, содержащем 0,01 моль/л Ca(NO3)2 и 0,01 моль/л CaCl2.
2.6. Вычислить ионную силу и активность ионов в 0,1 %-ном (по массе) растворе BaCl2. Плотность раствора принять равной единице.
2.7. Рассчитать активность иона водорода в 0,005 н. растворе HCl, содержащем, кроме того, 0,15 моль/л NaCl.
2.8. Найти приближенные значения коэффициентов активности ионов Cl – , SO4 2– , PO4 3– и [Fe(CN)6] 4– в растворе с ионной силой 0,0001.
3. Произведение растворимости
Примеры решения задач
Задача 3.1. Растворимость гидроксида магния Mg(OH)2 при 18 о С равна
1,7∙10 –4 моль/л. Найти ПР Mg(OH)2 при этой температуре.
Решение: При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg +2 и вдвое больше ионов ОН – .

Mg(OH)2Mg 2 + + 2 OH –
Следовательно, в насыщенном растворе Mg(OH)2
[Mg 2+ ] = 1,7∙10 -4 моль/л; [OH – ] = 3,4∙10 – 4 моль/л.
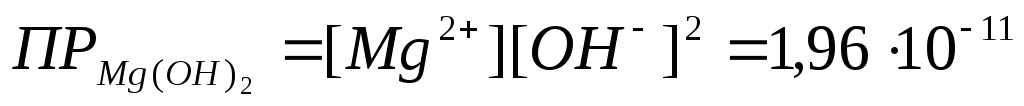
Отсюда .

Задача 3.2. . Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре.
Введение в растворимость и константа растворимости (видео 2)| Произведение Растворимости | Химия
Решение: Обозначим растворимость соли через s (моль/л). Тогда в насыщенном растворе PbI2 cодержится s моль/л ионов Pb 2+ и 2s моль/л ионов I – .

PbI2Pb +2 +2I –
s s 2s
ПР=[Pb 2+ ][I – ] 2 = 4s 3
 ;
;  .
.
Растворимость PbI2, выраженная в г/л, составляет 1,3∙10 -3 ∙461 = 0,6 г/л.
Задача 3.3. Во сколько раз растворимость CaC2O4 в 0,1 М растворе (NH4)2C2O4 меньше, чем в воде?
Решение: Вычислим растворимость CaC2O4 в воде. Пусть концентрация соли в растворе будет s (моль/л), поэтому можем записать



Найдем растворимость этой соли в 0,1 М растворе (NH4)2C2O4; обозначим её через s′. Концентрация ионов Ca 2+ в насыщенном растворе тоже будет s′, а концентрация [C2O4 2– ] составит (0,1+s′), т.к. s′2O4 2– ] = 0,1моль/л. Тогда 
 раз, т.е. в 2200 раз.
раз, т.е. в 2200 раз.
Задача 3.4. Смешаны равные объемы 0,02 н. растворов CaCl2 и Na2SO4; образуется ли осадок CaSO4?
Решение: Найдем произведение концентраций ионов Ca +2 и SO4 2– сравним его с  . Условием выпадения осадка является [Ca 2+ ][SO4 2– ] >
. Условием выпадения осадка является [Ca 2+ ][SO4 2– ] > .
.
Исходные молярные концентрации растворов CaCl2 и Na2SO4 одинаковы и равны 0,01 моль/л, т.к. при смешении исходных растворов общий объем раствора вдвое больше, то концентрация каждого из ионов вдвое уменьшается по сравнению с исходными. Поэтому [Ca 2+ ] = [SO4 2– ] = 5∙10 –3 , находим [Ca 2+ ][SO4 2– ] = 2,5∙10 –5

Поэтому осадок не образуется.
Задача 3.5. Произведение растворимости CaC2O4 = 2∙10 –9 . Найти растворимость этой соли в 0,1 М растворе (NH4)2C2O4.

Решение: Выразим ПРчерез активность ионов:

.
Обозначив искомую растворимость соли через s, находим, что
[Ca 2+ ] = s моль/л, [C2O4 2– ] = 0,1 моль/л. Таким образом,


Вычислим ионную силу раствора (I) 0,1 М раствора (NH4)2C2O4
I = 0,5(0,2∙1 2 +0,1∙2 2 ) = 0,3
Согласно табл. 2 приложения, при этой ионной силе коэффициенты активности двухзарядных ионов равны 0,42. Тогда

.
Задачи для самостоятельной работы:
3.6. Растворимость CaCO3 при 35 о С равна 6,9∙10 –5 моль/л. Вычислить произведение растворимости этой соли.
3.7. Вычислить произведение растворимости PbBr2 при 25 о С, если растворимость соли при этой температуре равна 1,32∙10 –2 моль/л.
3.8. В 500 мл воды при 18 о С растворяется 0,0166 г AgCrO4. Чему равно произведение растворимости этой соли?
3.9. Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
3.10. Исходя из произведения растворимости карбоната кальция, найти массу CaCO3, содержащуюся в 100 мл его насыщенного раствора.
3.11. Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
3.12. Вычислить объем воды, необходимый для растворения при 25 о С 1 г BaSO4.
3.13. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
3.14. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 о С?
3.15. Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
3.16. К 50 мл 0,001 н. раствора HCl добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
3.17. Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3) добавить равный объем 0,4 н. раствора NaCl?
3.18. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl — в растворе стала равной 0,03 моль/л?
3.19. Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
3.20. Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь данными табл. 2 приложения.
3.21. В каком из указанных случаев раствор электролита МХ ненасыщен: а) [M z + ][X z — ] < ПР; б) [M z + ][X z — ] = ПР; в) [M z + ][X z — ] >ПР?
3.22. Обозначим растворимость AgCl в воде, в 0,01 М CaCl2, в 0,01 M NaCl и в 0,05 М AgNO3 соответственно через so, s1, s2 и s3. Какое соотношение между этими величинами правильно: а) so > s1 > s2 > s3; б) so > s2 > s1 > s3; в) so > s1 = s2 > s3; г) so > s2 > s3 > s1?
3.23. К 0,01 н. раствору H2SO4 медленно добавляют раствор, содержащий 0,01 моль/л CaCl2 и 0,01т моль/л SrCl2. Какой осадок начнет выпадать раньше: а) SrSO4; б) CaSO4?
3.24. Произведения растворимости солей NiC2O4 и Na3AlF6 одинаковы (4∙10 -10 ). Какое соотношение между растворимостями (моль/л) этих солей правильно:
а)  >
>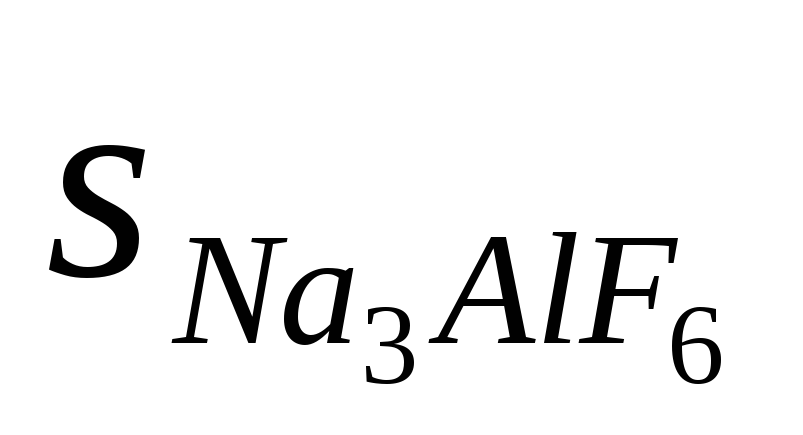 ; б)
; б) =
= ; в)
; в) ?
?
3.25. Произведения растворимости AgBrO3 и Ag2SO4 равны соответственно 5,5∙10 -5 и 2∙10 -5 . укажите правильное соотношение между растворимостями (s, моль/л) этих солей:
а)  ; б)
; б) ≈
≈ ; в)
; в) >
> .
.
3.26. Как изменится растворимость CaF2 в 0,1 М растворе KNO3 по сравнению с его растворимостью в воде:
а) возрастет; б) уменьшится; в) останется неизменной?
Источник: studfile.net
Найти массу серебра находящегося в виде ионов в 1 л насыщенного раствора agcl

October 2021 1 19 Report
Найти, массу серебра, находящегося в виде ионов в 1 л
насыщенного раствора AgBr
Answers
моль/л.
Найдем количество вещества ионов :
моль.
Найдем массу ионов в растворе:
г.
Ответ: г.
15 votes Thanks 31

More Questions From This User See All

zdenis07 October 2021 | 0 Ответы
2oe zadanie esli mozhno s poyasneniyami

zdenis07 October 2021 | 0 Ответы
Источник: scholar.tips