
1,7∙10 –4 моль/л. Найти ПР Mg(OH)2 при этой температуре.
Решение: При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg +2 и вдвое больше ионов ОН – .
Следовательно, в насыщенном растворе Mg(OH)2
[Mg 2+ ] = 1,7∙10 -4 моль/л; [OH – ] = 3,4∙10 – 4 моль/л.
Задача 3.2. . Вычислить растворимость соли (в моль/л и в г/л) при указанной температуре.
Решение: Обозначим растворимость соли через s (моль/л). Тогда в насыщенном растворе PbI2 cодержится s моль/л ионов Pb 2+ и 2s моль/л ионов I – .
s s 2s
ПР=[Pb 2+ ][I – ] 2 = 4s 3
Растворимость PbI2, выраженная в г/л, составляет 1,3∙10 -3 ∙461 = 0,6 г/л.
Задача 3.3. Во сколько раз растворимость CaC2O4 в 0,1 М растворе (NH4)2C2O4 меньше, чем в воде?
Решение: Вычислим растворимость CaC2O4 в воде. Пусть концентрация соли в растворе будет s (моль/л), поэтому можем записать
Найдем растворимость этой соли в 0,1 М растворе (NH4)2C2O4; обозначим её через s′. Концентрация ионов Ca 2+ в насыщенном растворе тоже будет s′, а концентрация [C2O4 2– ] составит (0,1+s′), т.к. s′2O4 2– ] = 0,1моль/л. Тогда ; s′=2∙10 –8 моль/л. Следовательно, в присутствии (NH4)2C2O4 растворимость СaC2O4 уменьшилась в раз, т.е. в 2200 раз.
Растворимость веществ. Виды растворов. Насыщенность растворов.
Задача 3.4. Смешаны равные объемы 0,02 н. растворов CaCl2 и Na2SO4; образуется ли осадок CaSO4?
Решение: Найдем произведение концентраций ионов Ca +2 и SO4 2– сравним его с . Условием выпадения осадка является [Ca 2+ ][SO4 2– ] > .
Исходные молярные концентрации растворов CaCl2 и Na2SO4 одинаковы и равны 0,01 моль/л, т.к. при смешении исходных растворов общий объем раствора вдвое больше, то концентрация каждого из ионов вдвое уменьшается по сравнению с исходными. Поэтому [Ca 2+ ] = [SO4 2– ] = 5∙10 –3 , находим [Ca 2+ ][SO4 2– ] = 2,5∙10 –5
Поэтому осадок не образуется.
Задача 3.5. Произведение растворимости CaC2O4 = 2∙10 –9 . Найти растворимость этой соли в 0,1 М растворе (NH4)2C2O4.
Решение: Выразим ПР через активность ионов:
Обозначив искомую растворимость соли через s, находим, что
[Ca 2+ ] = s моль/л, [C2O4 2– ] = 0,1 моль/л. Таким образом,
Вычислим ионную силу раствора (I) 0,1 М раствора (NH4)2C2O4
I = 0,5(0,2∙1 2 +0,1∙2 2 ) = 0,3
Согласно табл. 2 приложения, при этой ионной силе коэффициенты активности двухзарядных ионов равны 0,42. Тогда
Задачи для самостоятельной работы:
3.6. Растворимость CaCO3 при 35 о С равна 6,9∙10 –5 моль/л. Вычислить произведение растворимости этой соли.
3.7. Вычислить произведение растворимости PbBr2 при 25 о С, если растворимость соли при этой температуре равна 1,32∙10 –2 моль/л.
3.8. В 500 мл воды при 18 о С растворяется 0,0166 г AgCrO4. Чему равно произведение растворимости этой соли?
3.9. Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
3.10. Исходя из произведения растворимости карбоната кальция, найти массу CaCO3, содержащуюся в 100 мл его насыщенного раствора.
Задачи по химии. Растворимость 8
3.11. Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgBr.
3.12. Вычислить объем воды, необходимый для растворения при 25 о С 1 г BaSO4.
3.13. В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
3.14. Во сколько раз растворимость (в моль/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25 о С?
3.15. Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
3.16. К 50 мл 0,001 н. раствора HCl добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
3.17. Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3) добавить равный объем 0,4 н. раствора NaCl?
3.18. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl — в растворе стала равной 0,03 моль/л?
3.19. Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
3.20. Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь данными табл. 2 приложения.
3.21. В каком из указанных случаев раствор электролита МХ ненасыщен: а) [M z + ][X z — ] < ПР; б) [M z + ][X z — ] = ПР; в) [M z + ][X z — ] >ПР?
3.22. Обозначим растворимость AgCl в воде, в 0,01 М CaCl2, в 0,01 M NaCl и в 0,05 М AgNO3 соответственно через so, s1, s2 и s3. Какое соотношение между этими величинами правильно: а) so > s1 > s2 > s3; б) so > s2 > s1 > s3; в) so > s1 = s2 > s3; г) so > s2 > s3 > s1?
3.23. К 0,01 н. раствору H2SO4 медленно добавляют раствор, содержащий 0,01 моль/л CaCl2 и 0,01т моль/л SrCl2. Какой осадок начнет выпадать раньше: а) SrSO4; б) CaSO4?
3.24. Произведения растворимости солей NiC2O4 и Na3AlF6 одинаковы (4∙10 -10 ). Какое соотношение между растворимостями (моль/л) этих солей правильно:
3.25. Произведения растворимости AgBrO3 и Ag2SO4 равны соответственно 5,5∙10 -5 и 2∙10 -5 . укажите правильное соотношение между растворимостями (s, моль/л) этих солей:
3.26. Как изменится растворимость CaF2 в 0,1 М растворе KNO3 по сравнению с его растворимостью в воде:
а) возрастет; б) уменьшится; в) останется неизменной?
Источник: megaobuchalka.ru
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgCl

Готовое решение: Заказ №8424

Тип работы: Задача

Статус: Выполнен (Зачтена преподавателем ВУЗа)

Предмет: Химия

Дата выполнения: 06.09.2020

Цена: 228 руб.
Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора AgCl
Решение :
Хлорид серебра – малорастворимое соединение, в водном растворе частично диссоциирует:
Выражение произведения растворимости:

- Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация ОН- (моль/л) составляет: 10-4; 10-6; 10-8; 10-12;
- Пользуясь справочными данными, установить, возможно ли при температурах 298К самопроизвольно протекать реакции: С12(г.) + 2НI(г) = I2(к.) + 2НС1 (газ)
- Напишите уравнение гидролиза солей: Al2S3, FeS, Pb(NO3)2, CsCl
- Вычислить константу гидролиза фторида натрия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
В случае копирования материалов, указание web-ссылки на сайт natalibrilenova.ru обязательно.
Источник: natalibrilenova.ru
1. 4. Примеры решения задач
Пример 1. Вычислить ПРAgCl, если известно, что насыщенный раствор AgCl содержит 1,8 10 –3 г этой соли в 1л при 25С.
Решение. Определим молярную концентрацию насыщенного раствора AgCl:

,
где МAgCl — молярная масса хлорида серебра, 143 г/моль.
Поскольку каждая молекула AgCl дает при растворении по одному иону Ag + и Cl – , (это так называемый бинарный электролит), то концентрации ионов Ag + и Cl – в насыщенном растворе соли будут такими же:

[AgCl] = [Ag] + = [Cl – ] = моль/л.
Поэтому рассчитываем ПР:

ПРAgCl= [Ag + ] [Cl – ] = .
Пример 2. Вычислить  , если насыщенный раствор при 25С содержит
, если насыщенный раствор при 25С содержит  г этой соли в 1л.
г этой соли в 1л.
Решение. Вычислим молярную концентрацию насыщенного раствора Ag2CrO4:
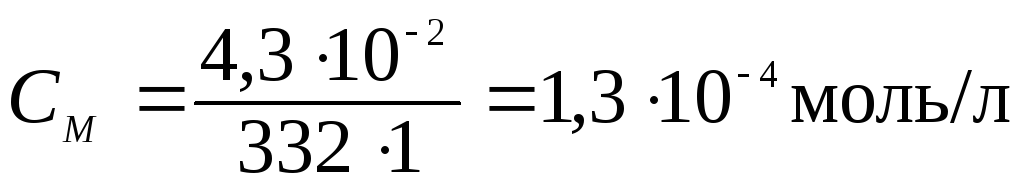
,
где 332 — молярная масса хромата серебра, г/моль.
Так как из одной молекулы Ag2CrO4 при растворении образуется 2 иона Ag + и один ион CrO4 2– :
то их концентрации в насыщенном растворе составят:

[CrO4 2– ] = моль/л ,
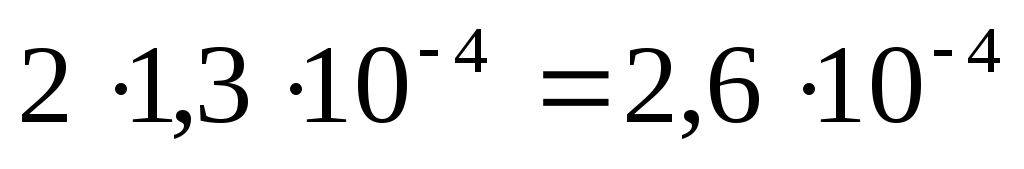
[Ag + ] = моль/л .

ПРAgCl= [Ag + ] 2 ·[CrO4 2– ] = .
Обратите внимание на то, что растворимость AgCl (1,25·10 –5 ) меньше, чем растворимость Ag2CrO4 ( ). Это объясняется тем, что при вычислении
). Это объясняется тем, что при вычислении  приходится возводить в квадрат малую величину — концентрацию ионов Ag + (
приходится возводить в квадрат малую величину — концентрацию ионов Ag + ( ), чего не делается при вычислении ПРAgCl .
), чего не делается при вычислении ПРAgCl .
Таким образом, о сравнительной растворимости каких-либо электролитов можно судить по величинам их произведений растворимости только в тех случаях, когда их формулы построены однотипно: AgCl, BaSO4, CaCO3 или Ag2CrO4, Ag2CO3, PbI2.

Пример 3. Определить растворимость Mg(OH)2 при 25С, если произведение растворимости его равно .
Решение. Примем искомую величину — растворимость Mg(OH)2 за х моль/л.
В результате диссоциации х молей Mg(OH)2 в растворе создаются следующие концентрации ионов:
[Mg +2 ] = x; [OH – ] = 2x .

;

;
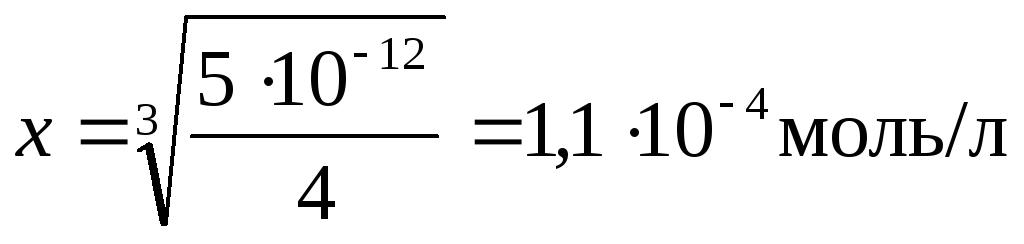
.
Чтобы определить растворимость в г/л, необходимо найденную величину умножить на молярную массу Mg(OH)2, которая равна 58 г/моль:
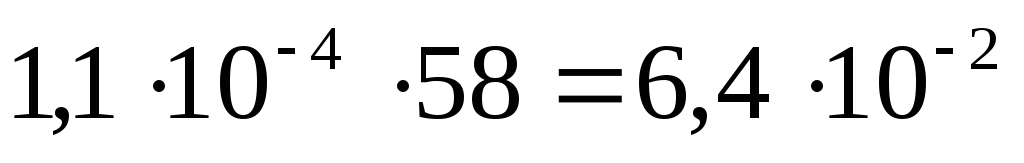
Растворимость Mg(OH)2 = г/л.
Пример 4. Рассчитать растворимость йодата бария Ba(IO3)2 в 0,03 М растворе Ba(NO3)2 приближенно и с учетом коэффициентов активности ионов.
Решение
1) Приближенный расчет
При диссоциации соли на один ион Ва 2+ образуется 2 иона IO – 3:

Поскольку концентрация насыщенного раствора Ba(IO3)2 при температуре 25С равна моль/л, то

[Ba 2+ ] =моль/л;
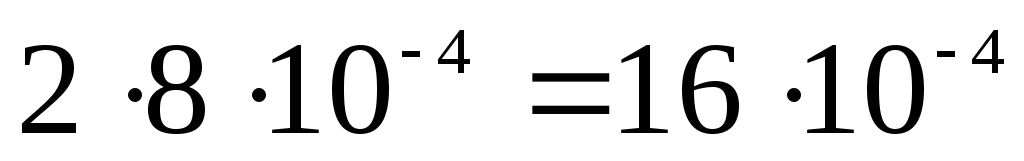
[IO3 – ] =моль/л;

.
Обозначим растворимость Ba(IO3)2 в присутствии Ba(NO3)2 через х моль/л. Тогда концентрация ионов [IO3 – ] = 2х.
Концентрация ионов Ва 2+ складывается из ионов, образующихся при диссоциации раствора Ba(NO3)2 и ионов, образующихся в результате растворения осадка Ba(IO3)2 (их концентрация равна х). Следовательно, в присутствии 0,03М Ba(NO3)2 произведение растворимости Ba(IO3)2 составит:

[Ba +2 ][IO3 – ] 2 = (0,03 + х)(2х) 2 =.
По сравнению с величиной 0,03, величиной х, как очень малой, можно пренебречь; тогда:

0,12х 2 = ,

.
Следовательно, расчет по упрощенной формуле ПР дает, что растворимость Ba(IO3)2 при замене воды 0,03 М раствором Ba(NO3)2 понизится с  моль/л до
моль/л до , т.е. примерно в 6 раз.
, т.е. примерно в 6 раз.
2) Расчет с учетом коэффициентов активности
Произведем вычисления по точной формуле:

Для определения активностей ионов необходимо величины их концентраций умножить на коэффициенты активности. Коэффициенты активности зависят от ионной силы раствора, которая определяется по формуле:

,
где С — молярные концентрация ионов; z — их степень окисления.
Определим ионную силу в насыщенном растворе Ba(IO3)2:

.
Путем интерполяции величин коэффициентов активности, приведенных в таблице Х, найдем, что ионной силе 0,0024 отвечают значения 
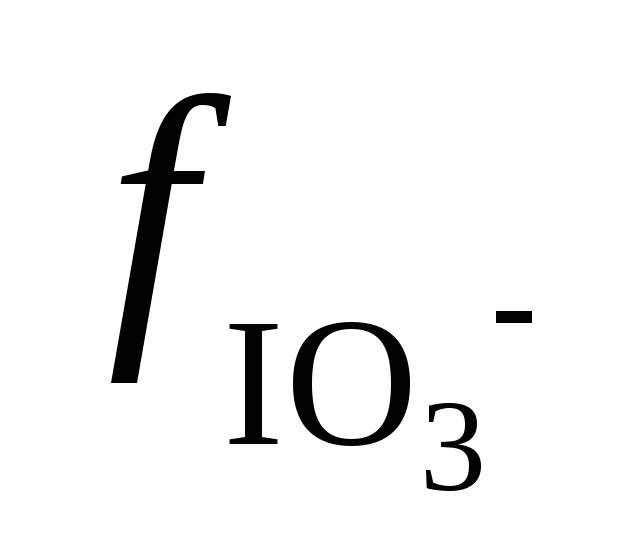 = 0,96.
= 0,96.
Интерполяцию производим следующим образом. Значение = 0,0024 лежит между значениями 0,001 и 0,005, разница между которыми 0,004. Этой разнице в величинах для двухвалентных ионов отвечает уменьшение f от 0,86 до 0,8, т.е. 0,06. Составим пропорцию:
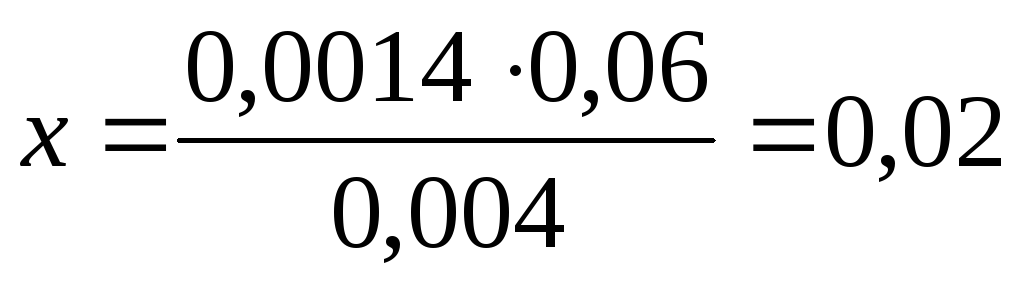
откуда .
fBa 2+ =0,86 – 0,02 = 0,84.
Аналогично производим расчет коэффициент активности для иодат-иона.
Рассчитываем активности ионов:

aBa 2+ =;

aIO3 – =.
Точное значение ПР соли составит:

.

Из найденной точной величины , вычислим растворимостьBa(IO3)2 в 0,03М растворе Ba(NO3)2. Для этого снова определим ионную силу раствора. Поскольку Ba(IO3)2 дает в раствор очень мало ионов по сравнению с Ba(NO3)2, для вычисления ионной силы можно учитывать только присутствие Ba(NO3)2:

.
Этой ионной силе отвечают следующие значения коэффициентов активности ионов: 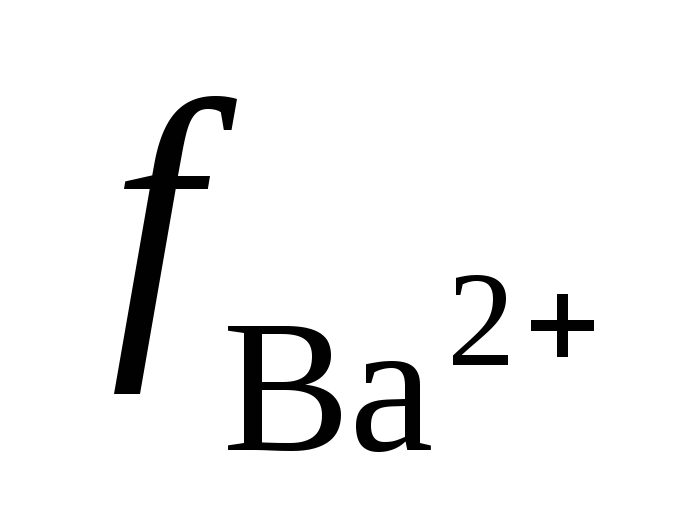 = 0,48;
= 0,48; =0,81.
=0,81.
Обозначим неизвестную нам величину молярной концентрации Ba(IO3)2 через х, при этом [IO3 — ] =2х.
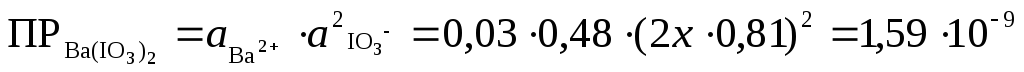
;

х =моль/л.
Таким образом, при точном вычислении получается, что в присутствии 0,03 моль/л Ba(NO3)2 растворимость Ba(IO3)2 понизится с  моль/л до
моль/л до моль/л, т.е. в 4 раза (вместо шестикратного уменьшения, полученного при приближенном расчете).
моль/л, т.е. в 4 раза (вместо шестикратного уменьшения, полученного при приближенном расчете).
Источник: studfile.net